外周血单核细胞在角膜上皮重建的体外研究
王萍 梁丽影 夏婵 张弛
华厦眼科医院集团佛山华厦眼科医院,佛山 528000
角膜是眼球的最外层,与外界环境接触易受到各种伤害,视力的清晰度部分取决于角膜表面的光滑透明,这是由角膜层,特别是角膜上皮所维持的。角膜上皮来源于角膜缘基底上皮层的角膜缘干细胞,这些干细胞的功能障碍或丧失会损害角膜稳态,导致角膜缘干细胞缺乏疾病的发生,可致邻近结膜上皮细胞侵入角膜表面引起角膜混浊、慢性炎症、血管化、角膜瘢痕,甚至视力丧失。目前角膜缘干细胞缺乏疾病的治疗策略包括健康对侧眼角膜缘干细胞移植或异体角膜移植。自体角膜缘干细胞移植适用于单侧角膜缘干细胞缺乏患者,而对于双侧角膜缘干细胞缺乏患者,有效治疗需要免疫相关供体,且存在免疫排斥和供体短缺的问题。因此,需要相应的替代治疗,其中之一是确定治疗角膜表面损伤的替代干细胞来源。最近的研究表明,间充质干细胞成功地应用于各种以细胞为基础的治疗中,是一类自我更新的前体细胞,具有抗炎和低免疫原性,容易从不同的组织类型[1-2]中获得。据文献报道,外周血单核细胞[3-4]具有与骨髓间充质干细胞[1]相似的生物学特征,易于获取及体外进行扩增,且比其他干细胞[5]来源更安全,可作为角膜上皮重建的替代干细胞来源[6]。关于外周血单核细胞的使用及其从血液中分离报道较少,但近期其作为再生治疗的干细胞来源引起了学者的关注。本研究旨在从小体积外周血中分离和鉴定单核细胞,收集单核迁移细胞,并研究单核迁移细胞是否具备替代角膜缘干细胞的潜能而用于角膜疾病治疗。
材料与方法
1、材料
1.1、实验动物 实验时间为 2020 年 1 月至 2021 年1 月,实验用5~8 月龄健康新西兰大白兔30 只,体质量2.0~2.5 kg,雌雄不限,来自暨南大学生理实验室,所有大白兔均在无病原体的动物房喂养,均符合动物伦理委员会要求,同时获得暨南大学动物伦理会批准。
1.2、主要试剂和仪器 LG-DMEM/F12培养基(Gibco);CD14 单克隆抗体(Sigma);兔抗小鼠细胞角蛋白单克隆抗体(cytokeratin,Sigma);山羊抗小鼠二抗(LFSC-H,Sigma);二氧化碳细胞培养箱(美国Thermo 公司);Transwell 共培养体 系 装 置(Millipore);32R 离 心 机(Hettich);Eclipse TE2000-u 倒置相差显微镜(尼康公司);流式细胞仪(美国Beckman公司)。
2、方法
2.1、外周血单核细胞分离与培养 (1)取实验用大白兔耳缘静脉血10 ml移入自带肝素的专用取血管,用10 ml磷酸盐缓冲液(PBS)将其稀释1倍后移入无菌离心管内。(2)按照制造商的说明,使用Histopaque-1077(Sigma-Aldrich,美国)进行密度梯度离心,获得单核细胞。即取1 支容量为50 ml的离心管,将10 ml(体积质量为1.077 g/ml)Ficoll-Paque 淋巴细胞分离液加入其内,然后用吸管将刚获取的20 ml 细胞混液沿管壁转移到分离液层上,并置于离心机内,转速2 000 r/min,离心时间25 min(离心半径90 mm)。(3)取出离心管,吸除表面稀释的血浆,收集中央呈絮状的细胞,将其移入另一支离心管中置于离心机内离心5 min。(4)离心结束后吸除上清,收集离心细胞重悬于基本培养基,即含有10%胎牛血清和100 IU/ml青霉素-链霉素(Gibco Invitrogen,美国)的LG-DMEM/F12 中,将细胞浓度调整为10×104接种于T25 培养瓶中后置于培养箱中孵育,待细胞贴服于培养瓶壁后更换培养液,待细胞间融合达80%以上消化离心后获取细胞悬液用于本研究。
2.2、单核细胞形态观察及鉴定
2.2.1、倒置相差显微镜观察 将新鲜差速离心获取的单核细胞悬液与在培养箱中培养3 d后的贴壁单核细胞,分别置于相差显微镜下对比前后细胞形态是否有所改变,见图1。
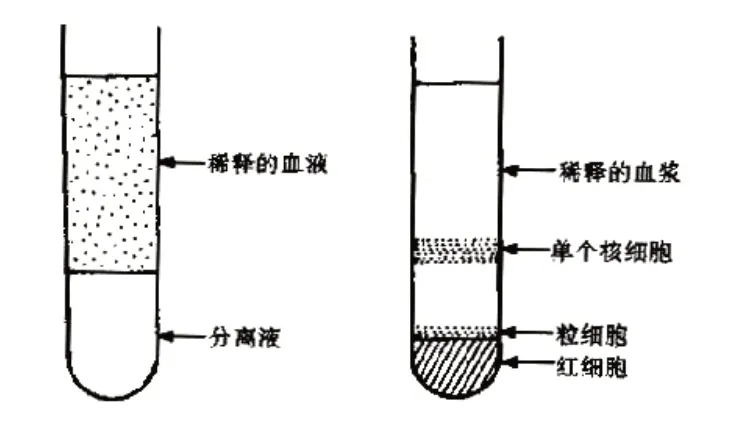
图1 外周血单核细胞密度梯度离心分离方法示意图
2.2.2、流式细胞术外周血单核细胞表面抗原鉴定 取第3 代单核细胞用胰蛋白酶消化,用4%多聚甲醛取代培养基,将细胞固定在悬浮液中,用0.1% Triton X-100(Sigma)渗透细胞5 min,细胞与一抗(CD14)在室温下孵育1 h,用PBS 冲洗后与二抗(抗小鼠FSC-H)孵育1 h。细胞重悬于PBS 中,流式细胞仪分选检测阳性细胞,Cell-Quest 软件分析计算单核细胞阳性率。
2.3、取带有角膜缘和角膜上皮的组织块 实验用新西兰大白兔耳缘静脉处空气处死,取其新鲜眼球放入含青/链霉素PBS 中浸泡30 min 后,再用含庆大霉素的PBS 反复冲洗干净。将处理好的眼球放置于无菌超净台,大头针固定眼球,用眼科穿刺刀在12点位角膜缘做一个3 mm浅层切口后分离前板层组织,分离角膜缘区域,剪下带有角膜缘和角膜上皮的组织块,用含抗生素的PBS 冲洗3 遍后,切成小块放入Transwell共培养体系上室内。
2.4、将单核迁移细胞与组织块在Transwell 体系共培养 在Transwell共培养体系中将收集到的单核迁移细胞与带有角膜缘和角膜上皮的组织块共同培养7 d,上室放置新鲜组织块,下室为单核迁移细胞。将实验分为两组,实验组:与含有角膜缘和角膜上皮的组织块在Transwell 体系内共培养7 d;对照组:在Transwell 共培养体系中上室仅有基础培养液,无组织块,下室为单核迁移细胞,在此环境下共培养7 d。收集实验组、对照组第1 天与第7 天细胞,各制备成细胞悬液,流式细胞仪检测其表面特异标志物:细胞角蛋白,观察共培养前与共培养后细胞表面特异抗原细胞角蛋白表达是否有所改变。
2.5、共培养单核细胞的观察和鉴定
2.5.1、相差显微镜观察 细胞生长情况倒置相差显微镜观察Transwell 共培养体系中共培养7 d 后单核迁移细胞的形态数量改变。
2.5.2、诱导前流式细胞术检测阳性细胞 实验组:收集共培养前的单核迁移细胞,用0.1% TritonX-100(Sigma)渗透细胞5 min,细胞与抗细胞角蛋白一抗在室温下孵育1 h,用PBS 冲洗后与二抗(抗小鼠FSC-H)孵育1 h;对照组:采用二抗(抗小鼠FSC-H)孵育1 h,流式细胞仪分选单个阳性细胞,Cell-Quest软件分析计算单核细胞阳性率。
2.5.3、诱导后流式细胞术检测阳性细胞 实验组:将在Transwell 体系中已培养7 d的细胞消化离心制成细胞悬液,用0.1%TritonX-100(Sigma)渗透细胞5 min,细胞与抗细胞角蛋白一抗在室温下孵育1 h,用PBS 冲洗后与二抗(抗小鼠FSC-H)孵育1 h;对照组:采用FSC-H 二抗单独避光孵育,流式细胞仪检测分选阳性细胞,Cell-Quest 软件统计分析阳性细胞率。
3、统计学分析
用SPSS 21.0 统计软件包处理数据,诱导前与诱导后细胞表面细胞角蛋白阳性表达率指数的组间比较,采用重复测量设计的方差分析,符合正态分布的计量资料以()表示,组间采用独立样本t检验,组内采用配对t检验,以P<0.05为差异有统计学意义。
结 果
1、单核细胞形态观察与鉴定
倒置相差显微镜观察单核细胞形态见图2,图2A 为差数离心分离的单核细胞悬液,图2B 为在适宜培养条件下单核细胞呈贴壁生长。经流式细胞仪分析单核细胞表面特异抗原CD14的阳性表达率为19.40%,见图3。

图2 倒置相差显微镜观察单核细胞形态(×20)。A为单核细胞悬液,B为单核细胞贴壁生长
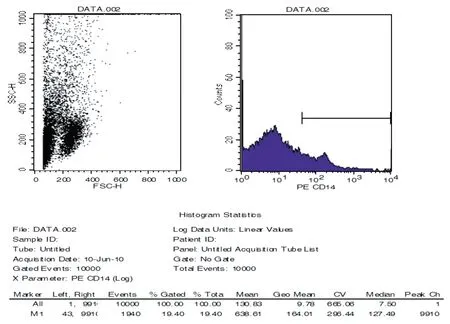
图3 流式细胞术检测单核细胞表面特异抗原CD14的阳性表达率
2、微环境诱导细胞形态和其特异表面抗原阳性率改变情况
将在Transwell 共培养体系中培养7 d 的细胞放置于倒置相差显微镜观察见图4,细胞呈多数量多形态生长,细胞形态异质,包含多种细胞类型,呈成纤维样和鹅卵石形细胞。实验组诱导细胞表面特异抗原细胞角蛋白阳性率在诱导前为1.64%,在Transwell 体系中与新鲜角膜缘和角膜上皮细胞共培养7 d 后,细胞表达的细胞角蛋白阳性率为11.30%;对照组第1 天细胞表面特异抗原细胞角蛋白阳性率为1.42%,第7天细胞表面特异抗原细胞角蛋白阳性率为2.35%。见图5、6。
图4 倒置相差显微镜观察在Transwell共培养体系中细胞呈多形态生长(×20)
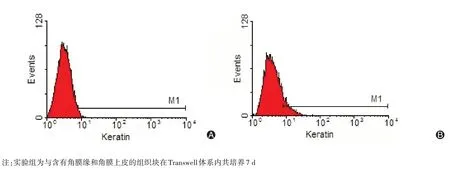
图5 实验组细胞诱导前与诱导后流式细胞术细胞角蛋白检测(A 为诱导前细胞表面细胞角蛋白阳性率1.64%,B 为诱导后细胞表面细胞角蛋白阳性率11.30%)
3、微环境培养对单核迁移细胞诱导分化的影响
将实验数据进行统计学分析,诱导前,实验组细胞角蛋白阳性表达率与对照组比较,差异无统计学意义(P>0.05);对照组诱导前细胞角蛋白阳性表达率与诱导7 d后比较,差异无统计学意义(P>0.05);实验组诱导前细胞角蛋白阳性表达率与诱导7 d 后比较,差异有统计学意义(P<0.05),这说明实验组细胞表面特异标志物细胞角蛋白阳性率随着共培养时间递增呈现递增趋势;诱导7 d 后,实验组细胞角蛋白阳性表达率与对照组比较,差异有统计学意义(P<0.05),这说明两组细胞角蛋白阳性表达率随时间变化的趋势有差异。见表1。
表1 流式细胞术检测诱导前与诱导后细胞角蛋白阳性表达结果(%,)

表1 流式细胞术检测诱导前与诱导后细胞角蛋白阳性表达结果(%,)
注:实验组为与含有角膜缘和角膜上皮的组织块在Transwell体系内共培养7 d;对照组为在Transwell 共培养体系中上室仅有基础培养液,无组织块,下室为单核迁移细胞,在此环境下共培养7 d
组别实验组对照组t值P值n 15 15诱导前1.308±0.376 1.327±0.392 0.135 0.893诱导7 d后10.298±0.996 1.786±0.237 32.200<0.001 t值32.705 1.942 P值<0.001 0.063
讨 论
角膜是眼球的最外层,易受到热或化学损伤、感染等引起的各种伤害,角膜上皮是抵御外界损伤的第一道屏障,其更新和修复主要依赖于一类被称为角膜缘干细胞(LSCs)的特殊干细胞的增殖来补充。LSCs存在于角膜缘基底部黑色素丰富的Vogt 栅栏区,可分化为短暂扩充细胞及终末上皮细胞,是角膜上皮细胞增殖的主要来源,用于维持角膜上皮结构和功能的完整[7]。任何损伤都会影响其正常的再生机制,导致角膜缘干细胞缺乏,角膜上皮持续缺损,血管化结膜上皮向角膜内生长,角膜混浊,视力下降甚至失明。目前对于严重眼表疾病的主要治疗方式为穿透性角膜移植或角膜缘组织移植,穿透性角膜移植术后因为需要长时间使用免疫抑制剂而引起局部或全身并发症,也可能因为炎症或新生血管产生排斥反应致使移植失败,而且存在供体来源有限等问题,限制了该项治疗的临床应用。大多数严重的角膜缘损伤病例,如双侧角膜缘干细胞缺乏,其角膜缘干细胞或角膜缘组织移植治疗材料是异体来源的,这些方法存在缺乏健康供体组织和免疫排斥反应的风险,需要免疫抑制治疗[8]。自体干细胞来源的替代细胞可以在眼表重建中发挥重要作用,因其避免了免疫排斥的风险,且可从健康的个体[9]中获得。
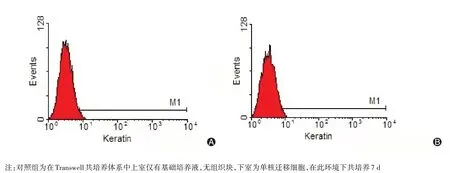
图6 对照组细胞诱导前与诱导后流式细胞术细胞角蛋白检测(A为第1天细胞表面细胞角蛋白阳性率1.42%,B为第7天细胞表面细胞角蛋白阳性率2.35%)
干细胞在角膜疾病的应用是近年来眼科领域研究热点之一,包括上皮、间充质、胚胎和诱导多能干细胞[10-11]。间充质干细胞,特别是脂肪和骨髓干细胞已经显示出其极大的分化潜能[12-13],然而大多数情况下,其收集过程涉及侵入性手术,感染的高风险以及由此带来的疼痛感。由于这些缺点,外周血单核细胞在组织工程应用中易于分离和获取是优于其他细胞来源的,具有表达角膜上皮标志物潜能的单核细胞可能是替代非角膜缘干细胞的又一来源,作为体内重要的成体干细胞,具有取材方便、易于体外培养、体外易保持生物活性等优点[14-15]。外周血单核细胞具有间充质干细胞的形态学特征,且可分化为多种细胞,具有往中胚叶和神经外胚叶分化的潜能,其分化潜能及方向很大程度受其所处干细胞微环境的影响和调控[16]。当单核细胞生长微环境发生改变,细胞外的信号传递至细胞内触发信号转导调控基因表达,从而改变其分化方向。本实验主要研究单核细胞在一定微环境诱导下是否具备往角膜上皮分化的潜能。
根据分化标志物外周血单核细胞广泛表现为CD14 阳性[17],单核细胞表达了与间充质干细胞相似的标志物,可以被认为是其亚类[18]。这些血液来源的细胞也被称为循环间充质干细胞,从骨髓和其他部位动员到血液。我们观察到这些细胞大多是CD14阳性,本实验中流式细胞仪测得单核细胞表面特异抗原CD14 表达阳性率是19.40%,单核迁移细胞表达细胞角蛋白的阳性率为1.64%。为了证明其表现出具有类似间充质干细胞的特性,并且易于分离,我们进一步分析以确定其向角膜上皮分化的潜能。角膜上皮的分化是通过用角膜缘干细胞微环境培养来实现的。免疫细胞化学研究表明,细胞角蛋白是一种在脊椎动物中局限于角膜上皮细胞的终末分化标志物,在角膜缘微环境培养诱导时细胞角蛋白表达上调,表明单核迁移细胞具有往角膜上皮谱系分化的潜力,其潜能可以考虑将其作为角膜再生治疗中角膜缘干细胞的替代细胞来源。
本实验将收集的单核迁移细胞置于Transwell共培养体系中,与带有角膜缘和角膜上皮的组织块共培养7 d,观察诱导后的细胞是否具备往角膜上皮细胞分化的潜能,流式细胞仪检测诱导前与诱导后细胞表面特异性标志蛋白细胞角蛋白表达阳性率变化情况。通过实验结果可以观察到诱导前流式细胞仪检测单核迁移细胞表达细胞角蛋白的阳性率为1.64%,在Transwell 体系中与新鲜角膜缘和角膜上皮细胞共培养7 d 后,细胞表达的细胞角蛋白阳性率为11.30%。角膜上皮细胞来源于外胚层,细胞角蛋白为其特异标志物,实验组单核迁移细胞共培养诱导后细胞角蛋白阳性表达率由1.64%改变为11.30%,对照组单核迁移细胞的细胞角蛋白阳性表达率未见统计学意义。通过重复测量设计的方差分析显示,单核迁移细胞在微环境诱导下细胞角蛋白阳性率有所变化,时间效应也有统计学意义。
通过本实验可以初步得出结论,单核迁移细胞在特定的诱导条件下,可能具备往角膜上皮分化的潜能。使用单核迁移细胞作为自体干细胞替代细胞来源是治疗双侧角膜缘干细胞缺乏疾病的一种合乎逻辑和可实施的方法,同时表现出多谱系分化潜力,这使得该细胞来源在不久的将来成为重要的研究热点。
利益冲突所有作者均声明不存在利益冲突

