突出价值引领 推进教考衔接
——2022年高考全国甲卷理综化学试题评析
章宪华 汤 伟(正高级教师)
2022年高考全国甲卷理综化学试题能够较好地落实立德树人根本任务,突出价值引领,试题设计依据课程标准,着意关联教材,深化基础考查,推进教考衔接,助推“双减”工作.本文针对2022年高考甲卷理综化学试题特点举例分析说明.
1 回归学科主干知识,助推“双减”工作
2022年高考是国家提出“双减”政策后的第一次高考,甲卷化学试题能够较好地体现“回归学科主干,注重基础知识考查,助推‘双减’工作开展”理念.如第26题化工生产流程题中涉及Mg、Zn、Fe、Ca、Cu等元素化合物的考查,这些几乎都是教材中考生所熟知的;第7题中考查的化学与生活知识点也均是教材中学生熟识的漂白粉、二氧化碳、棉麻、蚕丝等物质.从整体看,无偏题、难题、怪题,考查点为离子反应、氧化还原反应、原电池、NA常数的经典计算、化学实验、化学反应原理及其应用等,这些均是中学化学主干知识.
例1(第9题)能正确表示下列反应的离子方程式为( ).


该试题重点考查中学化学主干知识中的离子反应与氧化还原反应.HNO3具有强氧化性,易氧化S2-,硫化钠溶液和硝酸混合难以生成H2S,选项A 错误.明矾溶液与过量氨水混合时Al3+仅仅转化为Al(OH)3沉淀,不会转化为AlO-2,选项B错误.硅酸钠溶液中通入二氧化碳,SiO2-3转化为H2SiO3沉淀,不会转化为HSiO-3,选项C 错误.将等物质的量浓度的Ba(OH)2和NH4HSO4按照物质的量之比1∶2在溶液中混合时,发生的离子反应为

选项D 正确.答案为D.
例2(第12题)Q、X、Y、Z 是原子序数依次增大的短周期主族元素,其最外层电子数之和为19.Q 与X、Y、Z位于不同周期,X、Y相邻,Y原子最外层电子数是Q 原子内层电子数的2倍.下列说法正确的是( ).
A.非金属性:X>Q
B.单质的熔点:X>Y
C.简单氢化物的沸点:Z>Q
D.最高价含氧酸的酸性:Z>Y

该试题重点考查与元素周期律(表)相关知识点.根据“Q 与X、Y、Z不在同一周期,Y 原子最外层电子数为Q 原子内层电子数的2倍”,可以推出Q 为第二周期元素,X、Y、Z位于第三周期,Y 的最外层电子数为4,则Y 为Si元素,X、Y 相邻,则X为Al元素,根据“Q、X、Y、Z 的最外层电子数之和为19”,可以推出Q、Z的最外层电子数之和为19-3-4=12,由此讨论:若Q 为F 元素,则Z 为P 元素;若Q 为O 元素,则Z为S元素;若Q 为N 元素,则Z为Cl元素.综上所述,Q 为N 或O 或F,X 为Al,Y 为Si,Z为Cl或S或P.根据元素周期律,可以得出非金属性Q>X,选项A 错误.Si为原子晶体(或共价晶体),Al属于金属晶体,单质熔点:Si>Al,选项B 错误.Q 为N 或O 或F,其简单氢化物为H2O 或NH3或HF,Z 为Cl或S 或P,其简单氢化物为HCl或H2S或PH3,由于前者物质中存在分子间氢键,故沸点Q>Z,选项C错误.P、S、Cl的非金属性均强于Si,故最高价含氧酸酸性:Z>Y,选项D 正确.答案为D.
2 依据课程标准特点,凸显价值引领
2022年高考甲卷理综化学试题能够以课程标准为依据,以中国高考评价体系为宗旨,突出化学学科核心素养,考查学生必备知识和关键能力,试题选材贴近生活和生产实际,引导学生认识化学与生命健康、材料发展、科技进步的紧密关系,较好地体现了以化学学科素养为导向的“素养与情境”“问题与知识”的相互联系,如第7题与第8题结合化学与生活的考查,渗透“科学态度与社会责任”核心素养,第26题通过制备硫酸锌的化工生产流程,不仅让考生知晓了ZnSO4在防腐、电镀、医学上有诸多应用,还明确了如何运用化学原理解决实际化工生产中所遇到的各种问题,较好地凸显了学科价值的引领作用.
例3(第7题)化学与生活密切相关.下列叙述正确的是( ).
A.漂白粉与盐酸可混合使用以提高消毒效果
B.温室气体是形成酸雨的主要物质
C.棉花、麻和蚕丝均为碳水化合物
D.干冰可用在舞台上制造“云雾”

漂白粉的有效成分次氯酸钙,可以氧化盐酸生成有毒的氯气,两者不宜混合使用,选项A 错误.二氧化碳不是形成酸雨的主要物质,形成酸雨的物质一般是硫的氧化物、氮的氧化物,选项B 错误.棉花、麻来源于植物,主要成分均是纤维素,属于多糖,但蚕丝主要成分是蛋白质,选项C 错误.干冰是固态的二氧化碳,干冰升华时,吸收大量的热,易形成“云雾”效果,选项D 正确.答案为D.
例4(第26题)硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用.硫酸锌可由菱锌矿制备.菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物.其制备流程如图1所示.
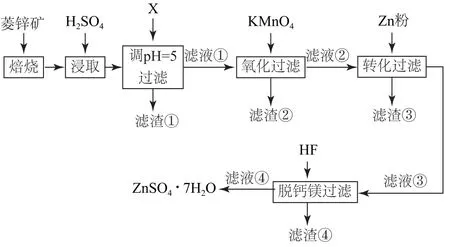
图1
本题所涉及离子的氢氧化物溶度积常数如表1所示.

表1
回答下列问题:
(1)菱锌矿焙烧生成氧化锌的化学方程式为________.
(2)为了提高锌的浸取效果,可采取的措施有________、________.
(3)加入物质X 调溶液pH=5,最适宜使用的X是_________(填标号).
A.NH3·H2O B.Ca(OH)2C.NaOH
滤渣①的主要成分是______、______、______.
(4)向80~90 ℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该步反应的离子方程式为________.
(5)滤液②中加入锌粉的目的是_________.
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是_________、_______.

该试题通过化工生产流程综合考查元素化合物、反应原理、化学实验等知识点.
(1)菱锌矿的主要成分为ZnCO3,焙烧时主要发生的反应为ZnCO3
(2)加入H2SO4酸浸,为了提高锌的浸取效果,可以将焙烧后的产物碾碎,增大接触面积,也可以适当增大硫酸的浓度等.
(3)酸浸后得到含Zn2+、Ca2+、Mg2+、Fe2+、Fe3+、Cu2+的溶液,结合表格数据及流程图信息分析,加入物质X 调节pH=5,为防止引入杂质难以清除,最适宜使用的X 为Ca(OH)2;过滤得到滤渣①为Fe(OH)3、CaSO4、SiO2.
(4)滤液①中Fe2+与KMnO4溶液反应,离子反应为3Fe2+++7H2O =3Fe(OH)3↓+MnO2↓+5H+.
(5)滤液②中加入锌粉,发生反应Zn+Cu2+=Zn2++Cu,通过置换反应将Cu2+转化为Cu 从而除去.
(6)滤渣④为CaF2、MgF2,与浓H2SO4反应后可以释放HF 并循环利用,同时得到的副产物是CaSO4、MgSO4.
3 着意关联教材,推进教考衔接
2022年高考甲卷理综化学试题素材情境取材广泛,但都与教材密切相关,试题尽可能将社会生产实践与中学教材中的化学原理结合,充分体现化学学科推动科技发展和人类社会进步的重要作用,凸显化学学科的社会价值,且能够有效地推进教考衔接.如第8题有机物辅酶Q10的性质考查体现了化学研究成果在保障人类健康中的作用,第10题新型电池的考查彰显了我国科研工作者的研究成果,第28题将生产金属钛的方法与中学化学教材相结合,较好地考查了化学热力学与化学动力学知识,第35题考查北京冬奥会场馆使用的高分子材料的结构与性质的关系,凸显了我国化学新材料的研发应用.
例5(第10题)一种水性电解液Zn-MnO2离子选择双隔膜电池如图2所示(KOH 溶液中,Zn2+以存在).电池放电时,下列叙述错误的是( ).

图2
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
C.MnO2电极反应:MnO2+2e-+4H+=Mn2++2H2O
D.电池总反应:Zn+4OH-+MnO2+4H+=Zn(OH+Mn2++2H2O

该试题情境取自2020年3月天津大学钟澄教授、胡文彬教授团队所研究的成果“电解液去耦合获得稳定、高能可充电水系Zn-MnO2电池”,试题将我国科研成果与中学化学教材有机结合,有效地推进了教考衔接.根据图示的电池结构和题目所给信息可知,Ⅲ区Zn 为电池的负极,电极反应为Zn-2e-+4OH-=,Ⅰ区MnO2为电池的正极,电极反应为MnO2+2e-+4H+=Mn2++2H2O,选项C正确.根据电池中阴、阳离子移动特点,Ⅱ区的K+通过隔膜向正极移动,不可能向Ⅲ区迁移,选项A 错误.Ⅰ区的通过隔膜向Ⅱ区迁移,选项B正确.该电池正极与负极反应相加就是该电池的总反应,即Zn+4OH-+MnO2+4H+=Mn2++2H2O,选项D 正确.答案为A.
例6(第28题)金属钛(Ti)在航空航天、医疗器械等领域有着重要用途,目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛.回答下列问题:
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法.在1000 ℃时反应的热化学方程式及其平衡常数如下.
(ⅰ)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH1=172kJ·mol-1,Kp1=1.0×10-2.

①反应2C(s)+O2(g)=2CO(g)的ΔH为_________kJ·mol-1,Kp=_________Pa.
②碳氯化的反应趋势远大于直接氯化,其原因是_________.
③对于碳氯化反应:增大压强,平衡________移动(填“向左”“向右”或“不”);温度升高,平衡转化率_________(填“变大”“变小”或“不变”).
(2)在1.0×105Pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应.体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图3所示.

图3
①反应C(s)+CO2(g)=2CO(g)的平衡常数Kp(1400 ℃)=_________Pa.
②图中显示,在200 ℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是_________.
(3)TiO2碳氯化是一个“气—固—固”反应,有利于TiO2-C“固—固”接触的措施是_________.

该试题重点考查化学热力学与化学动力学相关知识点,能力角度注重信息的提取与运用,试题也较好地体现了选拔性.
(1)①根据盖斯定律,将“反应ⅱ-反应ⅰ”得到反应2C(s)+O2(g)=2CO(g),则ΔH=-51kJ·mol-1-172kJ·mol-1=-223kJ·mol-1;则Kp==1.2×1014Pa;②碳氯化的反应趋势远大于直接氯化,因为碳氯化反应气体分子数增加,ΔH小于0,是熵增、放热过程,根据ΔH-TΔS<0的特点,可以得出该反应易自发进行,反应趋势较大,而直接氯化的体系气体分子数不变且是吸热过程,难以自发进行,反应趋势较小;③根据平衡移动原理,增大压强,平衡向气体分子数减少的方向移动,即“碳氯化反应”平衡向左移动;碳氯化反应是放热反应,温度升高,平衡向吸热方向移动,即向左移动,则平衡转化率变小.
(2)①根据图示信息,可以得出1400 ℃,体系中气体平衡组成比例CO2是0.05,TiCl4是0.35,CO是0.6,反应C(s)+CO2(g)=2CO(g)的平衡常数Kp(1400 ℃)=7.2×105Pa;②实际化工生产中需要综合考虑各种因素以达到最佳效益,如反应速率问题,实际反应温度远高于200 ℃,就是为了提高反应速率,在相同时间内得到更多的TiCl4产品.
(3)固体颗粒越小,比表面积越大,反应接触面积越大,反应速率越快.若要有利于TiO2-C“固—固”接触,可将两者粉碎后混合,同时鼓入Cl2,使固体粉末“沸腾”,增大接触面积.
(完)

