miR-524-5p调控FOXD3对甲状腺癌细胞增殖凋亡及上皮间质转化的影响*
殷鹏昌, 赵良柱, 闫红印
平煤神马集团总医院普外科(河南平顶山 461700)
近年来,内分泌恶性肿瘤甲状腺癌是女性常见癌症,随着临床对颈部超声检查及超声引导下的细针穿刺活检广泛应用,其检出率迅速增加[1-2]。据统计,甲状腺癌在2000年检出率为每10万人中的10.3人,到2012年已增长至每10万人中的21.5人[3]。而流行病学统计数据显示,全球每年新增及死亡的甲状腺癌病例约有56.72万例及4.11万例[2]。尽管以外科手术、内分泌治疗和放射性核素131I为主的治疗手段已达到较好的总生存率,但复发、转移仍易导致治疗失败[4]。故寻找与甲状腺癌复发、转移有关的发生机制,以降低治疗失败率,对改善患者生存具有重要意义。上皮间质转化(epithelial mesenchymal transition,EMT)与肿瘤复发或发生远方转移密切相关,是上皮细胞向间质细胞转化的过程[5-6]。叉头框D3蛋白(forkhead box D3,FOXD3)是叉头框转录因子(forkhead box,FOX)蛋白家族成员之一,可以参与调控糖类代谢、免疫调节、细胞周期调控等多个过程,与上皮性卵巢癌等肿瘤的进展相关[7]。微小RNA(microRNA,miRNA)可通过沉默靶基因,在癌症发生、发展中发挥重要的调控作用[8]。研究报道,miR-524-5p能调节胃癌细胞的增殖和转移,增强胃癌细胞的顺铂敏感性,并阻止甲状腺癌进展,是靶向多种类型癌细胞中多个基因的癌症抑制物[9-10],但其在甲状腺癌中的具体作用机制还有待深入研究。本研究于2020年3—10月开展研究,探讨miR-524-5p调控FOXD3对甲状腺癌细胞SW579增殖、凋亡及EMT的影响。
1 材料与方法
1.1 主要试剂与仪器 人甲状腺癌细胞SW579(美国ATCC细胞库,货号:HZ-CC100702);qRT-PCR试剂盒(美国Promega公司,货号:K1002S);negative control-miR-524-5p、hsa-miR-524-5p mimic、FOXD3 siRNA序列及miR-524-5p、FOXD3、U6、GAPDH引物均由生工生物工程(上海)股份有限公司合成;CCK-8试剂(日本同仁化学研究所,货号:CK-04);AnnexinV-FITC/PI试剂盒购自哈尔滨新海基因检测,货号:S0185;FOXD3抗体(货号:ab64807)、E-钙黏蛋白(E-cadherin)抗体(货号:ab231303)、N-钙黏蛋白(N-cadherin)抗体(货号:ab76057)、波形蛋白(Vimentin)抗体(货号:ab24525)、纤连蛋白(Fibronectin)抗体(货号:ab2413)、GAPDH抗体(ab181602)(美国abcam);ABI 7500 qRT-PCR仪(美国Applied Biosystems);MODEL550酶标仪(美国Bio-Rad)。研究经我院伦理委员会审核批准(202001-04)。
1.2 方法
1.2.1 细胞培养 SW579细胞复苏后,用RPMI-1640培养基常规培养,并消化、传代。
制备SW579细胞单细胞悬液,接种96孔培养板(1×104个/孔),分为:空白对照组、mimic NC组、miR-524-5p mimic组、siRNA NC组和共转染组,其中mimic NC组、miR-524-5p mimic组细胞分别转染negative control-miR-524-5p、hsa-miR-524-5p mimic;siRNA NC组同时转染hsa-miR-524-5p mimic和NC-siRNA;共转染组SW579细胞转染hsa-miR-524-5p mimic与FOXD3 siRNA。
1.2.2 miR-524-5p、FOXD3 mRNA表达检测 SW579细胞培养48 h,提取总RNA,并逆转录合成cDNA,以U6、GAPDH为内参基因,qRT-PCR法检测miR-524-5p、FOXD3 mRNA表达水平,以2-ΔΔCt法表示。反应程序:95℃ 10 min;循环40次:95℃ 10 s,55℃ 35 s,72℃ 1 min。miR-524-5p上下游引物为5′-CTACAAAGGGAAGCACTTTTCTCAA-3′和5′-GTGCAGGGTCCGAGGT-3′;FOXD3上下游引物为5′-AGCAAGCCCAAGAATAGC-3′和5′-TCCAGGGTCCAGTAGTTG-3′;U6上下游引物为5′-CTCGCTTCGGCAGCAC-3′和5′-AACGCTTCACGAATTTGCG-3′;GAPDH上下游引物为5′-GCACCACCAACTGCTTAG-3′和5′-GCATGGACTGTGGTCATGA-3′。
1.2.3 SW579细胞增殖检测 SW579细胞培养48 h,加入CCK-8试剂10 μL,培养2 h,酶标仪(450 nm)检测吸光度(optical density,OD)值。
1.2.4 SW579细胞凋亡检测 SW579细胞培养48 h,经消化、洗涤,使用缓冲液制备成1×106个/mL细胞悬液,加入Annexin V-FITC、PI各5 μL,孵育1 h,流式细胞仪检测细胞凋亡,细胞凋亡率=(早期凋亡细胞数+晚期凋亡细胞数)/总细胞数×100%。
1.2.5 SW579细胞侵袭检测 Matrigel基质胶(无血清培养基稀释)加入Transwell小室50 μL,37℃ 2 h凝固。将按1.2.1分组处理的SW579细胞稀释为2.5×105个/mL,向小室上层加200 μL,小室下层加500 μL含血清培养液,孵育24 h,侵袭细胞经固定、染色,用显微镜拍照(6个视野),统计侵袭细胞数。
1.2.6 划痕试验检测各组SW579细胞迁移能力 按照1.2.1分组处理后,将SW579细胞接种于6孔板,长满80%时使用枪头划线,PBS清洗,培养24 h,显微镜拍照,进行划痕宽度测量,计算细胞迁移率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.2.7 FOXD3及EMT相关因子蛋白表达检测 SW579细胞培养48 h,提取细胞总蛋白,测定浓度。取定量蛋白电泳、转膜、封闭1 h,用FOXD3、E-cadherin、N-cadherin、Vimentin、Fibronectin、GAPDH一抗(1∶500)孵育过夜,用二抗(1∶5 000)孵育1 h,显色、显影,拍照并分析条带灰度。
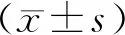
2 结果
2.1 miR-524-5p、FOXD3 mRNA表达 与mimic NC组相比,miR-524-5p mimic组SW579细胞中miR-524-5p、FOXD3 mRNA表达水平显著升高(P<0.05);miR-524-5p mimic组、siRNA NC组SW579细胞中miR-524-5p、FOXD3 mRNA表达水平差异无统计学意义(P>0.05);与siRNA NC组相比,共转染组SW579细胞中miR-524-5p表达水平差异无统计学意义(P>0.05),FOXD3 mRNA水平显著降低(P<0.05)。见表1。
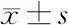
表1 miR-524-5p、FOXD3 mRNA在各组SW579细胞中表达水平比较(n=6)
2.2 SW579细胞增殖 miR-524-5p mimic组SW579细胞OD值较mimic NC组显著降低(P<0.05);与siRNA NC组相比,共转染组SW579细胞OD值显著升高(P<0.05)。见表2。
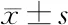
表2 各组SW579细胞OD值比较(n=6)
2.3 SW579细胞凋亡 miR-524-5p mimic组SW579细胞凋亡率较mimic NC组显著升高(P<0.05);与siRNA NC组相比,共转染组SW579细胞凋亡率显著降低(P<0.05)。见图1、表3。
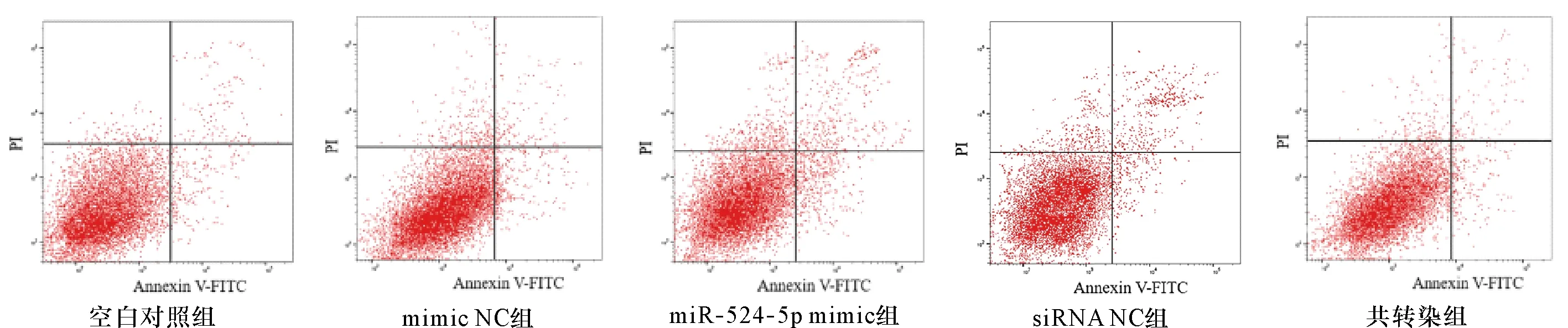
图1 各组SW579细胞凋亡情况
2.4 SW579细胞侵袭 与mimic NC组相比,miR-524-5p mimic组SW579细胞侵袭细胞数显著降低(P<0.05);miR-524-5p mimic组、siRNA NC组SW579细胞侵袭细胞数差异无统计学意义(P>0.05);与siRNA NC组相比,共转染组SW579细胞侵袭细胞数显著升高(P<0.05)。见图2、表3。

图2 各组SW579细胞侵袭情况(×200)
2.5 SW579细胞迁移 miR-524-5p mimic组SW579细胞迁移率较mimic NC组显著降低(P<0.05);与siRNA NC组相比,共转染组SW579细胞迁移率显著升高(P<0.05)。见图3、表3。

图3 各组SW579细胞迁移情况
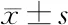
表3 各组SW579细胞凋亡率、侵袭细胞数、迁移率比较(n=6)
2.6 FOXD3及EMT相关因子蛋白表达 与mimic NC组相比,miR-524-5p mimic组SW579细胞中FOXD3、E-cadherin蛋白表达水平显著升高(P<0.05),N-cadherin、Vimentin、Fibronectin蛋白表达水平显著降低(P<0.05);miR-524-5p mimic组、siRNA NC组SW579细胞中FOXD3、E-cadherin、N-cadherin、Vimentin与Fibronectin蛋白水平无显著差异;与siRNA NC组相比,共转染组SW579细胞中FOXD3、E-cadherin蛋白表达水平显著降低(P<0.05),N-cadherin、Vimentin、Fibronectin蛋白表达水平显著升高(P<0.05)。见图4、表4。

图4 各组FOXD3、EMT相关因子蛋白表达情况
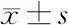
表4 FOXD3、EMT相关因子蛋白在各组SW579细胞中表达水平比较(n=6)
3 讨论
肿瘤是危害人类健康的严重疾病,近年来研究证实,miRNA广泛参与肿瘤细胞生物学过程,调控肿瘤进展。不同的miRNA在肿瘤中发挥的作用不同,同一种miRNA在不同肿瘤中也可能发挥不同作用。Wang等[11]在垂体瘤组织中发现miR-524-5p表达下调,将其过表达后可抑制垂体瘤细胞的增殖、迁移和侵袭能力。Liu等[12]研究表明,miR-524-5p过表达抑制胃癌细胞的增殖和侵袭,并促进其凋亡。李顺乐等[13]研究发现,结肠癌组织miR-524-5p的表达水平显著降低,将其过表达可显著降低结肠癌SW620细胞活力,减少迁移、侵袭细胞数,并提高细胞凋亡率。华国安等[14]也在研究中发现,胃癌耐药细胞SGC-7901和MKN-45被顺铂处理后,其中miR-524-5p表达水平较敏感性亲代细胞降低,而转染miR-524-5p模拟物可增强两者对顺铂的敏感性。但杨豪等[15]在骨肉瘤中发现,过表达miR-524-5p可逆转长链非编码RNA LINC-PINT对人骨肉瘤HOS细胞的增殖抑制和凋亡促进作用。
甲状腺癌是严重威胁女性健康的癌症,虽随着医疗手段的进步,对其治疗的手段愈发多样且有效,但肿瘤复发仍是导致患者治疗失败的主要原因。因此,寻找可以对抗跟肿瘤复发有关的癌细胞生物学行为的方法仍至关重要。靶向治疗是能针对细胞行为展开治疗的方式,而miRNA被认为是极具潜力的治疗靶点。研究发现,miR-524-5p表达与甲状腺癌关系密切。Jiang等[16]研究表明,人参皂苷Rh2通过激活miR-524-5p抑制甲状腺癌细胞的迁移和增殖。Liu等[10]研究表明,miR-524-5p通过靶向Foxe1和ITGA3在细胞自噬和循环途径中抑制甲状腺乳头状癌细胞的进展。以上研究表明,miR-524-5p在对抗甲状腺癌细胞恶性生物学行为方面发挥重要作用。EMT是上皮细胞在特定状况下向间质细胞转化的过程,会导致细胞的迁移、运动能力增加,该过程与多种生长因子、转录因子、蛋白因子及它们所调控的通路密切相关[17]。有研究发现,LINC00511通过LINC00511/miR-524-5p/YB1/ZEB1正反馈回路,促进胶质母细胞瘤的发生和EMT[18]。EMT的发生与上皮标志物下调及间充质标志物上调有关[19]。故本研究亦打算从EMT方面探讨miR-524-5p对甲状腺癌侵袭、迁移行为的影响。本研究上调miR-524-5p表达后发现,SW579细胞的凋亡率、E-cadherin蛋白水平升高,细胞的增殖、侵袭、迁移及N-cadherin、Vimentin、Fibronectin蛋白表达均受到抑制,提示过表达miR-524-5p可抑制SW579细胞增殖、侵袭、迁移及EMT过程,并诱导其凋亡。miRNA通常通过调控其它基因的转录后水平发挥作用,但miR-524-5p调控SW579细胞行为的机制尚不清楚。
据研究,FOX家族成员可改变上皮细胞的极性和连接功能,是参与EMT过程的一类转录因子,常作为多种miRNA的靶基因,被调控发挥作用[20]。FOXD3是具有翼状螺旋结构的FOX家族成员。Yin等[21]研究表明,FOXD3下调促进变性甲状腺癌细胞侵袭性和EMT过程,并减少细胞凋亡。He等[22]研究表明,FOXD3可抑制HepG2、SMMC-7721细胞的增殖、侵袭、迁移和EMT。本研究发现,上调miR-524-5p后,SW579细胞中FOXD3 mRNA及蛋白水平升高,提示miR-524-5p过表达可促进FOXD3表达。为探究FOXD3表达在miR-524-5p调控SW579细胞行为的机制中的作用,本研究在上调miR-524-5p基础上进一步下调FOXD3,发现SW579细胞的OD值、侵袭细胞数、细胞迁移率及N-cadherin、Vimentin、Fibronectin蛋白水平升高,凋亡率、FOXD3 mRNA及蛋白水平、E-cadherin蛋白水平降低,提示下调FOXD3表达可减轻miR-524-5p对SW579细胞增殖、侵袭、迁移及EMT过程的抑制作用,并减少细胞凋亡。以上研究均表明,miR-524-5p可能通过上调FOXD3表达进而影响SW579细胞的生物学功能,但鉴于miRNA通常负调控其靶基因表达发挥作用,推测miR-524-5p可能存在能负调控FOXD3的靶基因,通过靶基因的间接作用影响FOXD3表达,进而发挥抑癌基因作用。
综上所述,miR-524-5p可能通过提高FOXD3表达,从而诱导甲状腺癌SW579细胞凋亡,抑制增殖、侵袭、迁移和EMT过程。但miR-524-5p调控FOXD3的具体机制尚不完全清楚,后续实验会探索其具体机制,且本研究仅探讨了miR-524-5p调控FOXD3对一种甲状腺细胞系的影响,对其他甲状腺癌细胞系是否有同样的效果会在后续实验中继续探讨,此外,虽然miR-524-5p、FOXD3对SW579细胞的影响已明确,但由于本研究缺乏在临床组织中加以验证,是否能作为肿瘤靶点在甲状腺癌进展中发挥作用还有待进一步研究。
利益相关声明:所有作者均声明不存在利益冲突。
作者贡献说明:殷鹏昌负责实验设计、数据分析、修改和论文撰写;赵良柱负责数据分析、修改;闫红印负责课题设计、论文撰写和修改。

