Pam3CSK4与黄连素联合用药对小鼠抗MRSA感染的作用
彭珊珊, 刘思思, 巫谢生, 孙 静, 张 咏*
(1.江西省医学科学院, 南昌 330000; 2.南昌大学药学院, 南昌 330036)
金黄色葡萄球菌(Staphylococcusaureus)是目前世界上最常见的社区和院内感染因素之一,常见于烧伤、创伤科等,它几乎可以感染身体的全部器官和组织,引起各种炎症和并发症甚至毒血症等[1].金葡菌感染死亡率高,到目前为止所已知的人类致病菌中,没有一种菌的具有如金葡菌一样广泛的致病机制和毒性机制.金黄色葡萄球菌自身拥有多种免疫逃避机制可以抵抗机体免疫系统的作用[2].加之金葡菌的耐药性问题日渐严重,耐甲氧西林甚至耐万古霉素的金葡菌的出现,使得其感染的防治问题越发棘手.
Pam3CSK4(Pam3Cys-Ser-(Lys)4)是Toll样受体2(toll like receptor 2, TLR2)的模式识别分子,是细菌脂蛋白的人工模拟物.在此前的研究中使用了TLR2的激动剂Pam3CSK4去处理小鼠肺炎、肾脓肿模型,结果显示Pam3CSK4预处理对耐甲氧西林的金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus, MRSA)攻击的小鼠病理模型具有保护作用,能显著延长小鼠的生存时间和生存率,小鼠各脏器对MRSA清除能力显著增加,同时显著降低MRSA攻击后小鼠促炎症细胞因子TNF-α,IL-6和IFN-γ的产生[3].Pam3CSK4预处理小鼠腹腔巨噬细胞能增强其对MRSA杀菌能力,并降低相应炎症反应[4].对中性粒细胞的预处理可以增强对MRSA的吞噬功能和抗菌能力[5-6].表明利用Pam3CSK4干预TLR2,可能可以对抗金葡菌感染攻击,又能同时抑制续发的炎性病理反应,避免对机体造成过度免疫反应的二次打击.
黄连素又名小檗碱,是黄连、黄柏等中的主要有效抗菌成分,在临床上常以氯化物形式使用,广泛应用于消化道细菌性疾病.黄连素不仅具有显著的广谱抗菌能力,还具有一定的免疫调节能力[7-8].它可以抑制MRSA的生物膜形成,对被膜态的金葡菌抑制效果较浮游态更好,而MRSA的耐药性获得与其生物膜的形成密切相关[9].黄连素还可以通过抑制P65信号通路产生炎症抑制作用,对小鼠构建的金黄色葡萄球菌引起的急性肺损伤模型起到保护作用[10].
为了应对金葡菌的耐药性难题,本文将黄连素与Pam3CSK4联合使用以对抗MRSA的感染,黄连素在此作为抗菌药物,可以对抗金葡菌的耐药性,还具有一定的免疫调节能力,Pam3CSK4作为免疫激动剂可以调动机体的先天性免疫,两者相辅,可能在抗MRSA攻击上具有良好效果,可以做为一种无抗生素的预防和治疗金葡菌感染的手段.文中实验观察了小鼠用药后对MRSA的抵抗能力,并体外初步研究了感染过后的小鼠淋巴细胞对树突状细胞(dendritic cell, DC)的MRSA抗原提呈的反应情况,验证黄连素与Pam3CSK4的联用可以提高小鼠对抗MRSA感染效果,调动机体特异性免疫反应,为金黄色葡萄球菌的预防和治疗提供新思路.
1 材料与方法
1.1 主要实验材料与试剂
实验动物:18~20 g的SPF级雌性昆明鼠(江西省中医药大学实验动物中心).动物实验经江西省医学科学院医学伦理委员会批准(批准号为JXAMS=EWC-2019011).
菌种:耐甲氧西林的金黄色葡萄球菌标准株(MRSA,ATCC43300,江西省医学科学院微生物实验室保存).
培养基:胰蛋白胨大豆肉汤培养基(Solarbio),金黄色葡萄球菌显色培养基(科玛嘉),RPMI 1640培养基(Solarbio),胎牛血清(Gibco).
药品:氯化小檗碱水合物(东京化成工业株式会社,TGI),Pam3CSK4(invivogen).
细胞因子:GM-CSF(Pepro Tech),IL-4(Pepro Tech).
染料、抗体和试剂盒:羊抗小鼠IgG-HRP(Solarbio),小鼠免疫球蛋白M(IgM)检测试剂盒(Biolegend),CFSE(Abcam),APC anti-mouse CD11c(Biolegend Inc),PE anti-mouse MHCII(Biolegend Inc),FITC anti-mouse CD282(TLR2)(Biolegend Inc),PE anti-mouse CD3(Biolegend Inc),APC anti-mouse CD19(Biolegend Inc),PE-Cy5 anti-mouse CD4(Biolegend Inc),PE-Cy7 anti-mouse CD8(Biolegend Inc).
1.2 MRSA菌液的配制
取MRSA用TSB培养基培养至对数期,3 000 r·min-1离心取沉淀,用1 mL PBS稀释,充分混匀后用紫外分光光度计检测其600 nm波长处的吸光度,用PBS调整菌液浓度至6×109cfu·mL-1,2 h沸水水浴或40 min UV照射可以置备灭活的MRSA菌液[11].
1.3 细菌非致死剂量和致死剂量的确定
小鼠分组腹腔注射MRSA菌液,每组10只,每只分别注射1×108、5×108、1×109、1.5×109、2×109、2.5×109、3×109cfu,连续7 d观察小鼠死亡情况,确定后续实验中采用的腹腔注射MRSA的非致死剂量和致死剂量.
1.4 实验分组及给药
小鼠分组:联合治疗组、黄连素组、Pam3CSK4组、生理盐水组、空白组,每组6只.联合治疗组先给予Pam3CSK4尾静脉注射给药,每只100 μg,给药1次,1 d后进行MRSA攻击,同时每日黄连素灌胃给药,每只2 mg;黄连素组先给予生理盐水尾静脉注射,给药1次,1 d后进行MRSA攻击,同时黄连素每日灌胃给药,每只2 mg;Pam3CSK4组先给予Pam3CSK4尾静脉注射给药,每只100 μg,给药1次,1 d后进行MRSA攻击,同时生理盐水灌胃给药;生理盐水组进行一次生理盐水尾静脉注射,1 d后进行MRSA攻击,同时生理盐水灌胃给药;空白组不给药.
1.5 小鼠致死攻击保护实验
MRSA攻击采取小鼠腹腔注射最大致死剂量MRSA,24 h内每6 h观察一次小鼠死亡情况,24~48 h内每12 h观察1次,36 h后每24 h观察一次,累计1周,记录死亡数、生存时间,计算存活率.
1.6 器脏细菌清除实验
非致死剂量MRSA的腹腔注射小鼠,3 d后颈椎脱臼处死小鼠,无菌条件下取小鼠肝、肾脏器,向组织中加入1 mL PBS溶液后匀浆,匀浆后10倍稀释,取200 μL匀浆稀释液涂布于金黄色葡萄球菌显色培养基上,37 ℃培养24 h后选择平板上紫红色、红色、粉红色的菌落进行计数,计录肝、肾上MRSA的细菌载量.
1.7 血清中免疫球蛋白IgG和IgM检测
非致死剂量MRSA攻击小鼠后第7 d对小鼠进行眼球取血,离心分离血清,采用ELISA法分别检测血清中MRSA特异性抗体IgG和总IgM的水平.
间接ELISA法检测特异性IgG:将灭活的MRSA以1×108cfu·mL-1或溶血素-α以2 μg·mL-1用0.05 mol·L-1PH 9.4的碳酸盐缓冲液重悬,加入ELISA板,每孔包被100 μL,4 ℃包被过夜.PBST洗板4次,加入200 μL 1% BSA,37 ℃封闭1 h.PBST洗板4次,加入100 μL待测血清,37 ℃孵育2 h.PBST洗板4次,加入100 μL羊抗小鼠IgG-HRP, 37 ℃孵育1 h.PBST洗板4次,加入100 μL TMB,避光孵育20 min,加入100 μL 1 M H2SO4终止反应.用酶标仪在波长450 nm光下读取吸光度[12].
ELISA法检测总IgM:按照试剂盒说明书,在酶标ELISA板上加待测血清100 μL,37 ℃孵育1 h.PBST洗板4次,加入100 μL酶标二抗, 37 ℃孵育1 h.PBST洗板4次,加入100 μL TMB,避光孵育20 min,加入100 μL 终止液终止反应.用酶标仪在波长450 nm光下读取吸光度.
1.8 骨髓来源的树突状细胞DC制备
断颈处死6周龄小鼠, 游离小鼠后腿两侧股骨,无菌取股骨骨髓细胞悬液,过200目筛,并调整密度为106cell· ml-1, 加入含GM-CSF(10 ng·mL-1),IL-4(10 ng·mL-1),10% 胎牛血清的RPMI1640,置于六孔板中于37 ℃、5% CO2培养.48 h后吸去悬浮细胞换液,两天半后半量换液, 7 d后利用APC anti-mouse CD11c和PE anti-mouse MHCII进行标记, 流式细胞仪检测DC纯度.
1.9 小鼠淋巴结的淋巴细胞制备
第10 d处死非致死剂量MRSA的小鼠, 无菌取肠系膜小鼠淋巴结,轻轻碾磨取淋巴结细胞悬液,过200目筛滤网,悬液离心重悬,细胞计数.
1.10 淋巴细胞增殖实验
将培养到第7 d的DC加入灭活的MRSA刺激3 h,DC用FITC anti-mouse CD282染色,流式检测其细胞表面TLR2表达情况.淋巴细胞悬液中加入CFSE染色,10 min后用50%的血清终止染色,离心洗去染液.将MRSA刺激后的DC与CFSE染色的淋巴细胞按1∶10的比例混合共培养3 d,收集细胞,用PE anti-mouse CD3,APC anti-mouse CD19,PE-Cy5 anti-mouse CD4,PE-Cy7 anti-mouse CD8进行染色,流式细胞术检测CD4、CD8和CD19阳性细胞的增殖情况.
1.11 统计学处理
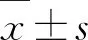
2 实验与分析
2.1 腹腔注射MRSA非致死剂量和致死剂量的确定
为确定实验中MRSA的注射致死剂量和非致死剂量,对小鼠腹腔注射一系列不同剂量的MRSA悬液,连续观察5 d小鼠的生存情况,结果如表1,在后续实验中采取每只2×109cfu MRSA为腹腔注射的致死剂量,每只5×108cfu MRSA为非致死剂量.
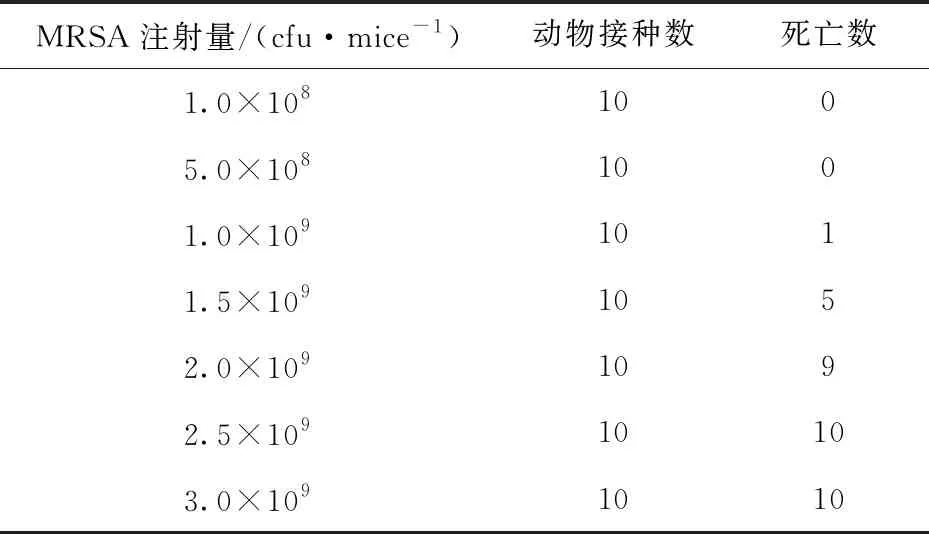
表1 小鼠腹腔注射MRSA致死实验
2.2 黄连素与Pam3CSK4对小鼠在MRSA致死剂量攻击下具有保护作用
为了探讨黄连素、Pam3CSK4以及两种药物联用对小鼠在MRSA攻击下的保护作用,将小鼠分组成联合治疗组、黄连素组、Pam3CSK4组、生理盐水组、空白组进行给药,每只小鼠腹腔注射2×109cfu 剂量的MRSA进行攻击,连续观察小鼠的生存情况,计算小鼠的生存率如图1所示.结果显示联合给药组存活率最高,为66.7%;黄连素组存活率25%;Pam3CSK4组存存活率41.7%;生理盐水组存活率16.7%.生存分析结果显示,联合给药组与生理盐水组对照相比,对小鼠的感染预保护实验结果存活率有统计学差异(p<0.05).单独给药黄连素或Pam3CSK4对小鼠存活率无显著差异.数据表明Pam3CSK4和黄连素联合给药可以有效提高小鼠感染后的存活率,黄连素或Pam3CSK4单独给药对小鼠感染后的存活情况有提高但并不明显.说明黄连素的抗菌作用与Pam3CSK4的免疫激动作用相结合,相对单独给药来对抗MRSA感染是有意义的.

注:*、**分别表示p<0.05、p<0.01.下同.
2.3 黄连素与Pam3CSK4降低小鼠器脏对MRSA的载量
为进一步分析黄连素和Pam3CSK4抗MRSA的作用,每只小鼠给予非致死剂量5×108cfuMRSA腹腔注射攻击并分组给药,取其肝、肾脏匀浆后用金黄色葡萄球菌显色培养基检测其中的细菌载量.结果如图2所示,联合给药和单独Pam3CSK4给药,统计学上显著降低肝脏(p<0.05)和肾脏(p<0.01)的细菌量,而黄连素用药对MRSA的清除率提高也有一定作用.在肝、肾脏清除MRSA的过程中,显然Pam3CSK4通过其免疫激动作用发挥了比黄连素的抗菌作用更大的效果,两者的联合使用似乎更加强了这种效果,从图上看联合给药组在载菌量的整体水平相较于Pam3CSK4组还是虽然并不显著,但是仍然更低一些.
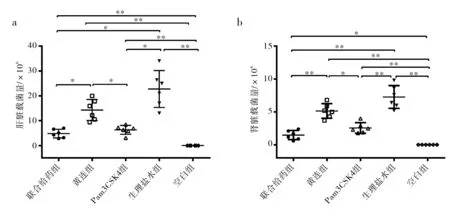
图2 分组给药的小鼠肝、肾上MRSA的载菌量
2.4 Pam3CSK4影响小鼠血清中免疫球蛋白IgG和IgM的水平
在机体抗感染的过程中,体液免疫发挥了重要的作用,为了进一步研究黄连素和Pam3CSK4抗MRSA的作用,采用ELISA法分析了各组小鼠感染后第七天血清中的免疫球蛋白IgG和IgM的水平.其中抗体特异性的IgG的检测采用了间接ELISA法,将抗原即灭活的MRSA或溶血素-α包被到ELISA板上,再加入待测血清与抗原特异性结合,以酶标二抗羊抗小鼠IgG-HRP显色检测[12].溶血素-α是金黄色葡萄球菌分泌的最重要的细胞毒素,以灭活的MRSA或溶血素-α分别为抗原检测特异性IgG可以相互印证结果.总IgM的检测采用双抗夹心ELISA法.结果如图3显示,黄连素组和生理盐水组的MRSA和溶血素-α特异性IgG水平都没有明显差别,Pam3CSK4组和联合给药组特异性IgG水平也没有明显差别,黄连素组和生理盐水组显著性高于Pam3CSK4组和联合给药组的特异性IgG水平;与之相反,Pam3CSK4组和联合给药组的总IgM的量要高于黄连素组和生理盐水组,黄连素组和生理盐水组的总IgM水平无明显差异,Pam3CSK4组和联合给药组也无明显差异.表明Pam3CSK4会降低小鼠对MRSA的IgG分泌水平但是会增加IgM的分泌,黄连素对IgG和IgM的分泌无明显影响.
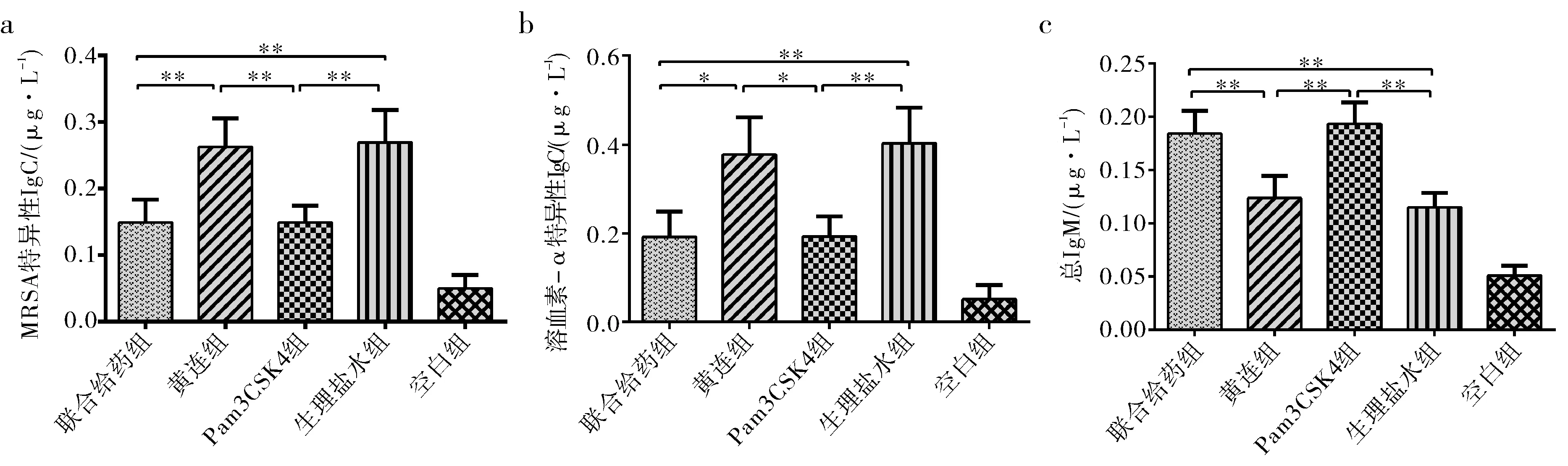
图3 分组给药对血清中特异性IgG和总IgM水平的影响
2.5 黄连素与Pam3CSK4影响小鼠淋巴细胞的增殖
为了观察黄连素和Pam3CSK4对淋巴细胞的增殖的影响,首先培养健康小鼠的树突状细胞(DC),培养到第6 d的DC用灭活的MRSA进行刺激,流式检测其TLR2的表达情况.结果如图4所示,培养到第6 d的细胞,CD11c阳性细胞比例61%以上,MHCII、CD11c双阳性细胞52.6%(图4a).DC细胞经过MRSA刺激后,TLR2表达量由未经细菌刺激前的20.5%提高到25.1%,提示DC细胞接受了抗原刺激,其TLR2表达量提高(图4b).然后在各给药组进行了非致死剂量MRSA攻击的10 d,取小鼠肠系膜淋巴结的淋巴细胞,与DC细胞共培养后,流式细胞术检测圈出CD3+细胞为T淋巴细胞,CD19+细胞为B淋巴细胞,在CD3+细胞群中圈出CD4+和CD8+细胞,CD4+亚群是辅助性T细胞,CD8+亚群是毒性T细胞,利用染色的CFSE检测各类细胞的增殖情况.

a.CD11c和MHCll双阳性的DC细胞;b.无MRSA刺激的DC细胞TLR2表达;c.MRSA刺激的DC细胞TLR2表达
CD4+的T淋巴细胞的增殖情况如图5所示,结果显示,未经过共培养的CD4+T淋巴细胞几乎没有增殖,与DC细胞共培养的空白组CD4+T淋巴细胞增值率均数为20.1%,共培养后生理盐水组CD4+T细胞增殖量均数为24.5%,黄连素组CD4+T细胞增殖量约26.7%,Pam3CSK4组CD4+T细胞增殖量约31.7%,联合给药组CD4+T细胞增殖量约37.5%.生理盐水组较空白组而言,相当于DC细胞给予了CD4+T淋巴细胞第二次的激活,其增殖量有所增长,符合淋巴细胞的增殖规律.联合给药组的CD4+T细胞增殖量最大,显著性高于生理盐水组和黄连素组(p<0.05).而单独给药的两组,虽然在统计学上无明显提高CD4+T细胞的增殖,但整体水平依然高于生理盐水组,特别是Pam3CSK4组,由于药物联合使用对CD4+T细胞增殖的确实有明显的促进效果,可以推论两种药物都有可能可以对辅助性T细胞的有促进作用,且Pam3CSK4的促进效果更加明显.
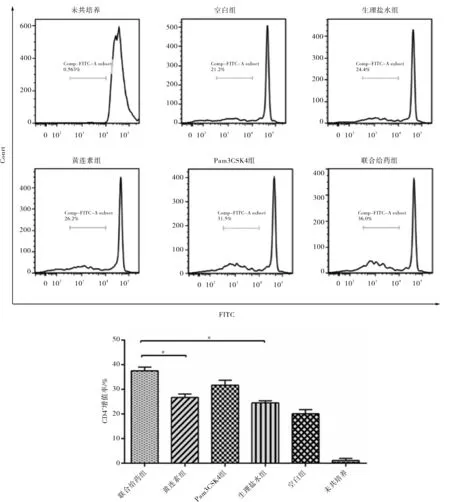
图5 CD4+ T淋巴细胞的增殖
CD8+的T淋巴细胞的增殖情况如图6所示,结果显示,未共培养的CD8+T淋巴细胞几乎没有增殖,与DC细胞共培养的空白组CD8+T淋巴细胞增值率均数为5.67%,共培养后生理盐水组CD8+T细胞增殖量约16.6%,黄连素组CD8+T细胞增殖量约16.1%,Pam3CSK4组CD8+T细胞增殖量约23.9%,联合给药组CD8+T细胞增殖量约20.2%.黄连素的单独给药对CD8+T细胞的增殖无明显影响,Pam3CSK4单独给药可以明显促进CD8+T细胞的增殖(p<0.05),药物联合使用对CD8+T细胞增殖的促进水平稍大于黄连素单独使用4.1%,相较于Pam3CSK4组对其的影响反而有所下降,这是否与黄连素的免疫调节能力相关,其中原因尚需进一步探索.
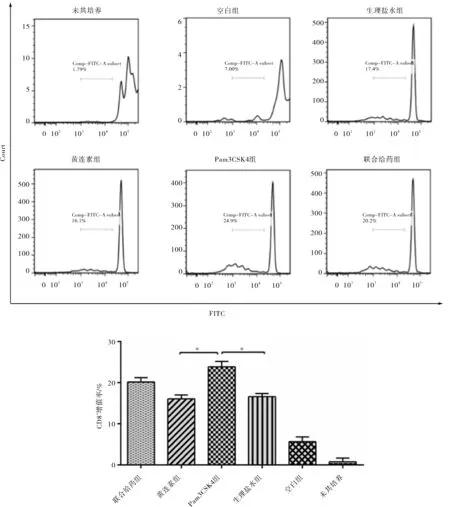
图6 CD8+ T淋巴细胞的增殖
B淋巴细胞的增殖情况如图7所示,结果显示,未与DC细胞共培养的CD19+B淋巴细胞几乎没有增殖,与DC细胞共培养的空白组B淋巴细胞增值率为2.28%,共培养后生理盐水组B细胞增殖量约6.13%,黄连素组B细胞增殖量约11.3%,Pam3CSK4组B细胞增殖量约20.1%,联合给药组B细胞增殖量约20.6%.结果可以看出, Pam3CSK4组较联合给药组几乎没有差别,都可以很大程度促进B细胞的增殖;尽管p>0.05,从图7上看黄连素的单独给药对B细胞的增殖也有明显程度的促进.但两种药物共同作用,对促进B细胞的增殖并未产生联合放大的作用.

图7 B淋巴细胞的增殖
3 讨论
Pam3CSK4已经显示出其通过提前干预的方式来激动机体免疫系统对抗耐药型金葡菌感染的潜力[3-4].黄连和黄连素在多种中药的对比中也表现出比较显著的对MRSA的杀菌和抑菌能力[9,13].本研究考察了Pam3CSK4和黄连素单独和联合使用时小鼠对抗MRSA感染的情况和效果.从提高小鼠生存率,增强小鼠对MRSA清除率,影响免疫球蛋白的分泌水平和T、B淋巴细胞的增殖几个方面综合来看,联合给药较两种药物单独给药对小鼠抵抗MRSA感染的保护作用确实产生了一定的放大效应.对于联合给药组而言,除对CD8+T细胞以外,在各方面对小鼠都具有的显著性影响.单独给药Pam3CSK4效果逊于联合给药,但相较于单独给药黄连素对小鼠的保护作用更加明显.对于单独使用黄连素而言,尽管大部分实验结果统计学计算中并没有明显差异,但是各个部分的实验数据相互呼应,生存率的提升,载菌量的降低,T、B细胞增殖的促进作用,表明黄连素的在抗MRSA感染中的使用依旧有意义.两者结合使用则明显增强了小鼠的抵抗MRSA的能力.因此联合给药,从抗菌与免疫调节两方面同时出发来对抗MRSA感染是有意义的.在机体对抗细菌攻击时,免疫系统被调动起来发挥其作用,然而金葡菌自身拥有多种免疫逃避机制可以抵抗机体免疫系统的作用,常常使得机体无法有效与之对抗[14].研究从体液免疫和细胞免疫两方面分析了部分Pam3CSK4和黄连素对机体免疫的影响.有研究发现,在体外用Pam3CSK4处理B细胞,相较于细菌的脂多糖(lipopolysaccharide, LPS)来说,更可以增加B细胞分泌的IgM和IgG2a、IgG2b的水平,但是几乎不能促进在IgG家族中含量最高的IgG1的分泌[15].对比本研究中Pam3CSK4对机体分泌特异性IgG和总IgM的影响,结果并无矛盾,在小鼠受到MRSA攻击后,Pam3CSK4会降低小鼠对MRSA的特异性IgG分泌水平但是会增加总IgM的分泌.研究还发现Pam3CSK4的使用可以促进对CD4+和CD8+T细胞以及B细胞的在体外的二次增殖,同时还验证了黄连素也具有一定的免疫调节作用,黄连素的使用使小鼠B细胞在体外的二次增殖有一定量的增加,CD4+T细胞在体外的二次增殖也有轻度的增长,两者联合使用时,对CD4+T细胞的促进作用得到了进一步加强,同时黄连素还可能在联合给药时对CD8+T细胞的增殖发挥了抑制作用.可以推测不论是联合给药还是两种药物单独使用,均对小鼠具产生了一定的免疫调节作用影响,对小鼠的获得性免疫也可能具有积极的意义.机体应对金葡菌的感染时常常发生过度免疫反应,其造成的二次打击对自身伤害很大.因此在对抗金葡菌感染时,不仅要考虑对金葡菌的清除和免疫系统的激活,同样也要考虑免疫反应的调节避免二次打击.CD8+T细胞作为毒性T细胞在机体发生二次打击时处于高水平状态,对机体产生负面的影响,联合用药时CD8+T细胞在增殖实验中水平的下降,对于降低机体在MRSA感染时的过度免疫反应有也着积极意义.金黄色葡萄球菌的持续传播与增长已逐渐成为一个全球性危机,耐药性问题日趋严重,甚至发现了耐万古霉素的金葡菌,寻找抗生素的替代应对方法意义非凡.黄连素作为一种抗菌物质,它可以抑制金葡菌的生物膜,进而对抗耐药性的产生,免疫激动剂的使用也避免了细菌的耐药性问题,对这两种药物联合抗MRSA的研究,也是提出一种对抗金葡菌感染的新思路[9].
4 结论
综上所述,为应对金葡菌日趋严峻的耐药性问题,采用免疫激动剂Pam3CSK4和黄连素的联用可能会是一种有潜力的对抗和预防金葡菌感染的方法.TLR2作为一种膜相关的模式识别受体,Pam3CSK4将其激活后通过抗原提呈细胞来调动机体的细胞免疫和体液免疫反应;黄连素杀菌抑菌,效果互为补充,一定程度上弥补在对抗金葡菌时药效不足的尴尬,还可以对抗细菌的耐药性,同时与Pam3CSK4各自发挥免疫调节的作用,降低机体的过度免疫反应造成的伤害.这种免疫激动剂与中药成分相结合的使用,一方面可以作为预防性对抗MRSA感染风险的手段,一方面可能也有用于治疗MRSA感染的潜力.

