MEBO 联合微粒皮种植对糖尿病足创面组织中VEGF、 EGF 表达水平的影响
戚世玲 刘 清 何仁亮 朱定衡 冯 雷 谢志敏 方培炫 朱 璐
糖尿病足是糖尿病患者常见且严重的并发症之一, 多由周围神经病变、 外周血管病变和感染等多种因素相互作用所致, 且机体长期处于高糖环境引起的血管损伤、 组织细胞功能紊乱、 神经营养因子表达水平降低、 生长因子减少等还可导致创面迁延不愈, 治疗难度较大, 给患者家庭和社会造成了巨大的经济负担[1]。 目前, 临床治疗糖尿病足的主要方法有药物外用、 手术植皮、 富血小板血浆外敷、负压封闭引流、 干细胞移植、 高压氧疗、 组织工程技术以及各种敷料外敷等, 其中干细胞移植、 负压封闭引流以及银离子凝胶等新型敷料的价格高昂[2-3], 且部分治疗方法治疗周期较长、 换药次数频繁, 临床难以推广。 因此, 探寻安全有效且价格低廉的糖尿病足创面治疗方法仍是临床研究的重点。 近年来有研究证实, 湿润烧伤膏(moist exposed burn ointment, MEBO) 联合微粒皮种植治疗糖尿病足创面的疗效较好, 且价格相对低廉[4]。 基于此, 本研究笔者鉴于血管内皮生长因子(vascular endothelial growth factor, VEGF) 与表皮生长因子(epidermal growth factor, EGF) 可间接反映创面的愈合情况[5], 于本研究中观察了MEBO 联合微粒皮种植对糖尿病足创面组织中VEGF、 EGF 表达水平的影响, 以期为该疗法的临床应用提供理论依据。
1 临床资料
1.1 一般资料
本组患者共38 例, 均为2018 年1 月至2020年12 月广州医科大学附属第五医院收治的Wagner 2 ~3 级糖尿病足患者, 其中男性21 例、 女性17例, 年龄(63.6 ±8.3) 岁, 糖尿病病程(9.3 ±2.2) 年, 糖尿病足病程(61.6 ±22.4) d, Wagner分级为2 级33 例、 3 级5 例, 糖化血红蛋白(8.4 ±1.2)%。 本研究经广州医科大学附属第五医院医学伦理委员会批准, 且所有患者均签署了知情同意书。
1.2 纳入与排除标准
纳入标准: 符合2 型糖尿病及糖尿病足的诊断标准; Wagner 分级为2 ~3 级; 经常规治疗无明显好转或持续恶化, 且经综合治疗后能承受微粒皮种植治疗; 对本研究知情同意。 排除标准: 合并有严重心、 脑、 肺、 肝、 肾等重要器官功能障碍; 合并有恶性肿瘤; 合并有认知功能障碍或精神类疾病,依从性较差; 入选前长期接受糖皮质激素、 免疫抑制剂及化疗药物治疗; 对本研究所用药物成分过敏或为过敏体质; 妊娠期及哺乳期女性。
1.3 主要试剂与仪器
鼠抗人VEGF 及EGF 酶联免疫吸附测定试剂盒: 美国Cell Signaling Technology 生产; 全波长酶标仪: 德国Thermo Fisher Scientific 生产; 二喹啉甲酸(bicinchoninic acid, BCA) 蛋白定量试剂盒:北京雷根生物技术有限公司生产; 超声匀浆器: 美国Biospec 生产; 低温离心机: 美国Beckman Coulter生产。
2 方法
2.1 基础治疗
所有患者入院后均积极予以调控血糖、 血压、血脂, 抗感染, 改善微循环, 营养神经, 调控饮食等对症支持治疗。
2.2 创面治疗
局部创面于生理盐水冲洗、 坏死组织清除后,均匀涂抹MEBO, 并依次覆盖MEBO 药纱及无菌敷料包扎, 每天换药1 ~2 次; 待新生肉芽组织覆盖创面后行微粒皮种植, 用眼科无齿镊将微粒皮以间隔0.3 ~0.5 cm, 深0.2 ~0.3 cm 为准种植于创面中; 继而依次覆盖MEBO 药纱及无菌敷料加压包扎, 每天换药1 次(换药时去除创面残余药膏、 液化物及坏死组织后再涂新药), 直至创面完全愈合。
微粒皮制作: 选择自身大腿健康皮肤, 常规消毒麻醉后, 按供皮区面积与创面面积比例为1∶20 ~30切取刃厚皮片, 剪成0.1 ~0.2 cm 的矩形微粒置于无菌生理盐水中备用[6]; 供皮区创面予以无菌纱布加压包扎, 每天换药1 次, 直至创面完全愈合。
2.3 标本采集
分别于治疗前及治疗第7、 14 天测量创面面积, 并剪取0.1 cm ×0.1 cm 创面边缘肉芽组织置于-80 ℃冰箱中保存备用。
2.4 VEGF、 EGF 含量测定
严格按照试剂盒说明书采用BCA 法检测创面组织中总蛋白含量、 采用酶联免疫吸附法检测VEGF 及EGF 水平, 并以VEGF、 EGF 水平与总蛋白含量的比值表示每毫克组织中VEGF、 EGF 的含量。
2.5 统计学处理
采用SPSS 22.0 统计软件对所得数据进行统计学分析, 符合正态分布的计量资料以及非正态分布数据进行对数转换后以均数± 标准差(±s)表示, 采用重复测量方差分析; 创面面积与VEGF、EGF 含量的相关性采用Pearson 相关性分析; 均以P<0.05 为差异具有统计学意义。
3 结果
3.1 创面愈合情况
治疗前, 38 例患者创面面积为 (11.78 ±3.04) cm2; 治疗过程中, 所有患者创面均逐渐缩小, 其中治疗第7 天创面面积为(9.64±2.73) cm2,治疗第14 天创面面积为(7.32 ±2.06) cm2; 治疗2 个月后, 33 例患者创面完全愈合、 5 例患者创面明显缩小。 典型病例图片见图1-2。
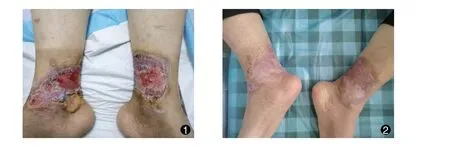
图1 微粒皮种植治疗前糖尿病足创面情况; 图2 微粒皮种植治疗3 个月后创面愈合Fig.1 The diabetic foot wound before micro⁃skin grafting; Fig.2 The wound was healed 3 months after the micro⁃skin grafting
3.2 治疗前后VEGF、 EGF 含量对比
治疗过程中, 38 例患者创面组织中VEGF 及EGF 含量均呈逐渐升高趋势, 其中各时间点创面组织中VEGF 含量对比,P均<0.001, 差异具有统计学意义; EGF 含量除治疗前与治疗第7 天对比,差异无统计学意义(P>0.05) 外, 其余各时间点对比,P均<0.001, 差异具有统计学意义, 详见表1。
表1 治疗前后糖尿病足创面组织中VEGF、 EGF 含量对比(pg/mg, ±s)Table 1 Comparison of levels of VEGF and EGF in diabetic foot wounds before and after treatment (pg/mg, ±s)

表1 治疗前后糖尿病足创面组织中VEGF、 EGF 含量对比(pg/mg, ±s)Table 1 Comparison of levels of VEGF and EGF in diabetic foot wounds before and after treatment (pg/mg, ±s)
注: VEGF 为血管内皮生长因子, EGF 为表皮生长因子。 与治疗前对比, aP <0.05, 差异具有统计学意义; 与治疗第7 天对比, bP <0.05, 差异具有统计学意义Note: VEGF-vascular endothelial growth factor, EGF-epidermal growth factor. The differences were statistically significant compared with that before treatment (aP <0.05) and on day 7 of treatment (bP <0.05)
指标Indicator例数Number of cases治疗前Before treatment治疗第7 天Day 7 of treatment治疗第14 天Day 14 of treatment F 值F value P 值P value VEGF 38 79.38 ±9.48 99.65 ±12.39a 125.17 ±14.06ab 136.076 <0.001 EGF 38 7.91 ±2.03 9.11 ±3.52 15.95 ±5.86ab 42.172 <0.001
3.3 创面组织中VEGF、 EGF 含量与创面面积的相关性分析
Pearson 相关系数分析结果显示, 创面组织中VEGF、 EGF 含量与创面面积无明显相关性(r=0.181、 0.205,P=0.833、 0.094)。
4 讨论
据统计, 我国现有糖尿病患者约1.3 亿, 糖耐量受损者(糖尿病前期) 约3.5 亿, 而糖尿病足作为糖尿病患者常见且严重的并发症, 50 岁以上的发病率高达8.1%, 且极易因合并感染、 局部微循环障碍及神经损害而使创面迁延不愈[7]。 糖尿病足是糖尿病患者致残、 致死的主要原因之一, 如何快速高效修复糖尿病足创面一直是医学领域亟待解决的难题。
自体微粒皮种植是一种临床常用的创面修复方法, 操作简便, 对手术设备及镇痛要求较低, 易于推广, 尤其适用于不能接受大面积皮肤移植或皮瓣移植的患者[8]。 自体微粒皮含有表皮、 真皮和皮下组织等皮肤全层结构, 且皮粒微小, 能够与边缘新生组织快速融合, 迅速封闭创面, 可明显降低并发症发生率及病死率, 被广泛应用于临床[9]。 MEBO是由黄芩、 黄柏、 黄连、 地龙、 罂粟壳等中草药提取物制成的软膏制剂, 具有清热解毒、 祛腐生肌、活血化瘀等功效。 现代医学研究证实, MEBO 能够为创面创造立体式生理性湿润环境, 并在创面表层形成一层保护膜, 从而隔绝外界细菌对创面的侵袭; 黄芩甙、 小檗碱等成分能够破坏细菌生存环境, 抑制细菌繁殖及毒性物质释放, 有效控制创面感染; 可与创面坏死组织发生水解、 酶解、 酸败、皂化、 酯化和脂化等一系列生物化学反应, 无损伤地液化排除坏死组织; 可激活创面组织中的潜能再生细胞, 并将其转化为干细胞, 再在原位增殖、 分化为创面各层组织细胞, 再生修复创面[10]; 同时,其内含有的碳水化合物、 脂肪酸、 氨基酸、 维生素等多种营养成分可为创面的再生修复提供充足的营养[11]。 本研究结果显示, MEBO 联合微粒皮种植治疗2 个月后, 33 例糖尿病足患者创面完全愈合,5 例患者创面明显缩小, 明显短于李健等[12]研究显示的前列地尔静脉注射联合溃疡局部前列地尔经皮超声电导透入治疗糖尿病足的创面愈合时间。 可见, MEBO 联合微粒皮种植可促进糖尿病足创面的愈合。 考虑与自体微粒皮种植术前使用MEBO 能够促进肉芽组织生长, 为微粒皮的种植提供基础, 以及自体微粒皮种植术后使用MEBO 能够为微粒皮成活、 扩张提供充足的营养有关。
创面愈合是一个复杂而有序的动态生物学过程, 包括凝血、 炎症反应、 肉芽组织形成和组织重塑4 个阶段, 其中肉芽组织形成对创面愈合至关重要, 而创面组织中相关生长因子及其受体相对或绝对缺乏是导致创面肉芽组织难以形成的关键因素[13]。 近年来部分研究证实, 细胞外基质可通过分泌VEGF、 EGF 等因子而调节成纤维细胞、 血管内皮细胞、 角质形成细胞的活化、 增殖, 从而促进创面肉芽组织形成, 加快创面愈合。 VEGF 是特异性促血管内皮细胞生长因子, 具有多种生物活性,可有效促进血管内皮细胞增殖、 迁移, 增加血管通透性, 从而诱导新生血管形成。 EGF 是人体分泌的一种重要细胞生长因子, 可启动创面修复程序, 促进成纤维细胞增殖及上皮细胞生长, 增强表皮细胞活力, 加快创面再生修复[14]。 唐乾利等[15]的研究发现, MEBO 能够通过提高大鼠创面组织中VEGF及EGF mRNA 的表达水平而促进创面愈合。 本研究结果显示, MEBO 联合微粒皮种植治疗后糖尿病足创面组织中VEGF、 EGF 含量均呈明显升高的趋势, 创面面积均呈明显缩小的趋势, 与以往研究结果一致[16]。 但Pearson 相关系数分析结果显示, 创面组织中VEGF、 EGF 含量与创面面积无明显相关性, 与VEGF、 EGF 及创面面积的变化趋势不一致, 分析其原因可能与VEGF、 EGF 等相关生长因子之间相互制约有关, 有待进一步深入研究探讨。
综上所述, MEBO 联合微粒皮种植促进糖尿病足创面愈合的作用机制可能与VEGF、 EGF 表达水平的上调有关, 但外源性VEGF、 EGF 是否能促进新生血管生成、 肉芽组织生长而促进创面愈合, 且其长期安全性、 耐受性以及最佳用药浓度、 用药时间等问题仍有待进一步深入研究探讨。 另外, 糖尿病足的发病机制及创面修复过程还与多条信号传导通路、多种细胞因子的共同参与有关, 因此, MEBO联合微粒皮种植治疗糖尿病足的作用机制还需大样本、多中心的前瞻性研究进一步验证, 以期为创面的临床治疗提供确切的理论依据以及新的思路和策略。

