基于ISSR分子标记的白鹤芋遗传多样性分析
郭甜馨,MuhammadMoaaz Ali,颜喜玺,李 雪,简丽观,彭金彬,陈歆妍,赵锦河,彭俊贤,陈发兴 *
(1.福建农林大学园艺学院,福建 福州 350002;2.泉州市泉美生物科技有限公司,福建 泉州 362000;3.泉州市洛江区林业局技术推广站,福建 泉州 362000;4.泉州市洛江区市政公用事业管理中心,福建 泉州 362000;5.安溪县林业局,福建 泉州 362400;6.泉州市洛江区自然资源局,福建 泉州 362000)
0 引言
【研究意义】白鹤芋(Spathiphyllum kochiiEngl.& K.Krause)是天南星科(Araceae) 白鹤芋属(Spathiphyllum) 的多年生草本植物,别名白掌,是从南美地区引进的一种花叶俱美的阴生花卉[1]。自80年代以来,白鹤芋作为观赏草本植物被大量引进中国,并迅速在中国观叶植物产业得到推广[2]。白鹤芋对净化室内甲醛、苯系物等有害物质具有积极作用,且作为优良室内观叶植物,其佛焰苞最具观赏价值[3−4]。白鹤芋种质资源开发工作开展至今,已发现原生种41个,经杂交育种、体细胞无性系变异等育种手段培育出的栽培品种也已上百,其中有60多个申请美国植物专利[5−7]。目前国内白鹤芋市场进口品种较多,但引进时单位间缺乏沟通与协调,品种往往出现重复与交叉,加上组培技术应用于其大规模生产,导致白鹤芋品种固化、优良性状单一,不利于白鹤芋的商业化发展。因此,开发适宜的技术对鉴定白鹤芋种质资源、分析其遗传多样性尤为重要。【前人研究进展】简单重复序列区间(Intersimple sequence repeat,ISSR)在植物遗传多样性分析中应用较为普遍,通过人工合成ISSR引物,在SSR 5′或3′端加锚2~4个核苷酸的重复序列,重复4~8次,使引物长度达20 bp左右[8]。ISSR分子标记具有多态性强、不受环境限制、稳定性好等优点,与SSR相比,因其无需预知基因组序列,可极大提高操作效率,在遗传多样性分析中得到较广泛的应用[9]。目前对于白鹤芋的研究多集中于组培体系的构建[10−11]、观赏价值的开发及栽培管理技术的应用[1−13]等,在国内仅刘小飞等[14−15]采用 SSR 和 SRAP标记对部分白鹤芋品种进行亲缘关系的鉴定[14−15]。【本研究切入点】使用ISSR技术对白鹤芋进行遗传多样性分析的研究鲜见报道。【拟解决的关键问题】本研究利用ISSR分子标记技术对14份栽培品种和7份杂交品系共21份白鹤芋种质进行亲缘关系和遗传多样性分析,同时使用NTsys、TBtools软件进行聚类分析、相关性分析和主成分分析,拟探讨白鹤芋种质资源的亲缘关系及遗传多样性,为其种质资源的开发、利用与保护提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试白鹤芋 供试的白鹤芋材料共21份,均由泉州泉美生物技术有限公司提供,具体信息见表1,主要包括栽培种9份、杂交种5份、杂交品系7份,其佛焰苞性状见图1。采集时选取新鲜健康的嫩叶2~3片,用冰盒保存并立即带回实验室,用超纯水清洁后,放入−80 ℃冰箱保存备用。

图1 供试白鹤芋的佛焰苞Fig.1 Spathes of the different cultivars of Spathiphyllum
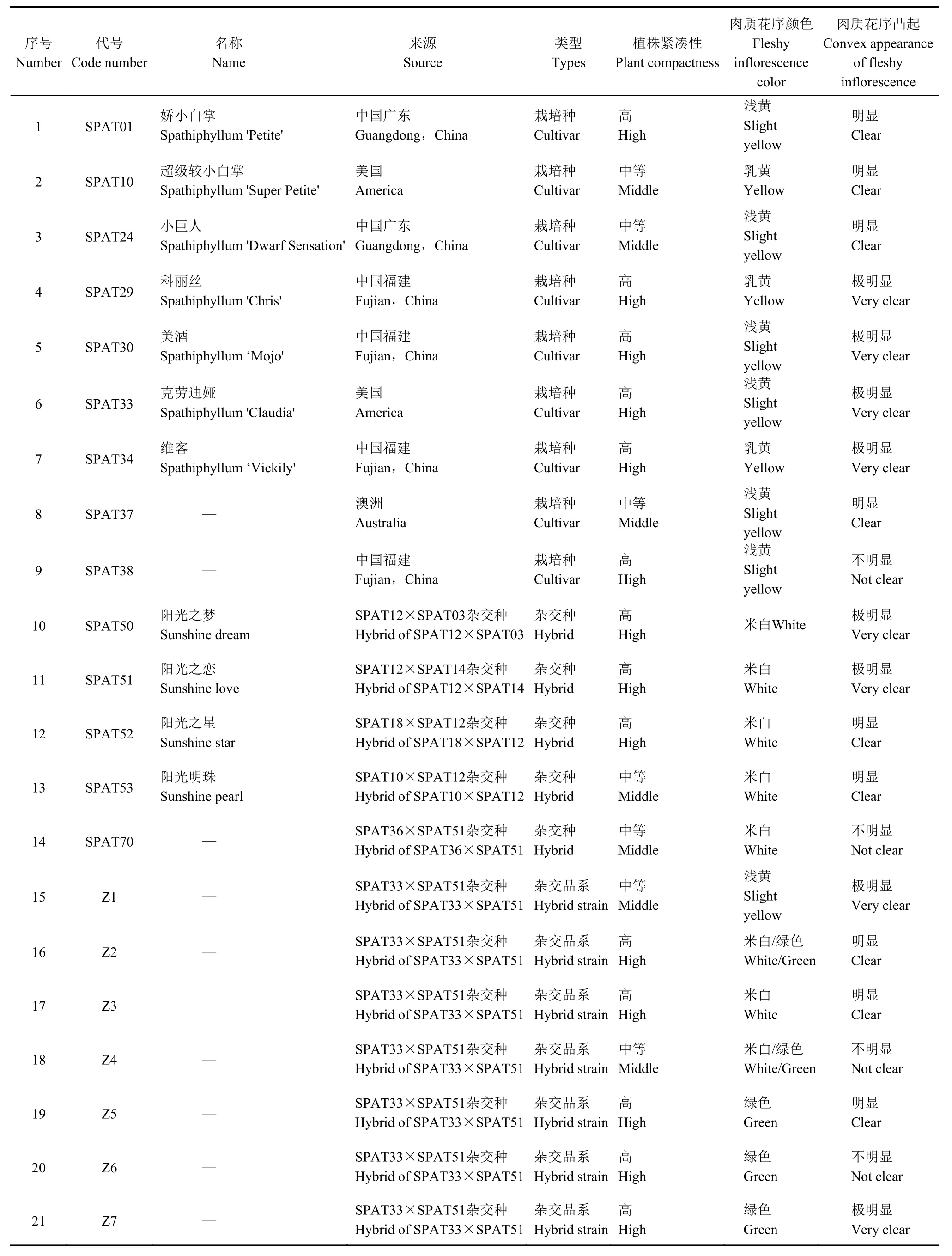
表1 供试白鹤芋信息Table 1 Spathiphyllum information of participants in the trial
1.1.2 试验试剂与仪器 试验试剂:DNA缓冲液参考李金璐的研究结果提前配置[16];无水乙醇(国药集团化学试剂有限公司);β-巯基乙醇(上海麦克林生化科技有限公司);氯仿-异戊醇(北京索莱宝科技有限公司);2 ×TaqMaster Mix 混合液、ddH2O(北京天根科技有限公司);琼脂糖(北京鉴联科技有限);ISSR引物采用加拿大哥伦比亚大学(University of British Columbia, Set No.9, No.801-900)提供的序列,并由上海生工生物工程有限公司合成。
试验仪器:Retsch MM400冷冻混合研磨仪(上海弗尔德仪器设备有限公司),精宏DK-500S水浴锅(山东博科再生医学有限公司),SCILOGEX MX-S涡旋振荡器(上海净信实业发展有限公司),IMS-50全自动雪花制冰机(常熟市雪科电器有限公司),Eppendorf 5804R冷冻台式离心机(上海土森视觉科技有限公司),WIX-EP300基础电泳仪(北京韦克斯科技有限公司),BIO-RAD PCR仪 T100(上海伯乐生命医学产品有限公司),BIO-RAD Gel Doc XR 凝胶成像仪(上海伯乐生命医学产品有限公司)。
1.2 试验方法
1.2.1 DNA 的提取及质量检测 按照李金璐等[16]的CTAB法进行DNA的提取,并根据白鹤芋的特性略作改动,其中使用研磨仪替代传统研钵研磨叶片,可获得较细植物粉末,以用于提取高质量DNA[17]。
制作1.5%的琼脂糖凝胶,用琼脂糖凝胶电泳检测DNA质量,通过与DNA marker相比较以推断DNA分子质量;根据电泳结果的条带表现推断DNA的纯度与浓度,若是一条集中条带与DNA marker分子质量大小相当,则表明DNA完整可靠,质量较高;若电泳条带出现脱尾、弥散现象,则表明出现DNA降解。用微量分光光度计检测DNA浓度与纯度,根据OD值分析纯度,以1.8左右为宜。
1.2.2 ISSR-PCR扩增反应 采用正交设计优化出适宜的白鹤芋ISSR-PCR反应体系,PCR扩增程序参考张晨光等[18]的方法并略作改动。PCR反应体系总体积20.0 μL, 其 中 含 20 ng·μL-1的 DNA 模 板 2.0 μL,2×TaqMaster Mix 添加量 10.0 uL,引物浓度为 0.8 μmol·L−1,剩余体积由 ddH2O 补充。PCR 反应程序为 94 ℃ 变性 5 min,94 ℃ 预变性 30 s,不同引物最佳退火温度下退火 30 s,72 ℃ 延伸 90 s,循环 40次,最后 72 ℃ 延伸 10 min,4 ℃ 保存。
1.2.3 ISSR-PCR 反应引物筛选 利用选定的 PCR 反应体系与程序,对100条ISSR引物进行筛选,以条带清晰明亮、多态性较好为选择标准;并在所选引物Tm±5 ℃的范围内,筛选引物最佳的退火温度。
1.2.4 ISSR-PCR 产物电泳检测 制作 1.5% 的琼脂糖凝胶,用琼脂糖凝胶电泳对PCR产物进行质量检测,设置100 V电泳40 min;电泳结束后,使用紫外凝胶成像系统拍照观察记录。
1.2.5 数据统计与分析 因ISSR为显性标记,同一引物下PCR产物电泳迁移率一致的条带具有同源性[9]。根据同一位点条带的有无记录电泳结果,有带的为扩增阳性,记为1,无带的为扩增阴性,记为0。将所得数据输入Excel表格,构建0-1数据矩阵。为反映各ISSR标记的多态性,计算各引物的多态条带百分率(Percentage of polymorphic bands,PPB)。并根据以下公式,计算ISSR标记位点的多态性信息含量(Polymorphism information content,PIC)[19]:
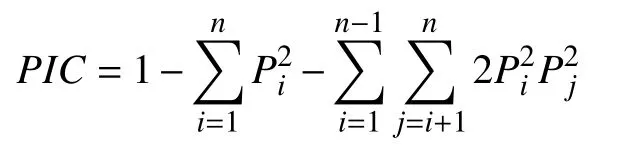
式中Pi、Pj分别为群体中第i、j个等位基因频率,n为等位基因数。
在此基础上,利用NTsys 2.10进行数据分析,计算品种间遗传相似系数,并进行非加权组平均法(Unweighted pair-group method with arithmetic mean,UPGMA)遗传相似度聚类分析,绘制品种间亲缘关系树状图。并使用TBtools进行相关性分析、主成分分析。
2 结果与分析
2.1 基因组 DNA 质量检测
使用CTAB法提取21份白鹤芋种质基因组DNA,经1.5%琼脂糖凝胶电泳检测,获得的条带清晰明亮、完整无污染,经微量紫外分光光度计测得其浓度为 400~700 ng·μL−1,OD 值为 1.7~2.0,质量完好。
2.2 ISSR 引物筛选
从100个ISSR引物中筛选适合白鹤芋ISSR-PCR反应的候选引物。经过初筛、次筛,最终筛选出稳定性强、多态性好的9个ISSR引物。并根据各引物熔解温度(Tm值)优化出适宜的退火温度,以用于基因组DNA的扩增。具体引物信息如表2所示。
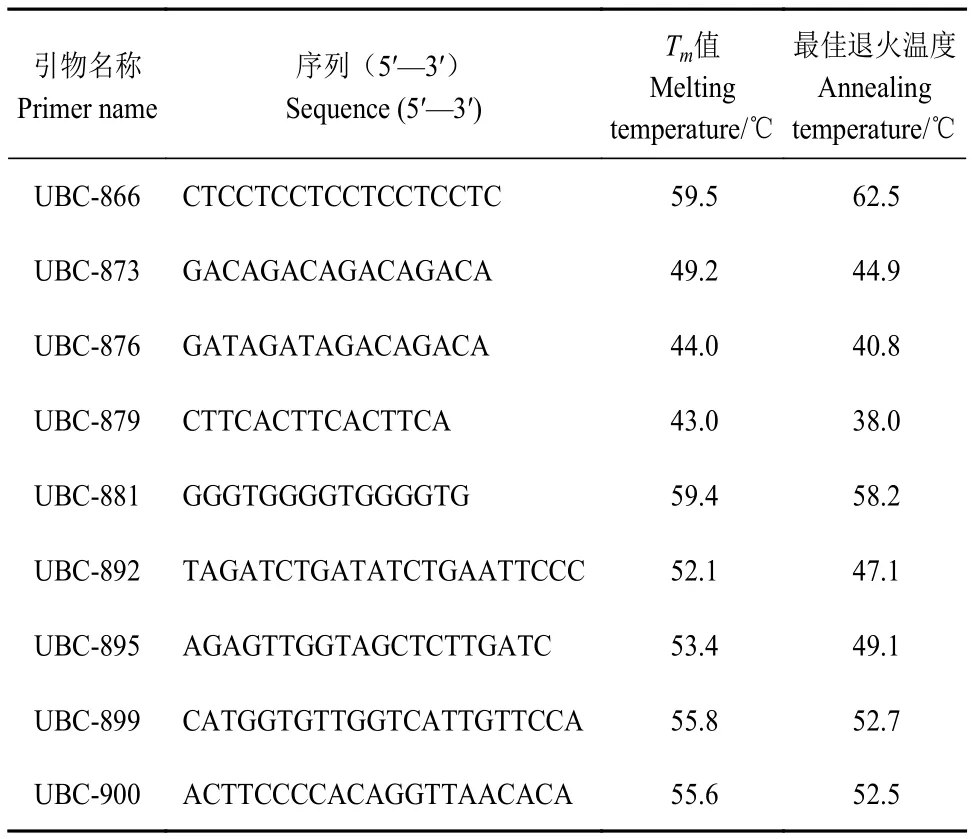
表2 筛选出的9条引物信息Table 2 Information of nine selected primers
2.3 ISSR-PCR 扩增结果分析
9个ISSR引物共扩增出133个位点,多态性位点有120个,多态位点百分率为90.23%。其中,扩增条带数最多的是引物UBC-900,扩增位点20个,其中多态性位点20个,多态位点比率为100.00%;扩增条带数最少的是引物UBC-876,扩增位点8个,其中多态性位点7个,多态位点比率为87.50%。
各引物的多态性扩增结果如表3所示,引物UBC-895、UBC-899扩增电泳图谱如图2所示。
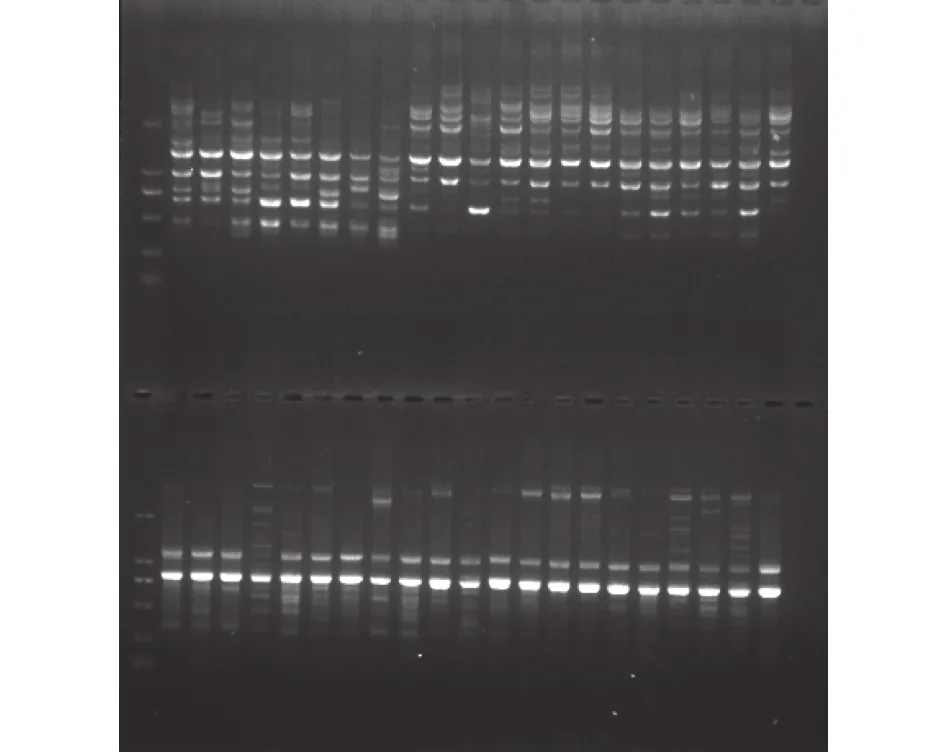
图2 引物UBC895、899对21份白鹤芋种质的扩增电泳图谱Fig.2 Electrophoretic patterns of 21 Spathiphyllum germplasm samples amplified with primer UBC895 and UBC899
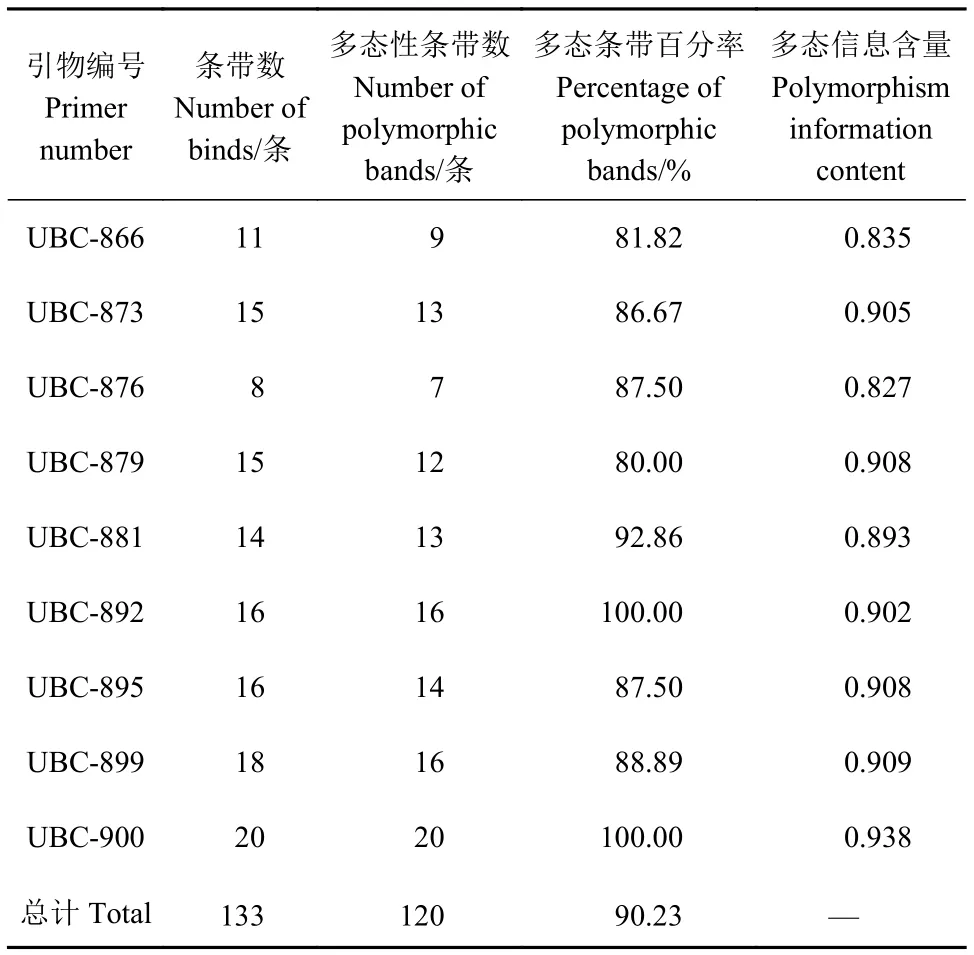
表3 9条引物多态性信息Table 3 Polymorphism information of 9 primers
2.4 14 个栽培品种的遗传多样性分析
2.4.1 聚类分析 聚类分析结果如图3所示,供试白鹤芋种质中14个栽培品种的遗传相似系数为0.58~0.81,变动幅度为0.23。其中SPAT10与SPAT29的相似系数最大,为0.81,表明它们的亲缘关系最近;SPAT01与SPAT24间的相似系数最小,为0.59,表明它们的亲缘关系最远。相似系数为0.67处按照种质来源将14份种质分为3组,第Ⅰ组主要包含8种栽培品种:SPAT10、24、29、30、33、34、37、38;第Ⅱ组主要包含5种由栽培种杂交选育的品种:SPAT52、50、51、53、70;第Ⅲ组仅有1种SPAT01,未与其他白鹤芋资源聚在一起,这表明SPAT01与其他品种之间亲缘关系较远,并且在形态上表现出株型紧凑、整体较矮,可在生产上用于杂交育种以开发性状,进一步丰富白鹤芋的种质资源。第Ⅰ组的8个栽培品种,虽来源广泛(美国、澳洲、中国等),但品种间遗传相似系数变动幅度较窄、亲缘关系较近,符合白鹤芋起源地集中于南美地区的客观事实。在遗传相似系数0.70处,按照植株株型及肉质花序形态可对第I组、第Ⅱ组进一步分组。在第Ⅰ组的栽培品种中,亚组1包含6个品种:SPAT10、29、30、33、34、37,表现中等株型、明显的肉质花序凸起;亚组2包含2个品种SPAT24、38,表现株型偏大、花序凸起较明显等性状。在第Ⅱ组利用栽培品种杂交选育出的5个杂交种中,亚组1包含3种:SPAT52、50、51,统一表现出株型紧凑茂密,但肉质花序凸起不明显;亚组2包含SPAT53、70,表现出株型较稀,肉质花序凸起明显、表面光滑。聚类分析结果表明,从种质来源及株型、花序形态等方面将14份栽培品种有效区分。
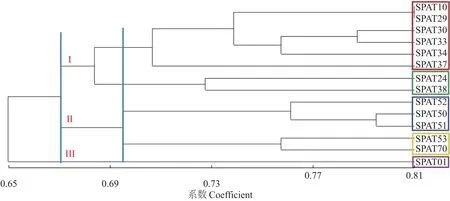
图3 14个白鹤芋栽培品种ISSR扩增条带的UPGMA聚类结果Fig.3 UPGMA clustering results of ISSR amplification bands of 14 cultivars of Spathiphyllum
2.4.2 主成分分析 利用 TBtools对 14 个栽培品种的ISSR标记数据矩阵进行主成分分析,检测品种间的相关性,结果如图4所示。图4-A表明相关性结果与基于遗传相似系数的聚类分析大体一致,其中SPAT10与SPAT29的相关性最高,为0.62;SPAT01与SPAT24之间的相关性最低,为0.17。图4-B显示所有品种均聚集在F1中,第一主成分的贡献率43.037%(特征值为6.03),表明第一主成分足以说明14个栽培品种的相关性。14个栽培品种被分为两大类,一为聚集在F1上象限的SPAT30、29、24、33、10、37、34,另一为SPAT52、50、38、51、58、70和01聚在同一因子的相反象限。可以看出PCA结果与聚类分析结果相同,但较之聚类分析结果,主成分分析更为直观地展示出14个栽培品种之间亲缘关系的远近,可作为聚类分析结果的印证与补充。
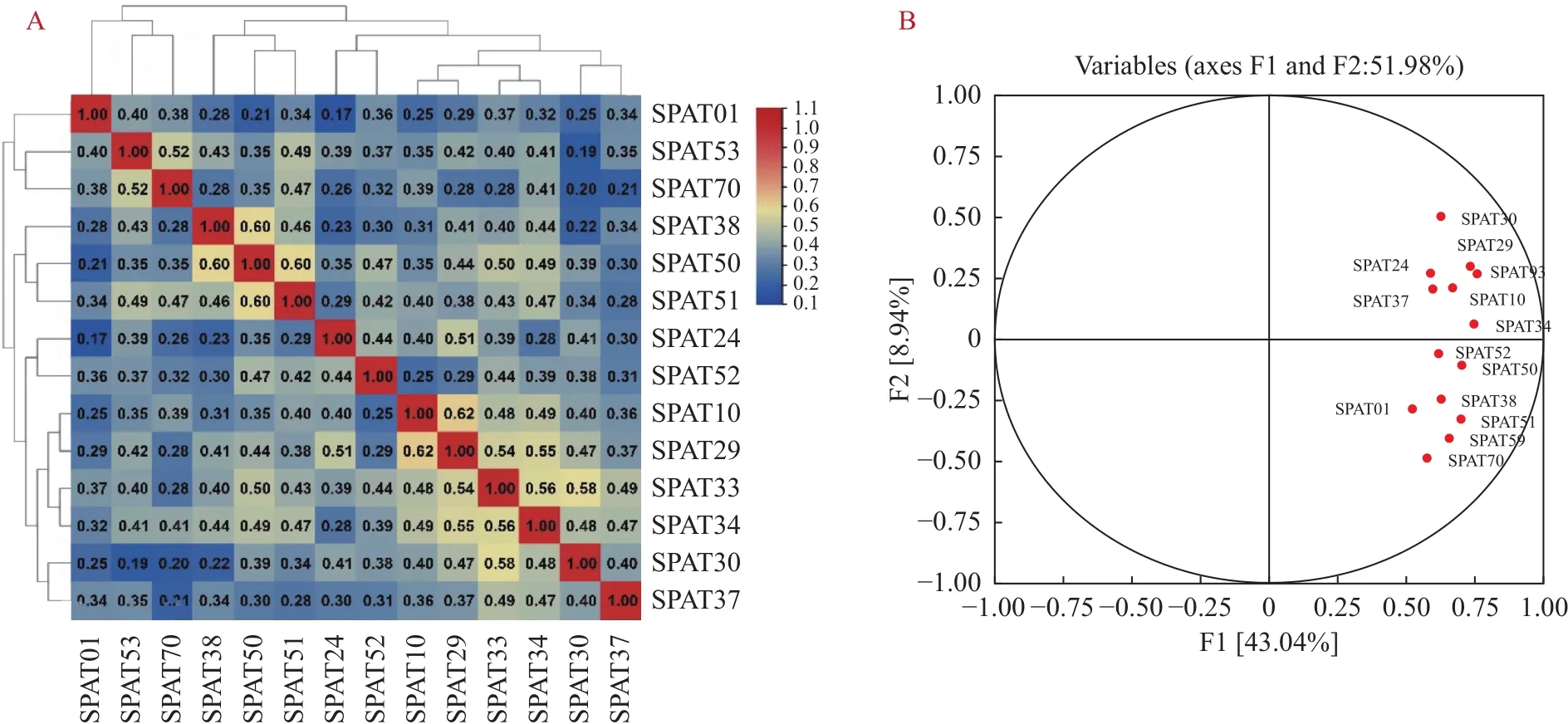
图4 14个白鹤芋栽培品种ISSR扩增条带的相关性分析、主成分分析Fig.4 Correlation analysis and principal component analysis results of ISSR amplification bands of 14 cultivars
2.5 7 个杂交品系与亲本间亲缘关系分析
以SPAT33为母本、SPAT51为父本,共获得7个杂交品系,分别记为Z1~Z7。聚类分析结果如图5所示,亲本与后代共9个个体的遗传相似系数为0.60~0.81,变动幅度为0.21。以0.670为阈值,可分为2类,第Ⅰ类为偏母本类(包括SPAT33、Z3、Z4、Z5、Z6、Z7),第Ⅱ类为偏父本类(包括SPAT51、Z1、Z2)。从外观形态上,亦可印证聚类结果,主要表现为:偏母本类中杂交品系个体之间株型等与母本相近;偏父本类中杂交品系个体 之间肉质花序短粗且呈白或绿的颜色,与父本性状相近。偏母本类可在相似系数0.6992处又分为2组,一组与母本关系较近(包含Z3~Z5),另一组表现为与母本关系稍远,这反映了Z6、Z7的佛焰苞发生明显变异,尤其是Z7出现一花序两苞片的现象(图6)。
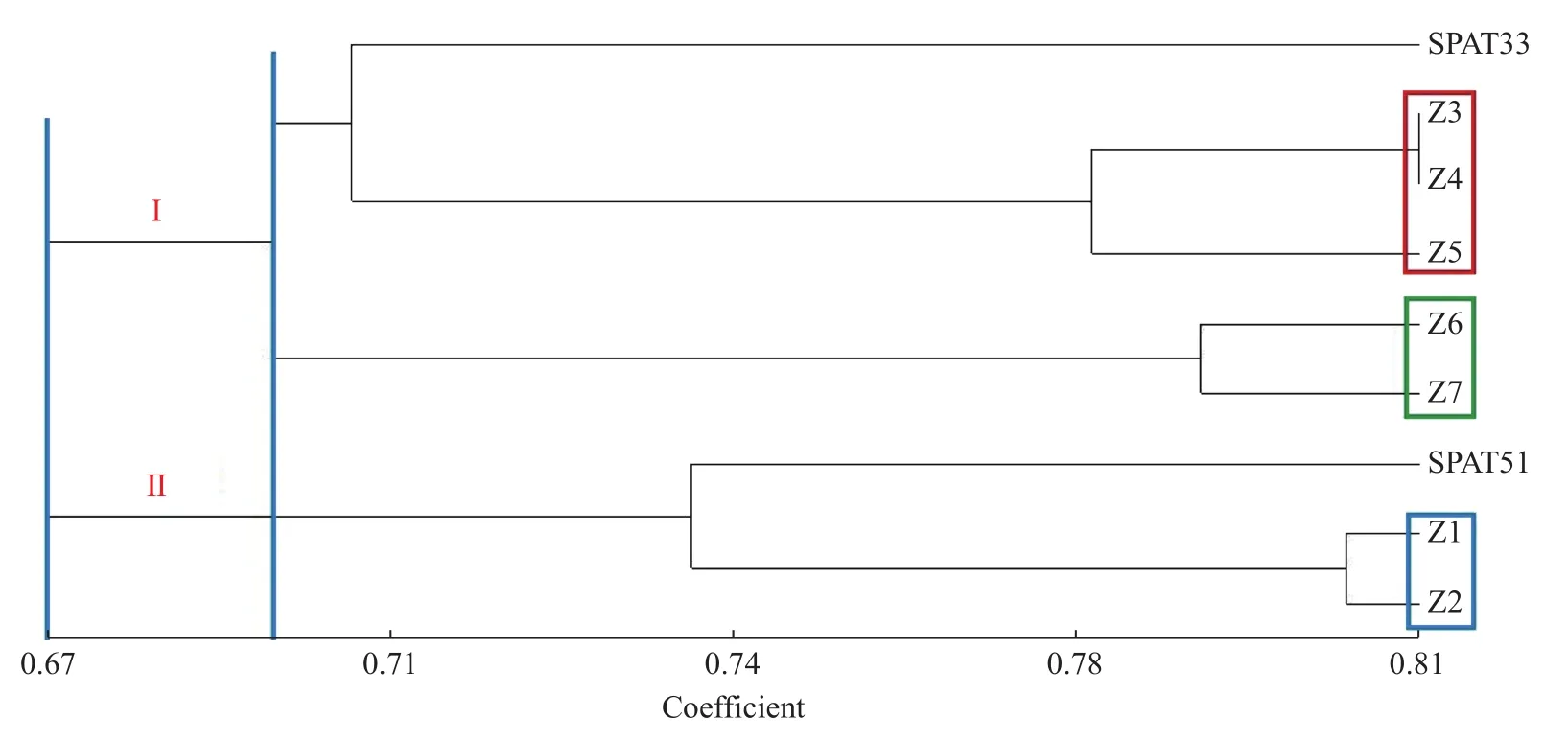
图5 7个杂交品系与亲本间ISSR扩增条带的UPGMA聚类分析Fig.5 UPGMA clustering of ISSR amplification bands between 7 hybrid strains and their parents

图6 Z7 双苞片变异Fig.6 Z7 double bract variation
3 讨论与结论
ISSR分子标记技术因其具有稳定可靠、操作简便、多态性强等优点在鉴定植物遗传多样性的研究中应用广泛。与其他的分子标记技术相比,它结合了SSR和RAPD的优点,比SSR和RAPD能更多地揭示多态性,提供较多的植物基因组信息[20]。本试验中,利用筛选的9个扩增清晰、多态性较好ISSR引物分别对14份白鹤芋品种和7个杂交品系进行分析,共扩增出133个位点,多态性位点有120个,多态位点百分率为90.23%,显示在白鹤芋的基因组中微卫星含量丰富,具有较强的多态性,也表明ISSR分子标记技术是适合白鹤芋品种鉴定的有效途径。
基于14个栽培品种与7个杂交品系间可比性较低,本试验分别对栽培品种之间以及杂交品系与其两亲本之间进行聚类,绘制亲缘关系树状图。14份栽培品种两两之间的遗传相似系数为0.58~0.81,变动幅度为0.23,从分子层面显示出白鹤芋起源单一,遗传基础狭窄。在遗传相似系数为0.67处按照种质来源将14份种质分组,第Ⅰ组为栽培品种类,第Ⅱ组为由栽培品种杂交选育的品种类,第Ⅲ组仅有一种SPAT01。在进一步对第Ⅰ、Ⅱ组分析时,则依据各品种的形态差异进行分类,结果表明从株型、佛焰苞的形态可有效区分白鹤芋品种。这也印证了岑彩娴[21]应用层次分析法得出的结论,即决定白鹤芋品质的性状主要为株型紧凑性、叶片和叶色、佛焰苞形态,符合白鹤芋作为室内观叶植物的基本特性。2亲本与其7个杂交品系共9份种质的聚类分析结果显示,两两之间的遗传相似系数为0.60~0.81,变动幅度为0.21。以0.67为阈值,可分为2类,第Ⅰ类为偏母本类,第Ⅱ类为偏父本类,聚类结果同样可从外观表型的差异上加以解释。总之在聚类分析时,从种质来源、形态学差异上可以有效地将不同白鹤芋品种区分开来,符合聚类结果的分析规律,也表明不同来源及不同的植物学表现是白鹤芋品种间的主要差别。
使用TBtools针对14个栽培品种的亲缘关系作相关性分析和主成分分析,分析所得与聚类结果相近,但从结果的呈现方式来看,主成分分析更能直观地显示各种质之间的关系,可与聚类分析结果相互印证与补充。刘小飞等[14]结合使用聚类分析和主成分分析后发现,系统聚类分析可以对亲缘关系较近的种质进行分析,但对亲缘关系较远的种质分析效果不理想,而主坐标分析方法可有效解决该问题。在本试验中也证实了这个观点,由于研究对象间遗传相似系数变动幅度较小,品种间亲缘关系较近,所以主成分分析的作用并不明显。今后在物种遗传多样性分析中,应掌握品种间遗传距离或遗传相似系数,判断品种间亲缘关系的远近,在此基础上再决定是否进行主成分分析,提高分析效率。
一直以来,为适应大规模商业化生产,组培技术在白鹤芋生产上应用较广,但长期以来观赏植物白鹤芋品种固化、优良性状单一,不利于白鹤芋的产业发展。探索杂交育种、倍性育种、诱变育种、生物技术育种等育种方式,以产生优良变异,培育新品种,丰富白鹤芋的遗传多样性。如刘小飞等[22]诱导无性系变异,经多年研究,选育出性状稳定、植株分蘖多、植株小、株型紧凑的银心梭品种;刘金梅等[23]探索了不同白鹤芋属植物杂交授粉和结实特性,建立杂交选育群体,对13个白鹤芋种进行组合授粉杂交试验,得出品种内易杂交,而种间杂交困难的结论,为杂交育种选育优良株系提供理论依据;周辉明等[24]以品种美酒的组培愈伤组织为材料,采用秋水仙素浸泡处理的化学诱变方法,选育出叶片增厚、叶色加深、茎杆变粗、叶柄变粗、花梗变粗、肉质花序变粗的四倍体白鹤芋新品种绿萌。由此可见,科学的育种手段有利于打破长久商业化模式下白鹤芋品种固化的危机局面,有利于丰富白鹤芋的种质资源。
在本研究中,将优良性状互补的两品种SPAT33和SPAT51的杂交品系也纳入试验,目的在于从分子层面鉴定杂交品系的优良变异,以辅助选育表型优良的新品种。ISSR对杂交品系的聚类中,Z7明显与其他个体分开,且有较大的性状变异,这表明分子层面的鉴定足以筛选出白鹤芋杂交中变异较大的个体,同时也证明ISSR分子标记具有辅助白鹤芋育种、丰富白鹤芋遗传多样性的潜力。
本试验研究对象主要集中于销量较高、流通较广的部分品种,并未大范围覆盖白鹤芋物种,因此仍需进一步加强收集种质、扩大研究范围,以更加科学地全盘分析鉴定白鹤芋的遗传多样性。当下缺乏白鹤芋种质的统一鉴定标准,而且引种引苗现象混乱,因此从分子层面对当前流通较广的白鹤芋品种进行分类具有重要意义。在掌握品种间的亲缘关系后,科学地选择杂交亲本,开展杂交试验,有利于发掘新的优良变异,进一步丰富白鹤芋的遗传多样性。

