赤霉素和干旱胁迫单一处理对珍稀濒危植物小溪洞杜鹃种子萌发的影响
李丹丹,李晓花,刘 杰,张乐华,①
(1.中国科学院庐山植物园,江西 庐山 332900;2.江西省植物迁地保护与利用重点实验室,江西 九江 332015)
杜鹃属(RhododendronLinn.)植物统称杜鹃花,种类繁多,花色艳丽,被誉为“花中西施”,为江西省省花,是世界三大高山花卉和中国十大传统名花之一。杜鹃属植物不但具有较高的观赏价值,还具有优良的山地水土保护能力[1],近年来已成为园林绿化的新宠;部分杜鹃属植物还具有很高的食用和药用价值[2],产业化前景广阔。中国是世界杜鹃属植物的地理起源以及现代分布和分化中心,拥有野生杜鹃属植物571种(含4个栽培种,不含种下分类等级),其中特有种409种[3];近十余年陆续发表新种约30种,目前中国杜鹃属植物已超过600种[4]。除宁夏和新疆外,其余省区均有分布,且集中分布在西南、华南、华中及华东等地区。受生态环境变化及人为干扰的影响,野生杜鹃属植物的数量急剧减少,2013年9月,中华人民共和国环境保护部和中国科学院联合编制了《中国生物多样性红色名录—高等植物卷》,该名录共收录杜鹃属植物644种(含种下分类等级),易危种、濒危种、极危种和灭绝种合计123种,占名录中杜鹃属植物总种数的19.1%。
小溪洞杜鹃(RhododendronxiaoxidongenseW.K.Hu)隶属于杜鹃属中的常绿杜鹃亚属〔Subgen.Hymenanthes(Bl.)K.Koch〕,为常绿灌木或小乔木,主要分布在林下或林缘,模式标本产地为江西井冈山。该种的花为纯白色,叶片密被绒毛,具有较高的观赏价值,被列为灭绝种[5]。庐山植物园相关人员在经过多次野外考察后,于2019年在井冈山上成功采集到小溪洞杜鹃的成熟种子,并进行了人工种子繁殖。为了有效保护和高效利用这一珍稀濒危植物资源,有必要对小溪洞杜鹃的种子繁殖技术进行研究。
分布区缩小、年龄结构衰退、生态适应能力弱、竞争能力差等是造成植物濒危的主要原因[6],种子萌发后形成的幼苗是植物繁衍后代、延续物种、扩大种群的基础。研究发现,种子萌发除了受种子大小、质量、外皮厚度等[7-9]自身表型特性影响外,还受温度[10]、光照[11,12]、水分[13]、激素[14-16]、基质[17]等外部环境因子的影响。赤霉素3(GA3)是一种常见的外源植物激素,研究发现GA3可以提高部分杜鹃属植物的种子发芽率,促进种子提前萌发,且适宜不同杜鹃属植物种子萌发的GA3浓度存在一定差异[18,19]。近年来,中国杜鹃属植物主要分布区(西南、华南、华中和华东)的干旱问题呈现面积扩大、程度加重、持续时间延长、频次增多的现状,严重降低了杜鹃属植物的种子活力,影响其种群更新[20]。
近年来,虽然有关杜鹃属植物种子萌发的研究已有较多研究报道[18,19,21-25],但尚未见关于小溪洞杜鹃种子萌发方面的研究报道。为此,笔者对小溪洞杜鹃的种实形态特征进行了观测,对不同质量浓度GA3浸种和不同质量体积分数聚乙二醇-6000(PEG-6000)模拟干旱胁迫条件下小溪洞杜鹃种子萌发指标进行了比较,并对GA3和PEG-6000浓度与种子萌发指标进行了Pearson相关性分析,以期筛选出适宜小溪洞杜鹃种子萌发的赤霉素浓度,初步判定小溪洞杜鹃的抗旱能力,从而为小溪洞杜鹃的种子繁育技术和抗旱性研究奠定研究基础,并为小溪洞杜鹃的引种驯化和保育、苗木繁殖栽培及野外回归等工作提供参考依据。
1 材料和方法
1.1 材料
于2019年12月在江西井冈山(具体地理坐标为东经114.113°、北纬26.076°)海拔1 640~1 680 m区域采集小溪洞杜鹃的成熟果实。将果实在室温条件下风干;待果实自然开裂后,收集种子,并置于通风干燥处保存、备用。选择籽粒饱满、大小均匀、表面无损伤且无病虫害的种子,用于形态特征观测和萌发实验。在萌发实验前,先用体积分数75%乙醇浸种1 min,再用蒸馏水冲洗若干次,备用。
1.2 方法
1.2.1 种实形态特征观测 采集10个成熟未开裂的果实,使用手持放大镜(100倍)观察果实形态。随机选取50粒种子,使用SMZ800N体视显微镜(日本Nikon公司)观察种子外观形态。随机选取100粒种子,使用电子游标卡尺(精度0.01 mm)测量种子的长(种子长轴的长度)和宽(种子短轴的长度),计算长宽比。随机选取100粒种子,使用电子天平(精度0.01 mg)测量种子百粒质量,重复测量8次,根据测量结果的均值计算种子千粒质量。
1.2.2 GA3浸种处理 在人工智能培养箱内分别使用质量浓度0(CK)、50、100、200和500 mg·L-1GA3溶液浸种36 h,GA3溶液用量以没过种子为宜,培养箱温度27 ℃;使用无菌滤纸吸干种子表面水分,放入铺有2层无菌滤纸的培养皿中,置于温度20 ℃、空气相对湿度68%、光照度5 500 lx、光照时间12 h·d-1的条件下进行萌发培养。每个培养皿100粒种子,每个处理3个培养皿,重复3次。每天定时向培养皿中滴加适量蒸馏水,每3 d更换1次滤纸,并及时挑出霉变的种子。
1.2.3 模拟干旱胁迫处理 实验共设置4个模拟干旱胁迫水平,分别使用质量体积分数0%(CK)、5%、10%和20%的PEG-6000溶液进行处理。将种子放入铺有2层无菌滤纸并浸透不同浓度PEG-6000溶液的培养皿中,置于前述条件下进行萌发培养。每个培养皿100粒种子,每个处理3个培养皿,重复3次。每天向培养皿中滴入适量的相应质量体积分数PEG-6000溶液,保持PEG-6000溶液浸透滤纸。
1.2.4 种子萌发指标测定 自发芽之日起,每24 h观测1次种子萌发情况,直至萌发实验结束(连续5 d无种子萌发)。在萌发实验结束时测定幼苗中的可溶性蛋白质含量。
以胚根长度达到种子长度的一半作为判定种子萌发的标准,统计种子的萌发时滞期、萌发峰值天数、萌发结束天数和平均发芽速率,并在萌发实验结束时计算发芽率、发芽势和发芽指数。其中,萌发时滞为实验开始到第1粒种子萌发的天数;萌发高峰期为实验开始到日萌发种子数最大时所需天数;萌发持续时间为第1粒种子萌发到最后1粒种子萌发的总天数;平均发芽速率、发芽率、发芽势和发芽指数计算公式分别为平均发芽速率=∑(实验期间每天对应的发芽天数×当天萌发种子数)/发芽种子总数、发芽率=(实验结束时萌发种子总数/供试种子总数)×100%、发芽势=(种子发芽高峰日的发芽种子数/供试种子总数)×100%、发芽指数=∑(实验期间每天发芽种子数/对应的天数)。
准确称取0.5 g新鲜幼苗,采用考马斯亮蓝G-250法[21]测定可溶性蛋白质含量,重复测定3次。
1.3 数据分析
使用EXCEL 2007软件整理实验数据,计算粒长和粒宽的变异系数,计算公式为变异系数=(标准偏差/均值)×100%。使用SPSS 19.0软件对相关数据进行方差分析(ANOVA),并对GA3和PEG-6000与种子萌发指标进行Pearson相关性分析。
2 结果和分析
2.1 小溪洞杜鹃的种实形态特征
观察发现,小溪洞杜鹃的果实为蒴果,呈肾形或圆柱形,具纵肋,密被长腺毛(图1-A);种子较为细小,呈长卵形,两端凸起;种子均具翅,沿纵缝线一侧的翅较为明显,且翅的一端较为尖锐,另一端较为平缓,腹缝线两侧的翅上均具有翅状纵棱,翅在种脐端收缢;种皮为黄褐色(图1-B)。

A: 果实形态Fruit morphology; B: 种子形态Seed morphology.
测量结果显示:小溪洞杜鹃种子长均值为3.15 mm,最大值4.16 mm,最小值2.43 mm,极差1.73 mm;种子宽均值为1.40 mm,最大值1.94 mm,最小值0.97 mm,极差0.97 mm,种子长和宽的变异系数均较高,分别为14.29%和17.86%。小溪洞杜鹃种子的长宽比较大,均值为2.35,变异系数为28.09%。小溪洞杜鹃种子千粒质量较小,均值为0.212 g,变异系数为10.38%。
2.2 赤霉素对小溪洞杜鹃种子萌发的影响
对不同质量浓度GA3处理组小溪洞杜鹃种子萌发情况进行比较,结果见表1。结果显示:不同质量浓度GA3处理组小溪洞杜鹃种子的萌发时滞无显著差异,并且,除500 mg·L-1GA3处理组外,其余处理组的萌发时滞均较对照(0 mg·L-1GA3)略短,其中200 mg·L-1GA3处理组的萌发时滞最短(9.7 d),较对照短1 d。不同质量浓度GA3对小溪洞杜鹃种子的萌发高峰期均较对照提前,但提高幅度不显著。不同质量浓度GA3处理组小溪洞杜鹃种子的萌发持续时间明显缩短,较对照短2~4 d,其中,500 mg·L-1GA3处理组的萌发持续时间最短(16.3 d),100 mg·L-1GA3处理组的萌发持续时间也很短(17.0 d),且这2个处理组的萌发持续时间均与对照差异显著(p<0.05)。与对照相比,50、100、200和500 mg·L-1GA3处理组小溪洞杜鹃种子的平均发芽速率均显著下降,但这4个处理组间的平均发芽速率差异不显著。
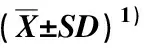
表1 不同质量浓度GA3对小溪洞杜鹃种子萌发的影响
不同质量浓度GA3处理组小溪洞杜鹃种子的发芽率和发芽势均无显著差异,但各处理组的发芽率和发芽势均高于对照。随着GA3质量浓度升高,发芽率呈现“升高—降低”的变化趋势,其中100 mg·L-1GA3处理组的发芽率最高(86.7%),较对照高17.2%;发芽势也随着GA3质量浓度升高呈现“升高—降低”的变化趋势,以50 mg·L-1GA3处理组的发芽势最高(53.0%)。随着GA3质量浓度升高,小溪洞杜鹃种子的发芽指数亦呈现“升高—降低”的变化趋势,以100 mg·L-1GA3处理组的发芽指数最高(33.0);并且,50、100、200和500 mg·L-1GA3处理组的发芽指数均显著高于对照,但这4个处理组间的发芽指数差异不显著。
不同质量浓度GA3处理组小溪洞杜鹃幼苗的可溶性蛋白质含量存在明显差异。其中,50和200 mg·L-1GA3处理组的可溶性蛋白质含量均高于对照,但与对照的差异不显著;100 mg·L-1GA3处理组的可溶性蛋白质含量最低(0.75 mg·g-1),且显著低于对照和其他处理组;500 mg·L-1GA3处理组的可溶性蛋白质含量最高(1.12 mg·g-1),且显著高于对照和其他处理组。
相关性分析结果表明:GA3质量浓度与小溪洞杜鹃种子萌发指标的相关性表现为与萌发时滞和可溶性蛋白质含量呈显著正相关,相关系数分别为0.584和0.627;与萌发高峰期和萌发持续时间分别呈极显著(p<0.01)和显著负相关,相关系数分别为-0.661和-0.554;与发芽指数呈较弱的正相关;与平均发芽速率、发芽率和发芽势呈较弱的负相关。
2.3 干旱胁迫对小溪洞杜鹃种子萌发的影响
使用不同质量体积分数PEG-6000模拟干旱胁迫条件,对各处理组小溪洞杜鹃种子萌发情况进行比较,结果见表2。由表2可见:随着PEG-6000质量体积分数增大,小溪洞杜鹃种子的萌发时滞呈现“提前—推迟”的变化趋势;其中,质量体积分数5%PEG-6000处理组萌发时滞最短,且显著(p<0.05)短于对照(质量体积分数0%PEG-6000)和其他处理组,而质量体积分数20%PEG-6000处理组的萌发时滞最长(16.3 d),且显著长于对照和其他处理组。随着PEG-6000质量体积分数增大,小溪洞杜鹃种子的萌发高峰期基本上呈现逐渐推迟的趋势;其中,质量体积分数20%PEG-6000处理组的萌发高峰期最迟(21.0 d),较对照和其他处理组显著推迟,而质量体积分数5%和10%PEG-6000处理组的萌发高峰期较对照略推迟,且这2个处理组间的差异不显著。质量体积分数5%、10%和20%PEG-6000处理组小溪洞杜鹃种子的萌发持续时间存在显著差异;其中,质量体积分数10%PEG-6000处理组的萌发持续时间最短(19.7 d),且显著短于对照和其他处理组,而质量体积分数20%PEG-6000处理组的萌发持续时间最长(25.7 d),且显著长于对照和其他处理组。随着PEG-6000质量体积分数增大,小溪洞杜鹃种子的平均发芽速率呈现“降低—升高”的变化趋势;其中,质量体积分数5%和10%PEG-6000处理组的平均发芽速率分别较对照略降低和略升高,而质量体积分数20%PEG-6000处理组的平均发芽速率最高(20.9 d),且显著高于对照和其他处理组。
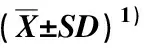
表2 不同质量体积分数PEG-6000对小溪洞杜鹃种子萌发的影响
总体来看,随着PEG-6000质量体积分数的增大,小溪洞杜鹃种子的发芽率、发芽势和发芽指数均呈现逐渐下降的趋势;其中,质量体积分数20%PEG-6000处理组的3个指标均最低,并且,发芽率和发芽指数显著低于对照和其他处理组。与对照相比,质量体积分数20%PEG-6000处理组的发芽率降低了42.8%,发芽势降低了41.3%,发芽指数降低了70.6%。
随着PEG-6000质量体积分数的增大,小溪洞杜鹃幼苗的可溶性蛋白质含量呈现“降低—升高”的变化趋势。其中,质量体积分数5%PEG-6000处理组的可溶性蛋白质含量最低(0.72 mg·g-1),且显著低于对照和其他处理组;质量体积分数10%PEG-6000处理组的可溶性蛋白质含量与对照接近;质量体积分数20%PEG-6000处理组的可溶性蛋白质含量最高(2.55 mg·g-1),且显著高于对照和其他处理组。
相关性分析结果表明:PEG质量体积分数与小溪洞杜鹃种子萌发指标的相关性表现为与种子的萌发时滞、萌发高峰期、平均发芽速率和可溶性蛋白质含量呈极显著(p<0.01)正相关,相关系数分别为0.918、0.849、0.832和0.860;与发芽率和发芽指数分别呈显著和极显著负相关,相关系数分别为-0.620和-0.811;与萌发持续时间呈较弱的正相关,与发芽率呈较弱的负相关。
3 讨论和结论
观测发现,小溪洞杜鹃种子较为细小,且具翅,有助于其种子的传播扩散。但是,种子小意味着种子中贮藏的营养物质和能量有限,这可能是小溪洞杜鹃自然更新困难的重要原因。有研究表明:植物的种子形态和种皮颜色会对种子萌发造成一定的影响[26],因此,在后续研究中应关注小溪洞杜鹃种子形态特征是否对其种子萌发有影响。
相关研究表明:植物种子能否正常萌发直接决定了其种群能否实现自然更新[27]。外源激素可通过调控种子内可溶性糖含量、抗氧化酶活性和基因协同表达等来影响种子萌发[28,29],如适宜浓度的GA3可降低种子萌发过程中膜脂过氧化产物的含量,打破种子休眠[26];赤霉素(GA)可增加种子中的α-淀粉酶活性,促进细胞分裂,助力种子萌发[30]。不同种类杜鹃属植物种子萌发的适宜外源激素浓度存在一定差异,如毛毡杜鹃(R.confertissimumNakai)种子经500 mg·L-1GA3浸种后萌发效果最好[24],而露珠杜鹃(R.irroratumFranch.)种子萌发的最佳GA3质量浓度为250 mg·L-1[26]。本研究结果表明:GA3对小溪洞杜鹃种子萌发有一定的促进作用,以100 mg·L-1GA3处理组的萌发效果最明显,萌发持续时间和平均发芽速率均最低,但发芽率和发芽指数均最高,并且该处理组幼苗的可溶性蛋白质含量最低,说明100 mg·L-1GA3有助于小溪洞杜鹃种子萌发和幼苗生长,推测100 mg·L-1GA3还可能加快可溶性蛋白质的分解和代谢,促进种子萌发后幼苗的生长。500 mg·L-1GA3虽然也能促进小溪洞杜鹃种子萌发(发芽率、发芽势和发芽指数均高于对照,萌发高峰期和萌发持续时间均较对照提前),但幼苗中的可溶性蛋白质含量却显著高于对照(0 mg·L-1GA3),说明500 mg·L-1GA3对小溪洞杜鹃种子萌发有一定的促进作用,但对幼苗生长有一定的阻碍。这可能是因为较高浓度的GA3会干扰种子的正常代谢过程[31],也可能是因为在幼苗体内合成了较多的蛋白质,以调节渗透压和核酸代谢过程[32],从而适应逆境条件。
水分是决定植物种子能否萌发的必要条件之一,只有种子的吸水量达到萌发所需水平时,种子才有萌发的可能[33]。小溪洞杜鹃适宜生长在海拔1 390~1 700 m的林下潮湿环境中,然而,由于近年来极端气候频繁发生和人类过度开发利用,使其自然更新苗越来越少,种群扩大繁殖遭到严重阻碍,导致其逐渐走向濒危甚至灭绝[34]。种子萌发是环境与基因共同作用的结果[35],并且种子在萌发过程中极易受到盐分、干旱和寒冷等非生物胁迫的影响[36]。近年来,利用PEG模拟干旱胁迫被广泛用于植物种子萌发耐旱机制研究[37,38]。本研究采用不同质量体积分数PEG-6000模拟干旱胁迫条件,对不同干旱胁迫下小溪洞杜鹃种子萌发差异进行了比较。总体来看,质量体积分数5%和10%PEG-6000处理组,小溪洞杜鹃种子萌发多数指标与对照(质量体积分数0%PEG-6000)无显著差异,且部分指标优于对照,说明小溪洞杜鹃具有一定的耐旱能力,质量体积分数5%~10%PEG-6000不但不会抑制小溪洞杜鹃种子的萌发,还会促使种子打破休眠,这一研究结果与边才苗等[25]对云锦杜鹃(R.fortuneiLindl.)干旱胁迫响应的研究结果相似。值得注意的是,质量体积分数5%PEG-6000处理组小溪洞杜鹃幼苗的可溶性蛋白质含量最低,推测这可能是因为该胁迫条件促使小溪洞杜鹃幼苗获得了一定的抗逆能力,因此,可通过用质量体积分数5%PEG-6000浸种的方式提高小溪洞杜鹃的抗旱性。质量体积分数20%PEG-6000处理组小溪洞杜鹃种子的萌发时滞、萌发高峰期和萌发持续时间较对照显著推迟,发芽率和发芽指数显著低于对照,而幼苗的可溶性蛋白质含量却显著高于对照,说明该胁迫条件对小溪洞杜鹃种子萌发有较强的抑制作用,对幼苗生长不利。研究发现,外源GA3可提高低盐胁迫下种子的发芽率,并且发芽率会随着GA3浓度提高而增大[39]。那么,GA3能否促进干旱胁迫下小溪洞杜鹃种子的萌发呢?为了弄清这一问题,应开展不同浓度GA3和不同干旱胁迫条件下小溪洞杜鹃种子萌发的系统研究,从而筛选出可促进干旱条件下小溪洞杜鹃种子萌发的最佳GA3浓度,为探讨小溪洞杜鹃的耐旱机制和完善其耐旱评价体系提供基础资料。
综上所述,GA3和PEG-6000单一处理均会对小溪洞杜鹃种子萌发产生一定的影响。从相关系数看,PEG-6000对小溪洞杜鹃种子萌发的影响更大。100 mg·L-1GA3可显著缩短小溪洞杜鹃种子的萌发高峰期和萌发持续时间,显著提高发芽指数并降低幼苗中可溶性蛋白质含量,但萌发时滞、发芽率和发芽势无显著变化。总体来看,小溪洞杜鹃具有一定的耐旱性,幼苗可通过调节体内可溶性蛋白质含量来适应低水平干旱胁迫环境。
众所周知,影响植物种子萌发的外因有很多,包括贮藏条件、温度、光照和化学试剂处理等,建议在实施就地保护和迁地保育的基础上,系统分析造成小溪洞杜鹃种子发芽率低的主要内因和外因,并结合小溪洞杜鹃植株形态结构特性深入解析小溪洞杜鹃的成苗机制;探究通过人工抚育方式增加小溪洞杜鹃的个体数量,提高其种群的自然更新能力,并在条件允许的情况下进行回归野外研究,扩大其种群数量,缓解甚至摆脱濒危现状。

