食管空肠π形吻合术在完全3D腹腔镜下根治性全胃切除术中的应用
龚佑红 吴艳烈
目前我国胃癌的发生率在男性肿瘤病人中排第2位,女性肿瘤病人排第5位,死亡率分别为第3位、第 2位[1]。对于胃体、胃底、贲门腺癌的病人,根治性全胃切除术为主要手术方式。目前国内大部分学者采取腔镜辅助切口下施行Roux-en-Y吻合,但对于肥胖、左肝叶肥大或吻合口位置高等病人,因食管胃结合部空间狭小,加大了吻合的困难。食管空肠吻合是全胃切除术消化道重建的技术难点[2]。2016年Kwon等[3]及杨力等[4]先后报道π形吻合技术,均获得成功。本研究回顾性分析行完全腹腔镜根治性全胃切除术及腔镜辅助根治性全胃切除术病人的临床资料,探讨完全腹腔镜根治性全胃切除术食管空肠改良π形吻合的围手术期疗效。
对象与方法
一、对象
2019年1月~2021年7月间行3D腹腔镜下根治性全胃切除术病人70例,根据吻合方式分为两组,观察组30例,男18例,女12例,采用全腹腔镜下食管空肠改良π形吻合术。对照组40例,男24 例,女16 例,采用腔镜辅助下根治性全胃切除食管空肠端侧吻合术。纳入标准:(1)术前胃镜及病理检查确诊为胃体、胃底、贲门腺癌;(2)术前分期为Ⅰ~Ⅲ期,无远处转移。排除标准:Ⅳ期胃癌;行新辅助化疗或转化治疗;中转开腹;有其他合并症。两组病人年龄、性别、体质指数(BMI)、病理学特征(肿瘤浸润深度、区域淋巴结转移、淋巴结清扫数量、肿瘤分化程度、神经浸润、脉管浸润) 比较差异无统计学意义(P>0.05) 。见表1。
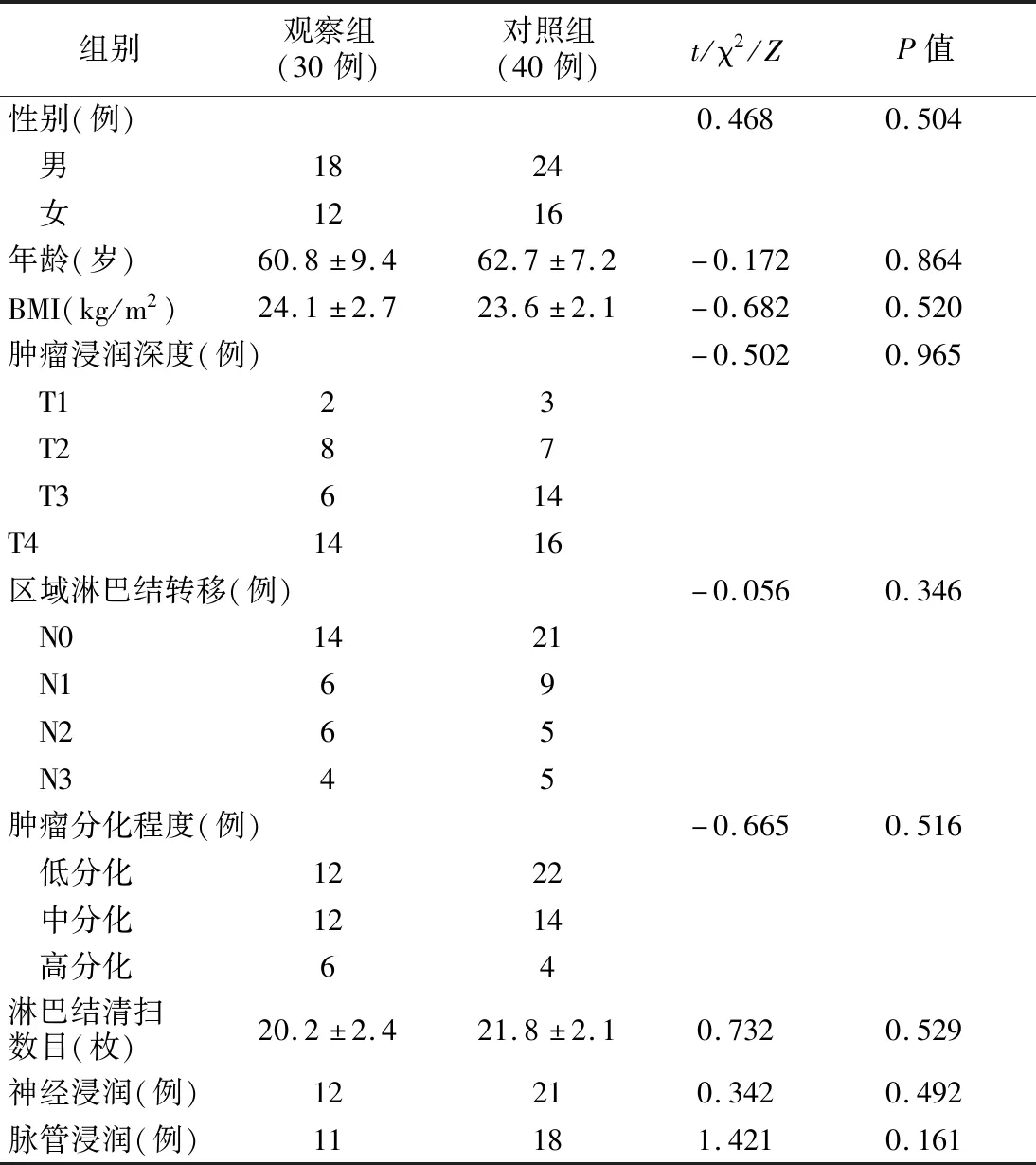
表1 两组病人一般资料比较
二、方法
1.手术方法:大字位,腹腔镜戳卡按照五孔法布局。术者位于病人左侧,助手站右侧,扶镜手站双腿之间。(1)观察组:按照胃癌根治术要求,离断胃周血管及清扫淋巴结,腹腔镜下60 mm直线切割闭合器离断幽门下2 cm处十二指肠,十二指肠残端用3-0可吸收缝线荷包缝合包埋。寻找距屈氏韧带约25 cm处空肠,离断系膜,裸化肠管,超声刀切开远端空肠,在不离断食管的前提下向下牵拉食管并切开食管右侧壁,腹腔镜下60 mm直线切割闭合器于结肠前完成食管空肠侧侧吻合,再以直线切割闭合器关闭食管空肠共同开口,一并离断食管及空肠,吻合口呈π形,将此吻合口远端空肠肠壁缝合固定于膈肌脚,达到减轻吻合口张力的目的。继续以腹腔镜下直线切割闭合器完成近端空肠与食管空肠吻合口下方45 cm处空肠侧侧吻合,以直线切割闭合器关闭空肠共同开口,吻合口均以3-0可吸收线缝合加固,最后关闭系膜裂孔。取上腹部正中5~6 cm切口,经此切口取出标本(图1)。(2)对照组:游离、血管离断及淋巴结清扫同观察组。幽门下2 cm离断十二指肠后,取上腹部正中切口,长约8~12 cm,逐层切开入腹,置入切口保护套,牵拉食管,距离肿瘤近端约3 cm处置入荷包钳,离断食管,移除标本,食管断端置入25 cm强生吻合器蘑菇头以备吻合。寻找距屈氏韧带约25 cm处空肠,分离空肠系膜,离断空肠。提拉远端空肠与食管完成端侧吻合,近端空肠与距离此吻合口下方45 cm 处空肠完成空肠-空肠端侧吻合,3-0可吸收线缝合关闭残端,最后关闭系膜裂孔。
2.观察指标:记录两组手术时间、术中出血量、术中吻合时间、切口长度、术后疼痛感、术后排气时间、进食时间、住院时间及术后并发症(吻合口漏、吻合口出血、狭窄、腹腔感染)等。
三、统计学方法

结果
1.两组术中情况比较见表2。结果表明,两组病人术中均未发生中转开腹。两组手术时间、术中出血量比较差异均无统计学意义(P>0.05) 。两组手术切口长度、吻合时间比较,差异有统计学意义(P<0.05)。

表2 两组病人术中情况比较

A.幽门下2 cm直线切割闭合器切断十二指肠;B.不离断食管,向下牵拉食管;C.结肠前完成食管空肠侧侧吻合;D.直线切割闭合器关闭食管空肠共同开口,一并离断食管及空肠;E.食管-空肠吻合口呈π形;F.直线切割闭合器完成近端空肠与食管空肠吻合口下方45 cm处空肠侧侧吻合;G.直线切割闭合器关闭空肠共同开口;H.关闭系膜裂孔
2.两组术后恢复情况比较见表3。结果表明,两组病人术后排气时间、术后进食时间、术后住院时间比较差异均无统计学意义(P>0.05) 。观察组术后第1天及术后第3天的VAS评分低于对照组,差异有统计学意义(P<0.01)。

表3 两组病人术后恢复情况比较
3.两组术后并发症比较:两组均为R0切除,所有病例最终病理均为腺癌,均无死亡病例。观察组围手术期未出现吻合口漏等并发症,发生胸腔积液并肺部感染1例,气胸1例,经抗感染、胸腔闭式引流等治疗后好转。对照组发生吻合口漏、腹腔感染1例,通过禁食、禁水、抗感染、抑制分泌、营养支持治疗及经腹腔引流管冲洗等综合治疗好转出院。切口感染1例,伤口换药后好转;发生肺部感染1例,经抗感染治疗后好转。观察组及对照组术后总体并发症发生率分别为6.67%(2/30)和7.50%(3/40),两组比较差异无统计学意义(P>0.05) 。
讨论
近年来,随着腹腔镜设备的不断进步与发展,外科医师对腹腔镜下操作技能的不断熟练,胃癌手术经历了由开腹、手助腹腔镜、腹腔镜辅助到全腹腔镜手术的发展过程。随着3D腹腔镜的诞生,血管的裸化与离断、规范的淋巴结清扫等过程更加精准、迅速,这为外科医师完成镜下操作难度较高的手术提供了更好的操作平台。对于胃体、胃底、贲门的肿瘤,手术以全胃切除为主,目前有完全腹腔镜及腹腔镜辅助全胃切除术两种手术方式,区别在于是否于腹腔镜下完成食管空肠吻合口的吻合。目前,国内多数学者采用辅助小切口行Roux-en-Y吻合,以管形吻合器实现食管空肠吻合。此术式因切口较小,视野受限,造成吻合过程操作的困难[5]。尤其是在肥胖病人及吻合口位置过高等情况下,辅助小切口下管形吻合器难以实现直视下吻合。为了获得良好的手术视野、保障吻合口安全,通常需要适当延长辅助切口的长度,甚至与开腹手术切口长度相当,这也有违微创理念的初衷。本研究显示,观察组的手术切口长度短于对照组,这与国内其他学者研究基本一致[6]。手术切口的缩小不仅带来视觉上的美观,更减少了对腹壁结构的破坏,术后病人疼痛感明显降低。本研究结果显示,观察组病人术后第1天和第3天VAS评分均明显低于对照组组。
腔镜辅助手术通常使用管形吻合器进行食管空肠吻合,此方法借鉴了开腹手术的吻合方法。完全腹腔镜手术也有利用管形吻合器进行吻合,如直接置入法、反穿刺法、Orvil法等。相较于管形吻合器遮挡视野等缺点,直线切割吻合器更适合于镜下吻合。Kwon等[3]于2016年首次报道腹腔镜下应用直线切割闭合器完成π形吻合,π形吻合脱离了原来“先离断后吻合”的理念,术中先进行食管空肠吻合,再离断食管空肠,将胃切除、空肠离断、共同开口关闭三步并成一步完成,达到降低吻合难度,减少吻合时间的目的。本研究显示,观察组术中无需在镜下放置抵钉座,且视野开阔,吻合时间明显短于观察组。据报道,π 形吻合术后并发症发生率大概在2.2%~25%之间[7-8]。本中心开展的30例全腹腔镜下全胃切除食管空肠π形吻合术,术后发现肺部感染2例,发生率6.67%,经积极对症治疗后好转。
吻合口漏是胃肠道手术术后最严重的并发症,部分病人甚至需要二次手术。其原因可能与吻合口缺血、张力过大有关。食管空肠吻合口张力主要来源于空肠系膜对吻合口的牵拉。本研究中30例行π形吻合的病人,无吻合口漏、出血等并发症发生。分析其原因,可能与以下因素有关:(1)π形吻合在完全腹腔镜直视下完成吻合,确保上提的远端空肠在无张力条件下与食管进行吻合,减轻了吻合口张力;(2)术中将吻合口远端空肠肠壁缝合固定于膈肌脚,对抗空肠对吻合口的牵拉,确保吻合口无张力;(3)π形吻合利用直线切割闭合器在食管、空肠自然伸展状态下吻合,避免空肠扭转,避免过度牵拉吻合口,保障吻合口血运。由于直线切割闭合器的吻合线是沿食管方向向上的,因此π形吻合亦有局限性。对于肿瘤位置过高的病人,π形吻合需要游离更长的食管进行吻合,部分需要进入纵隔腔,容易损伤胸膜导致气胸。本研究出现1例气胸与此有关。另外,吻合口上缘太高,增加了吻合口漏的发生率。因此,我们认为,π形吻合不适用于肿瘤位置较高的病人。
综上所述,完全腹腔镜根治性全胃切除术食管空肠π形吻合术式相较于腹腔镜辅助下腹腔镜食管空肠端侧吻合术式,其创伤更小、疼痛感更轻,吻合过程安全且用时更短,不增加吻合口漏的发生率,近期疗效值得肯定。但需要严格掌握手术适应征。

