信迪利单抗联合化疗一线治疗晚期或复发性非小细胞肺癌的成本-效用分析Δ
高红婷,胡梦雪,贾琳琳,吴方,侯艳红(中国药科大学国际医药商学院,南京 211198)
肺癌是最常见的恶性肿瘤之一,其发病率和患者死亡率在全球和中国均位居首位[1],2022年中国预计将有87万肺癌新增确诊病例和77万死亡病例[2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是我国最多见的肺癌类型,约占我国肺癌总例数的80%~85%,且隐匿性较强,大多数NSCLC患者确诊即晚期[3]。据统计,25%~35%的晚期NSCLC患者体内至少有50%的肿瘤细胞能检测到程序性死亡受体配体1(programmed death-ligand 1,PD-L1)呈阳性[4]。而研究表明,程序性死亡受体1(programmed death 1,PD-1)和PD-L1抗体是未经治疗的转移性非鳞状无驱动基因突变NSCLC的有效疗法[5]。
信迪利单抗是一种选择性的PD-1抗体,可抑制PD-1与其配体PD-L1之间的相互作用。根据临床前研究数据,信迪利单抗与其他同类型单抗相比,具有不同的结合位点并且可能对PD-1具有更大的亲和力[6]。一项ⅠB期临床研究发现,信迪利单抗联合培美曲塞和铂类药物在未经治疗的中国非鳞状NSCLC患者中具有可耐受的安全性和良好的疗效,其客观缓解率(objective response rate,ORR)为68.4%,患者中位无进展生存(progressionfree survival,PFS)时间为11.4个月[7]。随后的ORIENT-11研究结果显示,信迪利单抗联合化疗一线治疗晚期NSCLC的效果显著优于单纯化疗,且联合化疗组患者的中位PFS时间长于单纯化疗组(8.9个月vs.5.0个月)[8]。
2021年12月3日,我国新一轮医保谈判结果出炉,信迪利单抗继复发或难治性经典型霍奇金淋巴瘤适应证后,进一步扩大了医保适应证范围,获批非鳞状、鳞状NSCLC和不可切除或转移性肝细胞癌的一线治疗适应证,价格也进一步降至1 080元[100 mg(10 mL)/瓶][9]。由于治疗方案的经济性对医疗决策至关重要,因此本研究从我国卫生体系的角度出发,对降价后信迪利单抗联合化疗一线治疗晚期或复发性NSCLC的成本-效用进行研究,为临床用药方案的选择和医疗卫生决策提供依据。
1 资料与方法
1.1 目标人群及临床数据
本研究基于一项针对信迪利单抗安全性和有效性的Ⅲ期临床试验(ORIENT-11研究)展开。目标人群的纳入标准为:(1)不能手术治疗且不能接受根治性同步放化疗的局部晚期(ⅢB/ⅢC期)、转移性或复发性(Ⅳ期)非鳞状NSCLC患者;(2)之前未经过系统治疗;(3)根据实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1版,至少有1个可测量病灶。ORIENT-11研究的目标患者符合本研究纳入标准,故以其作为本研究目标人群。参与该研究的患者中位年龄为61岁;76.3%为男性;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)功能状态(performance status,PS)评分为0或1分的患者比例分别为27.7%和72.3%;90.9%患者的肿瘤分期为Ⅳ期;肿瘤细胞阳性比例分数(tumor proportion score,TPS)<1%的患者占32.5%;14.6%的患者存在脑转移;73.8%的患者同时接受卡铂治疗,26.2%的患者同时接受顺铂治疗[8]。
在ORIENT-11研究中,患者按照2∶1的比例被随机分为2组,其中对照组患者接受培美曲塞500 mg/m2和顺铂75 mg/m2或卡铂[按药-时曲线下面积(area under the curve,AUC)5 mg/(mL·min)计算剂量]治疗,每3周静脉输注1次;试验组患者在对照组基础上,联用信迪利单抗200 mg治疗,每3周静脉输注1次。3周为1个周期,2组患者均治疗4个周期,之后分别接受培美曲塞单药或信迪利单抗联合培美曲塞维持治疗,直至出现不可接受的毒性反应或发生疾病进展(progressive disease,PD),且信迪利单抗最多使用24个月。其主要终点是由盲态独立影像评审委员会根据RECIST v1.1标准评估的PFS时间;次要终点包括总生存(overall survival,OS)时间、疾病控制率、反应时间、响应持续时间和安全性。在入组的357例患者中,试验组患者的中位PFS为8.9个月,化疗组仅为5.0个月,试验组治疗方案显著降低了患者的死亡风险[风险比(hazard ratio,HR)=0.482,95%置信区间(confidence interval,CI)为0.362~0.643,P<0.000 01];试验组患者的ORR为51.9%(95%CI为45.7%~58.0%),对照组为29.8%(95%CI为22.1%~38.4%);安全性方面,试验组患者3级及以上不良反应的发生率为61.7%,稍高于对照组的58.8%,但前者的不良反应是与培美曲塞和铂类药物使用相关的不良反应,在预期之中并且可控[10]。
1.2 模型构建
本研究基于ORIENT-11研究中报告的Kaplan-Mayer生存曲线,利用Microsoft Excel 2019软件构建分区生存模型(partitioned survival model,PSM),具体包括PFS、PD和死亡(Death)3种健康状态,如图1所示。PSM与马尔可夫模型的根本区别在于前者严重依赖于能够建立生存曲线的个体患者数据的可及性,且不需要考虑转移概率,虽计算简便,但在缺乏数据的情况下无法建立。本研究假设所有患者在进入模型时均处于PFS状态,后逐步向PD或死亡状态转移且过程不可逆转。以ORIENT-11研究中的用药周期(21 d)作为循环周期,模拟至99%的患者死亡;以质量调整生命年(quality adjusted life year,QALY)作为产出指标;成本和效用均采用5%的贴现率[11]。
图1 PSM结构
1.3 生存分析
由ORIENT-11研究可以获得随访期内OS和PFS曲线上的患者人数比例,而PD状态的人数比例等于OS曲线上的人数比例减去PFS曲线上的人数比例。超出随访期后,则使用参数法重构曲线、拟合外推。首先利用GetData Graph Digitizer软件对ORIENT-11研究原始PFS和OS曲线的生存率进行挖掘并进行数据清理,利用Stata16.0软件重构Kaplan-Mayer生存曲线并进行外推;随后进行视觉检查以初步判断重构曲线的稳健性,再根据赤池信息准则(Akaike information criterion,AIC)和贝叶斯信息准则(Bayesian information criterion,BIC)检验拟合优度,选取出最优的拟合曲线后计算生存函数。本研究最终选择Log-logistic和Log-normal分布对各组曲线进行拟合,结果如表1所示。
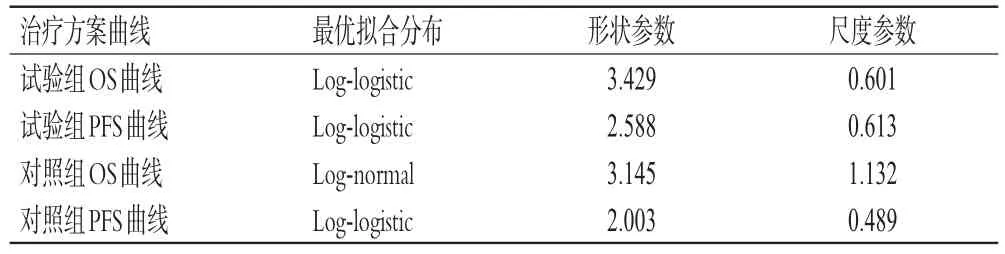
表1 OS和PFS曲线的拟合结果及其参数
1.4 模型参数
ORIENT-11研究没有提及二线治疗方案,故根据相关文献和《中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南2020》的推荐——对NSCLC的二线治疗使用纳武利尤单抗或者多西他赛[12-13],本研究假设试验组和对照组在PD后均接受多西他赛单药治疗。由多西他赛药品说明书可知,患者在接受多西他赛静脉滴注前1天必须口服糖皮质激素类药物(如地塞米松),每天16 mg,至少持续3 d。另外,根据ORIENT-11研究,如果信迪利单抗使用至24个月后患者仍处于PFS状态,则采用培美曲塞维持治疗[8]。
本研究从卫生体系角度出发,仅纳入直接医疗成本,包括药品成本、药品管理成本、疾病管理成本和不良反应处理成本。其中,药品成本数据为药智网(https://www.yaozh.com/)2022年各省市中标价格的中位数;药品管理成本包括输液费、诊断费、护理费等,疾病管理成本包括实验室检查成本和影像学检查成本,二者均取江苏省内三级医院相关医疗服务价格的中位数。本研究仅纳入3级及以上且发生率大于5%的不良反应,主要包括白细胞计数减少、贫血、中性粒细胞计数减少和血小板减少症,并且假设该不良反应只发生1次;不良反应及其处理成本通过咨询医院专家获得;不良反应发生率来源于ORIENT-11研究。疾病PFS和PD状态的效用值来源于文献[14]。模型基线参数及其分布如表2所示(表中假设患者体表面积为1.72 m2[15])。
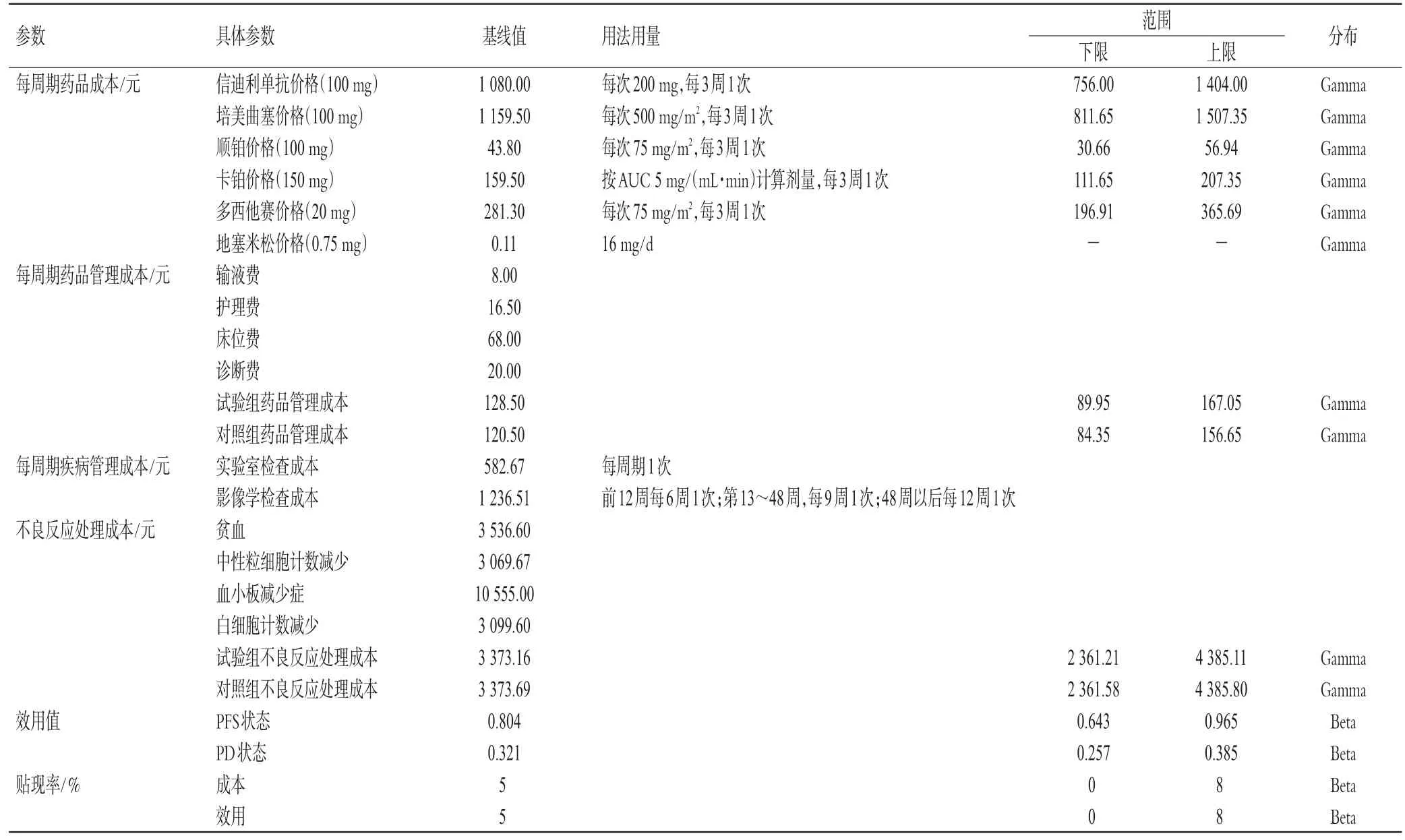
表2 模型基线参数及其分布
1.5 敏感性分析
本研究对各个参数的不确定性利用单因素敏感性分析进行评估——假设成本数据上下浮动30%、效用值上下浮动20%,贴现率的范围仍为0~8%。此外,考虑到模型中所有参数的不确定性对结果的综合影响,本研究运用概率敏感性分析,在每个不确定性参数的指定分布下,利用Monte-Carlo模拟重复抽样1 000次,结果以成本-效果散点图和成本-效果可接受曲线呈现。
1.6 情境分析
由于效用值往往是导致增量成本-效果比(incremental cost-effectiveness ratio,ICER)发生变化的主要原因之一,因此本研究拟对其他文献中不同的效用值(PFS和PD状态的效用值分别为0.82和0.58)[16-17]以及信迪利单抗使用至最长周期(24个月)进行情境分析。
2 结果
2.1 基础分析结果
基础分析结果显示,试验组患者在获得更多效用(0.482 QALY)的同时也需要花费近2倍于对照组的成本(表3),试验组相对于对照组的ICER为334 974.41元/QALY。根据《中国统计年鉴2020》人均国内生产总值(gross domestic product,GDP)数据(约72 000元)[18],在以3倍我国2020年人均GDP(216 000元)作为意愿支付(willingness-to-pay,WTP)阈值的前提下,加用信迪利单抗的试验组方案相对于单纯化疗的对照组方案不具有经济性。

表3 基础分析结果
2.2 敏感性分析结果
2.2.1 单因素敏感性分析结果 单因素敏感性分析的旋风图如图2所示。由图2可知,在各参数浮动范围内,对模型最终结果影响较大的参数依次为PFS状态效用值、培美曲塞价格、效用贴现率、成本贴现率和信迪利单抗价格等。其中,信迪利单抗价格对模型结果的影响相对于前4个参数并不明显,可见,在信迪利单抗进入医保及通过2次医保谈判被大幅度降价后,其价格已经不能显著影响整体治疗方案的经济性,其可及性将得到有效提高。此外,疾病管理成本、2组不良反应处理成本和药品管理成本等对结果的影响较小。
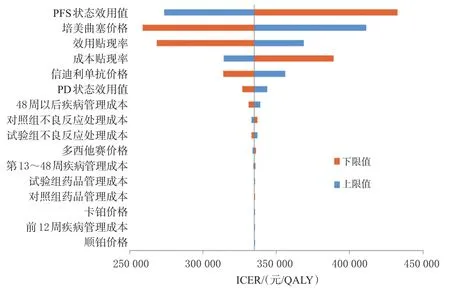
图2 单因素敏感性分析的旋风图
2.2.2 概率敏感性分析结果 成本-效果散点图和成本-效果可接受曲线分别如图3、图4所示。由图3可知,92.1%的散点位于WTP阈值线上方,表明当WTP阈值为3倍2020年我国人均GDP(216 000元)时,试验组方案具有经济性的概率仅为7.9%。由图4可知,当WTP阈值为100 000元/QALY时,试验组方案具有经济性的概率为0;当WTP阈值为334 974.41元/QALY时,试验组方案具有经济性的概率为50%;当WTP阈值大于334 974.41元/QALY时,试验组方案具有经济性的概率逐渐增大直至100%;当WTP阈值为3倍2020年我国人均GDP(216 000元)时,试验组方案具有经济性的概率为6.5%。这一分析结果证明了本研究模型的稳健性。
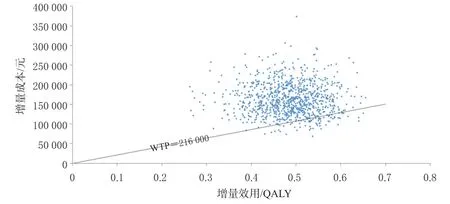
图3 成本-效果散点图
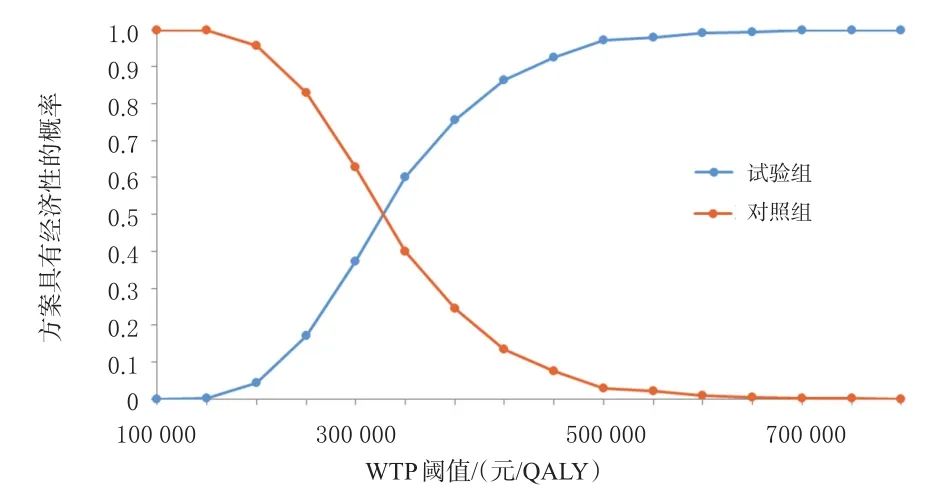
图4 成本-效果可接受曲线
2.3 情境分析结果
当使用文献[16-17]中的效用值数据进行分析时,试验组相对于对照组的ICER为364 788.81元/QALY,相较于基础ICER结果有所上升,但在以3倍2020年我国人均GDP(216 000元)作为WTP阈值的前提下仍不具有经济性,研究结果并未发生翻转;并且,单因素敏感性分析结果中PFS和PD状态的效用值对结局指标依然具有较大的影响。在模拟只治疗24个月的情境中,可得ICER为447 112.07元/QALY,与WTP阈值相比,试验组方案仍不具有经济性,说明基础分析结果稳健。
3 讨论
PD-1/PD-L1抑制剂现已成为继放化疗、手术之后治疗肿瘤的又一主要手段,在癌症领域的特异性免疫治疗中展示出预期可控制的安全性和有效性[19]。信迪利单抗是一种重组全人源抗PD-1单克隆抗体,通过抑制PD-1受体与其配体的相互作用,解除免疫抑制效应,重新激活并提高细胞毒性T淋巴细胞对特异肿瘤细胞的杀伤能力[20]。该药已于2021年2月新增了联合培美曲塞和铂类化疗药物治疗未经系统治疗的表皮生长因子受体基因突变阴性和间变性淋巴瘤激酶阴性的晚期或复发性非鳞状细胞NSCLC的适应证[9]。在过去的几年中,已有报道证明亚洲与世界其他地区患者在NSCLC免疫治疗安全性和可控性方面显示出不同的特点[20-21]。然而,包括中国在内的亚洲地区患者的临床治疗数据十分有限:在信迪利单抗相关的多项Ⅲ期临床试验中,来自亚洲的患者比例仅占3%~14%[22-23]。ORIENT-11(NCT03607539)研究是一项评估信迪利单抗联合培美曲塞和铂类化疗药物一线治疗晚期或复发性非鳞状细胞NSCLC有效性和安全性的随机、双盲、Ⅲ期临床试验,其入组患者超90%来自中国,故本研究基于该试验进行药物经济学评价,可更好地为我国NSCLC患者的临床用药提供参考[8]。
本研究从我国卫生体系角度出发,构建了包含PFS、PD和死亡三状态的PSM,采用成本-效用分析评价了信迪利单抗联合化疗一线治疗晚期或复发性NSCLC的经济性。结果显示,使用信迪利单抗联合化疗方案的患者在获得更多效用的同时,几乎要花费相当于单纯化疗2倍的成本,且ICER值大于WTP阈值,说明并不具有经济性。但是,如果以北京、上海和江苏三地的3倍2020年人均GDP(分别为494 667、467 304、363 693元)[18]作为WTP阈值,信迪利单抗联合化疗方案则具有经济性。可见,对于价格高昂的抗癌药物,其定价策略是否应该结合国内发达地区或相对落后地区的经济情况加以区分值得进一步探讨。
本研究仍存在一定的局限性:(1)原始试验中的OS曲线并未成熟,其对外推曲线选择的影响和不确定性暂不明确,有待进一步改进;(2)受相关临床试验和NSCLC经济学文献研究的限制,某些模型参数来自于真实世界专家咨询结果,或许会造成一定的偏差;(3)本研究假设PD后试验组和对照组患者均使用多西他赛治疗,但现实中的患者并不会完全选用同一种药物进行后续治疗,这可能使本研究结果存在一定的偏倚;(4)本研究只纳入了部分不良反应且并未把不良反应所造成的效用值下降纳入考虑范围,由此得出的结果会与实际存在差异。因此,后续还需进一步对研究数据进行完善,以更好地为临床用药和医疗卫生决策提供参考。

