青贮用乳酸菌的分离鉴定及生物学特性评价
韦庆旭 张建鹏 梁煜晨 唐连群 王 平*
(1.西北农林科技大学动物科技学院,杨凌 712100;2.新疆农业大学动物科技学院,乌鲁木齐 830002)
青贮体系中乳酸菌的种类和数量是影响青贮质量的直接因素[1]。青贮的发酵质量高度依赖附生微生物区系,对于用不同作物调制的青贮饲料,甚至是在不同环境条件下种植的同一作物,附生微生物区系可能有很大差异[2]。构树营养丰富,是优质的饲料资源,但构树开发利用不当,不仅会造成饲料资源的浪费损失,还会影响动物的生产性能。构树中较高的水分和蛋白质含量及较低的水溶性碳水化合物含量使其青贮具有挑战性。研究表明,未经生物发酵处理的构树被畜禽食用后消化吸收利用率不高[3],常通过添加乳酸菌来改善构树青贮品质。乳酸菌是指能利用可溶性碳水化合物发酵产生乳酸的细菌,是青贮饲料中常添加的饲用菌种[4]。乳酸菌通过调节青贮饲料内微生物区系,使乳酸菌快速大量繁殖成为青贮饲料中的优势菌群,快速产生乳酸,降低青贮饲料pH,抑制好氧菌生长,从而达到提高青贮饲料品质的作用。
不同地区的乳酸菌种类相似度较低,且不同地区作物附着乳酸菌均为适合其附着的作物种类和当地自然环境的特异性菌群[5]。作物附着的微生物为该作物的内源附着微生物,其他物种附着的微生物则为该作物的外源微生物,内源附着乳酸菌对附着的作物的碳水化合物利用能力更佳,内源附着乳酸菌与微生物之间的相互作用在目标作物青贮饲料中效果更强,与接种外源乳酸菌相比,接种内源乳酸菌能更快降低目标作物pH并产生大量乳酸[2],故分离筛选构树自然发酵青贮中内源乳酸菌用于构树青贮是可行的。玉米由于其自然附着乳酸菌数量可观,自然发酵条件下能够成功保存,被广泛用于青贮,推测将玉米青贮中存在的乳酸菌接种至构树青贮能够激发出与玉米青贮相似的性能。有研究表明,从宿主动物消化道中分离的乳酸菌可能更利于动物生产性能的提高[6],将羔羊的消化道环境作为一种自然的筛选流程,推测饲喂构树青贮的健康羔羊粪便中可能存在能够在羔羊消化道环境中存活或能够影响动物生产性能的乳酸菌。
目前,在对青贮饲料中乳酸菌筛选及乳酸菌对青贮饲料发酵品质等应用研究方面,我国主要采用国外商品化乳酸菌制剂进行研究,对具有自主性知识产权的乳酸菌制剂研究较少[7]。因此,筛选出优良青贮用乳酸菌对研制具有自主知识产权的乳酸菌制剂具有重要意义。本研究拟从构树青贮、玉米青贮和饲喂构树青贮的健康奶山羊羔羊直肠粪便筛选出生长速率、产酸能力、耐酸能力、抑菌能力等方面综合表现良好的可饲用菌株,为后续开发构树青贮饲料提供试验材料。
1 材料与方法
1.1 试验材料
构树青贮样品来自陕西康构草业科技有限公司。于株高120~150 cm时收获全株构树,边收割边切短至2 cm左右,留茬高度15 cm左右。每千克构树中添加2.5×1011CFU植物乳杆菌(台湾亚芯生物科技有限公司)和2.5×107CFU布氏乳杆菌(陕西泰克生物科技有限公司),使用4层以上拉伸膜裹包密封,发酵30 d以上。构树青贮含水量78%左右,感官评价良好,而且饲喂动物未发现不良反应。
玉米青贮样品来自西北农林科技大学萨能奶山羊种羊场青贮塔。于蜡熟期收获全株玉米,切短至2 cm左右,留茬高度15 cm左右。全株玉米青贮制作中未添加任何添加剂,贮藏于砖混凝土结构的青贮塔中,采样时已发酵6个月,含水量72%左右,感官评价良好,而且饲喂动物未发现不良反应。
构树青贮和玉米青贮各采集500 g,密封保存后立即置冰盒中带回实验室进行后续操作。
1.1.2 粪便样品的采集
粪便样品来自西北农林科技大学萨能奶山羊种羊场饲喂构树青贮的4只8月龄健康奶山羊羔羊。羔羊分栏饲养,每栏2只,饲喂含19.8%构树青贮的全混合日粮(TMR)。饲粮组成及营养水平见表1。饲粮中粗蛋白质含量采用GB/T 6432—2018的方法测定,中性洗涤纤维含量采用GB/T 20806—2006的方法测定,酸性洗涤纤维含量采用NY/T 1459—2007的方法测定,钙含量采用GB/T 6436—2018的方法测定,磷含量采用GB/T 6437—2018的方法测定。每天分别于07:30和15:30各饲喂1次,自由采食和饮水。每日清扫羊舍,保证羊舍的清洁卫生。

表1 饲粮组成及营养水平(干物质基础)
于10:00徒手采集羔羊粪便。为保证粪便不受污染,采集人员戴灭菌手套通过肛门部位采集直肠粪便,丢弃靠近肛门的样品。每只羊采集4粒粪球,将4只羊的粪便样品混合装于10 mL灭菌离心管,放入装有温水(37 ℃)的保温杯,立即带回实验室进行后续操作。
会计主体假设作为会计学中主要假设因素,同时也是政府会计制度及有待处理的关键问题,要想促进政府预算会计和财务会计的融合,就要从会计主体入手,促进二者协调。结合新政府会计制度得知,政府会计主体一般以各级政府部门、各级单位为主,充分展现出了政府会计主体和本级政府财政部门之间的关系。在把组织当作会计主体时,需要综合思考各个应用预算资金单位及公共部门设定特点,促进政府预算会计和财务会计融合。此外,在进行会计主体选择时,也可以把“基金”当作会计主体,也可以将“政府整体”作为会计主体。根据新政府会计制度要求,合理选择。
1.1.3 培养基
MRS液体培养基(1 L)(北京索莱宝科技有限公司,pH为6.2±0.2):葡萄糖20 g,蛋白胨10 g,牛肉浸粉5 g,吐温80 1 mL,酵母浸粉4 g,柠檬酸三胺2 g,磷酸氢二钾2 g,乙酸钠5 g,硫酸镁0.2 g,硫酸锰0.05 g。
MRS琼脂培养基(1 L)(北京索莱宝科技有限公司,pH为6.2±0.2):葡萄糖20 g,蛋白胨10 g,牛肉浸粉5 g,吐温80 1 mL,酵母浸粉4 g,柠檬酸三胺2 g,磷酸氢二钾2 g,乙酸钠5 g,硫酸镁0.2 g,硫酸锰0.05 g,琼脂粉15 g。
LB液体培养基[9](400 mL):胰蛋白胨4 g,酵母提取物2 g,氯化钠4 g。
LB平板琼脂培养基[10](400 mL):胰蛋白胨4 g,酵母提取物2 g,氯化钠4 g,琼脂6 g。
1.2 试验方法
1.2.1 乳酸菌的分离与纯化
在超净工作台中,使用无菌操作方法将10 g粪便加入90 mL灭菌的磷酸盐缓冲液(PBS)后振荡混匀,用4层灭菌纱布过滤;将25 g玉米青贮及25 g构树青贮剪碎后分别加入225 mL灭菌的PBS后震荡混匀,用4层灭菌纱布过滤,各取100 μL于加有1%碳酸钙的MRS固体培养基上均匀涂布,37 ℃厌氧培养48 h。
根据菌落的颜色、大小、状态的不同,挑取有溶钙圈的典型菌落,采用平板划线法在MRS平板上做单菌落划线分离,37 ℃厌氧培养48 h,纯化4~6次。对各菌株进行编号标记。并挑取单菌落接种至1 mL MRS液体培养基37 ℃厌氧培养24 h,于20%甘油中-80 ℃保存。
1.2.2 菌株种属鉴定
分别将分离到的所有纯化菌液以1%接种量接种于10 mL MRS液体培养基充分活化后,离心收集菌体,根据细菌DNA提取试剂盒(粪便细菌基因组DNA试剂盒,天根生化科技有限公司)方法提取菌体DNA并进行测序,测序引物采用16S rRNA通用引物序列:27F(5′-GAGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-AAGGAGGTGATCCAGCCGCA-3′)。将测序结果与NCBI核酸数据库进行同源性对比。
1.2.3 乳酸菌耐酸性能测定
参照韦票[10]的方法进行乳酸菌耐酸性能测定。将供试菌株接种于MRS液体培养基中,37 ℃培养24 h,用6 mol/L的盐酸分别调节MRS液体培养基pH至3.0、3.5、4.0后灭菌。将活化的乳酸菌以1%的接种量分别接种至未调pH培养基及调pH培养基至3.0、3.5、4.0的MRS液体培养基中,37 ℃静置培养24 h,测定600 nm波长下吸光度(OD600)值,以未调pH培养基为对照,计算比值。
1.2.4 乳酸菌生长曲线、产酸速率曲线测定
参照韦票[10]的方法进行乳酸菌生长曲线测定,将活化的乳酸菌以1%的接种量接种至MRS液体培养基中,37 ℃静置培养,在第0、2、4、6、8、10、12、14、16、20、24、28、32、36、48 h测定菌液OD600值,以菌液培养时间为横坐标,OD600值为纵坐标,绘制生长曲线。
参照何江波等[11]的方法进行乳酸菌产酸速率曲线测定,将活化的乳酸菌以1%的接种量接种至MRS液体培养基中,37 ℃静置培养,在第0、2、4、6、8、12、16、24、36、48 h测定菌液pH,以菌液培养时间为横坐标,pH为纵坐标,绘制产酸速率曲线。
1.2.5 乳酸菌菌株上清液抑菌特性测定
参照何江波等[11]抑菌性试验方法,以沙门氏菌、金黄色葡萄球菌和大肠杆菌为指示菌,采用牛津杯法进行抑菌试验。将候选菌株于MRS培养基培养活化2代,将活化好的菌液以8 000×g离心2 min,上清液经滤膜过滤吸取150 μL加入牛津杯中,37 ℃培养24 h后检测其是否对指示菌产生抑制作用,抑菌能力根据抑菌圈大小判定,判定方法参考高擎燏等[12]。
1.2.6 菌株之间的拮抗性
参照韦票[10]方法,在菌液中加入无菌圆滤片(直径6 mm),浸泡10 min;以其中一株菌作为指示菌,指示菌种子液稀释10倍,吸取100 μL涂布于MRS固体培养基,静置10 min,将浸泡在菌液中的滤纸片依次加入,编号,37 ℃培养48 h后观察待测菌与指示菌间拮抗性,待测菌周围有透明圈表明该菌株与指示菌菌株之间有拮抗作用;无透明圈表明该菌株与指示菌菌株之间无拮抗作用,不会互相抑制生长。
1.3 统计分析
采用Excel 2019和SPSS 19.0统计分析软件对数据进行描述统计和正态检验,并进行方差分析,平均值间差异显著性用LSD法进行多重比较分析。采用GraphPad Prism 8软件作图。
2 结果与分析
2.1 乳酸菌菌株分离纯化
共分离得到74株菌株,所有菌株革兰氏染色为阳性,过氧化氢酶触反应为阴性。部分菌株在MRS琼脂培养基的菌落形态见图1,乳酸菌菌落形态呈圆形凸起,表面光滑,边缘整齐,菌落颜色为乳白色。
2.2 乳酸菌菌株鉴定
将纯化好的菌液16S rRNA测序结果与NCBI核酸数据库进行同源性对比后发现74株乳酸菌,其中包括31株植物乳杆菌、4株副干酪乳杆菌、1株戊糖乳杆菌、1株布氏乳杆菌、1株香肠乳杆菌、4株海氏肠球菌、1株非解乳链球菌、11株牛链球菌、5株巴黎链球菌、3株婴儿链球菌、2株马肠链球菌、1株粪肠球菌、1株肠膜明串珠菌和8株嗉囊乳杆菌。根据《饲料添加剂品种目录(2013)》中可饲用微生物目录,其中37株为可饲用乳酸菌。37株可饲用乳酸菌中构树来源的有34株,包括29株植物乳杆菌、4株副干酪乳杆菌和1株布氏乳杆菌;饲喂构树青贮的羔羊粪便来源的有1株植物乳杆菌;玉米青贮来源的有1株植物乳杆菌和1株粪肠球菌。37株可饲用乳酸菌鉴定结果见表2,这些菌株的覆盖率均为99%,同源性均在99.45%以上。这些乳酸菌分别属于植物乳杆菌、布氏乳杆菌、副干酪乳杆菌、粪肠球菌,其中植物乳酸菌占83.73%,布氏乳杆菌占2.70%,副干酪乳杆菌占10.81%,粪肠球菌占2.70%(图2)。
A:副干酪乳杆菌 Lactobacillus paracasei;B:布氏乳杆菌 Lactobacillus brucelli;C:植物乳杆菌 Lactobacillus plantarum;D:粪肠球菌 Enterococcus faecalis。
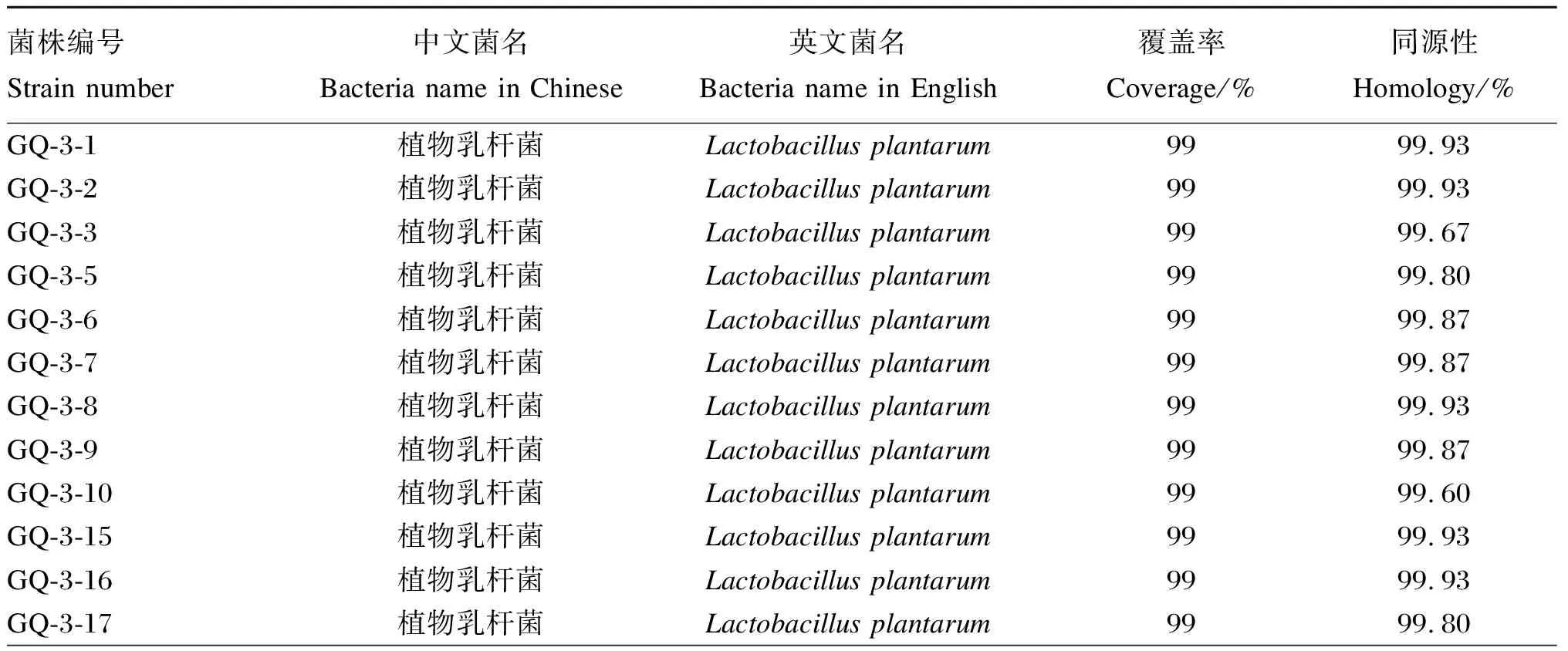
表2 37株可饲用乳酸菌鉴定结果
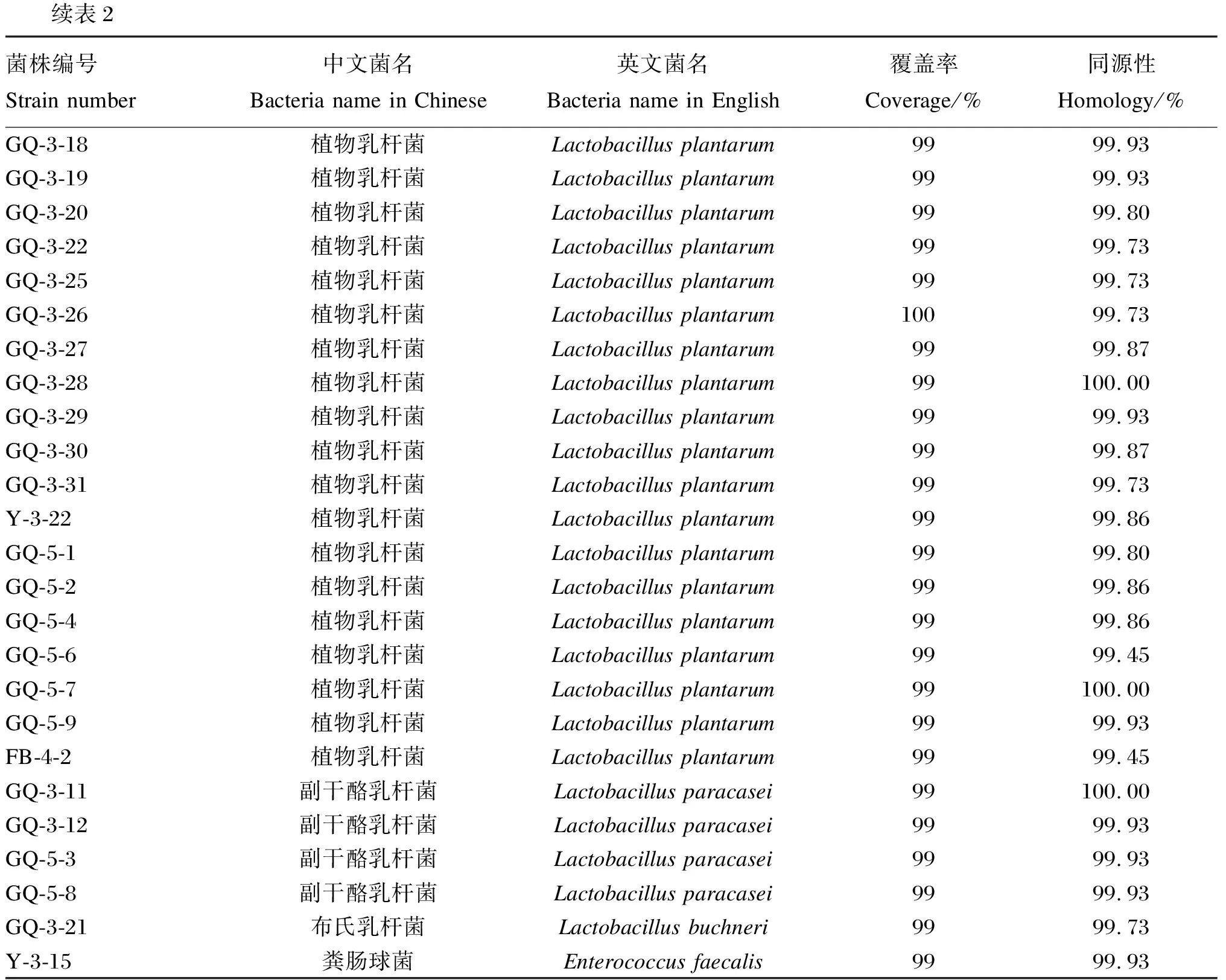
续表2菌株编号Strain number中文菌名Bacteria name in Chinese英文菌名Bacteria name in English覆盖率Coverage/%同源性Homology/%GQ-3-18植物乳杆菌Lactobacillus plantarum9999.93GQ-3-19植物乳杆菌Lactobacillus plantarum9999.93GQ-3-20植物乳杆菌Lactobacillus plantarum9999.80GQ-3-22植物乳杆菌Lactobacillus plantarum9999.73GQ-3-25植物乳杆菌Lactobacillus plantarum9999.73GQ-3-26植物乳杆菌Lactobacillus plantarum10099.73GQ-3-27植物乳杆菌Lactobacillus plantarum9999.87GQ-3-28植物乳杆菌Lactobacillus plantarum99100.00GQ-3-29植物乳杆菌Lactobacillus plantarum9999.93GQ-3-30植物乳杆菌Lactobacillus plantarum9999.87GQ-3-31植物乳杆菌Lactobacillus plantarum9999.73Y-3-22植物乳杆菌Lactobacillus plantarum9999.86GQ-5-1植物乳杆菌Lactobacillus plantarum9999.80GQ-5-2植物乳杆菌Lactobacillus plantarum9999.86GQ-5-4植物乳杆菌Lactobacillus plantarum9999.86GQ-5-6植物乳杆菌Lactobacillus plantarum9999.45GQ-5-7植物乳杆菌Lactobacillus plantarum99100.00GQ-5-9植物乳杆菌Lactobacillus plantarum9999.93FB-4-2植物乳杆菌Lactobacillus plantarum9999.45GQ-3-11副干酪乳杆菌Lactobacillus paracasei99100.00GQ-3-12副干酪乳杆菌Lactobacillus paracasei9999.93GQ-5-3副干酪乳杆菌Lactobacillus paracasei9999.93GQ-5-8副干酪乳杆菌Lactobacillus paracasei9999.93GQ-3-21布氏乳杆菌Lactobacillus buchneri9999.73Y-3-15粪肠球菌Enterococcus faecalis9999.93

Lactobacillus plantarum:植物乳杆菌;Lactobacillus brucelli:布氏乳杆菌;Lactobacillus paracasei:副干酪乳杆菌;Enterococcus faecalis:粪肠球菌。
2.3 乳酸菌生长性能评价
乳酸菌生长曲线如图3所示,其中生长速度快的菌株为GQ-3-2、GQ-3-6、GQ-3-8、GQ-3-9、GQ-3-12、GQ-3-18、GQ-3-19、GQ-3-26、GQ-3-29、GQ-3-31、GQ-5-1、GQ-5-2、GQ-5-6、Y-3-15、Y-3-22,它们在发酵2 h进入对数生长期。其中增殖能力较强的菌株为GQ-3-2、GQ-3-8、GQ-3-12、Y-3-22、GQ-3-26、GQ-3-19、GQ-5-6,生长稳定期的OD600值大于2.0。最快进入生长稳定期的菌株为Y-3-15,在10 h进入生长稳定期,其OD600值小于1.5。生长速度较慢但增殖能力强的菌株为GQ-3-21、GQ-5-8、GQ-3-28和GQ-3-20,分别于6、14和16 h进入对数生长期,其中GQ-3-21在16 h进入生长稳定期,GQ-5-8和GQ-3-20在28 h进入生长稳定期,这3株菌生长稳定期的OD600值都大于2.0。生长速度最慢但增殖能力较强的菌株为GQ-5-4、FB-4-2、GQ-5-9,在0~8 h为生长迟滞期,在26 h进入生长稳定期,生长稳定期的OD600值都大于2.0。生长速度慢且增殖能力较弱的菌株为GQ-3-1、GQ-3-5、GQ-3-10、GQ-3-16、GQ-3-17,生长稳定期的OD600值小于2.0。
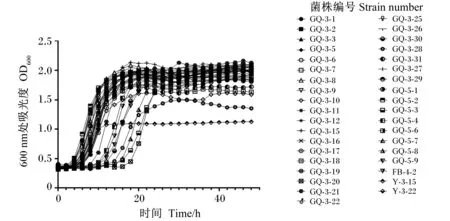
图3 乳酸菌生长曲线
2.4 乳酸菌产酸速率曲线
乳酸菌产酸速率曲线如图4所示,其中产酸速度快的菌株为GQ-3-1、GQ-3-2、GQ-3-3、GQ-3-5、GQ-3-6、GQ-3-7、GQ-3-8、GQ-3-9、GQ-3-10、GQ-3-12、GQ-3-15、GQ-3-16、GQ-3-17、GQ-3-18、GQ-3-19、GQ-3-21、GQ-3-22、GQ-3-25、GQ-3-26、GQ-3-27、GQ-3-29、GQ-3-30、GQ-3-31、GQ-5-1、GQ-5-2、GQ-5-4、GQ-5-6、GQ-5-7、Y-3-22,这些菌株在发酵0~16 h的pH均能快速下降,其中产酸最快的菌株为GQ-3-2,在发酵0~2 h时菌液pH下降速度最快,已经降至5.0以下。产酸速度慢的菌株为GQ-3-11、GQ-3-28、GQ-5-9、FB-4-2、GQ-3-20、GQ-5-8、GQ-5-3、Y-3-15、GQ-3-28。另外大部分菌株在发酵12 h时菌液pH相对较低(<3.5),而菌株GQ-3-30、GQ-3-22、GQ-5-1、FB-4-2、GQ-3-20、GQ-5-8、GQ-5-3、Y-3-15、GQ-3-28在发酵12 h时菌液pH相对较高(>3.5)。菌株Y-3-15在发酵48 h菌液pH最高,为3.99,其余菌株发酵48 h的菌液pH均在3.5以下。
2.5 乳酸菌耐酸性能
乳酸菌的耐酸性能见图5,在pH 4.0的条件下,存活率最低的菌株为Y-3-15,存活率为15%,其余菌株存活率均大于50%。在pH 3.5的条件下,所有菌株存活率均大于10%,其中存活率较高的菌株为GQ-3-18、GQ-3-19、GQ-3-29、GQ-5-6、GQ-5-7、Y-3-22,这些菌株存活率均大于30%。在pH 3.0的条件下,存活率最高的菌株为Y-3-15,存活率为14%,其余所有菌株存活率均低于10%。
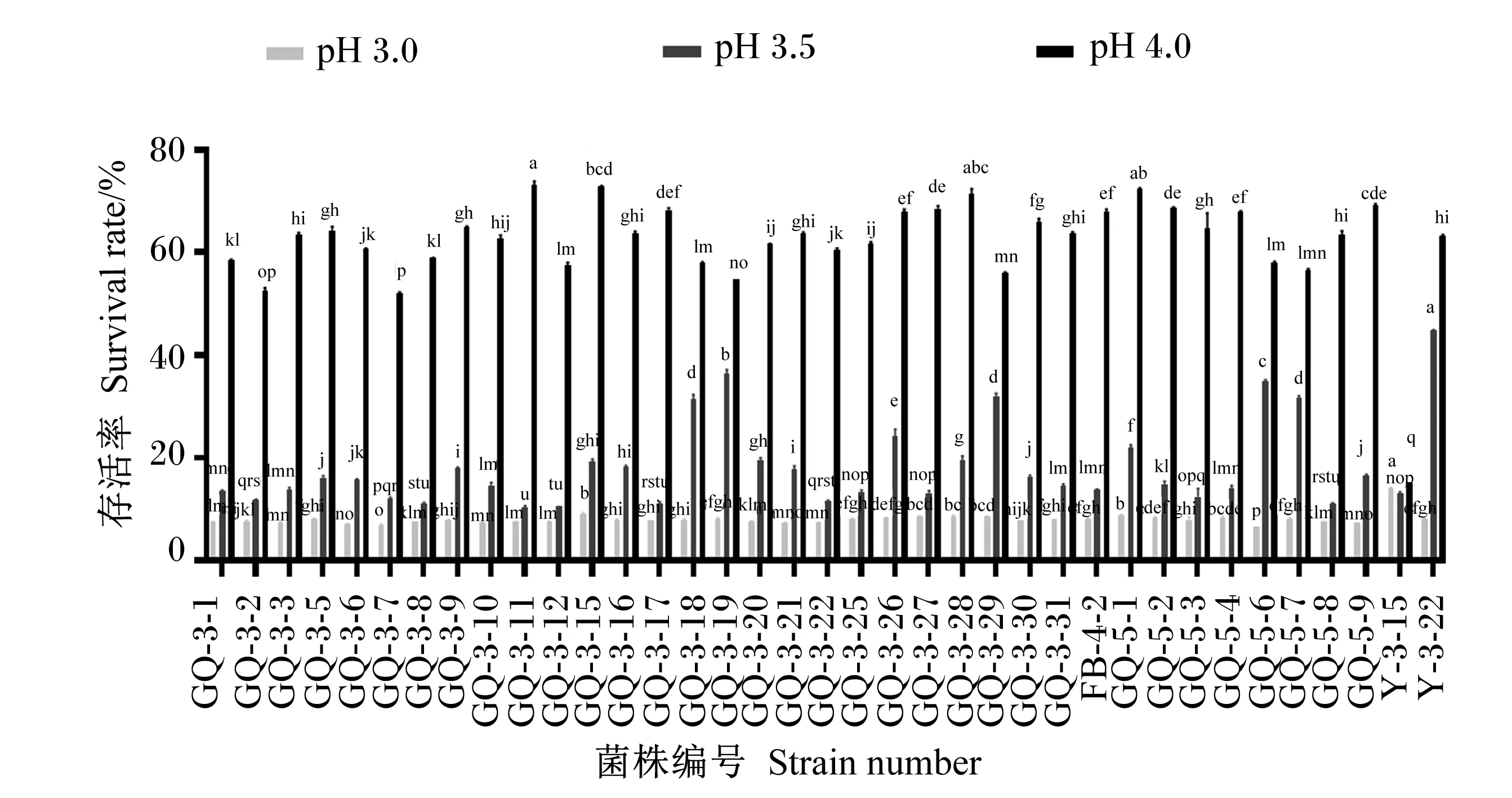
数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。
2.6 乳酸菌抑菌性能
乳酸菌抑菌性能测定结果见表3和图6。能够抑制大肠杆菌的菌株有24株,其中抑制作用由强到弱的菌株依次为GQ-3-3、GQ-3-17、GQ-5-3、GQ-3-2、GQ-3-5、GQ-3-10、GQ-3-12、GQ-3-29、GQ-5-4、GQ-3-19、GQ-3-26、GQ-3-27、GQ-3-28、GQ-5-2、GQ-5-7、GQ-5-8、Y-3-15和Y-3-22。能够抑制沙门氏菌的菌株有12株,其中抑制作用由强到弱的菌株依次为GQ-5-7、GQ-3-2、GQ-3-5、GQ-3-6、GQ-3-20、GQ-3-22、GQ-3-29、GQ-5-4。能够抑制金黄色葡萄球菌的菌株有18株,其中抑制作用由强到弱的菌株依次为GQ-3-10、GQ-3-28、GQ-5-8、FB-4-2、GQ-3-2、GQ-3-20、GQ-3-27、GQ-3-29、GQ-5-3、GQ-5-4、GQ-5-9和Y-3-22。对鼠伤寒沙门氏菌、金黄色葡萄球菌及大肠杆菌均具有抑制作用的菌株为GQ-3-2、GQ-3-29、GQ-5-4。
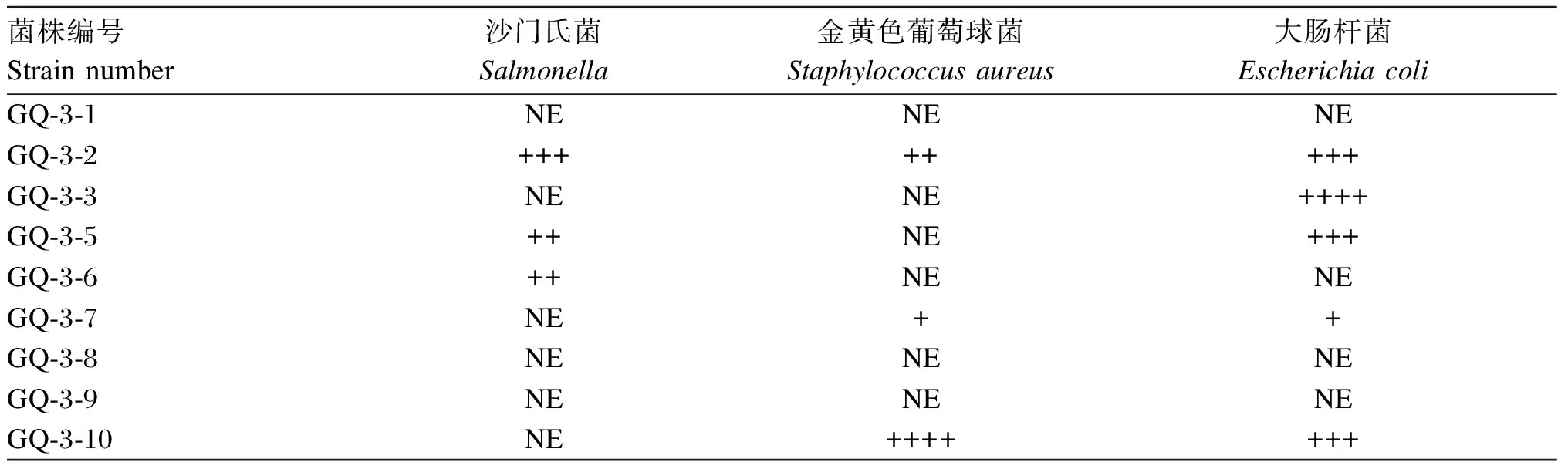
表3 37株可饲用乳酸菌对沙门氏菌、金黄色葡萄球菌和大肠杆菌的抑菌性能
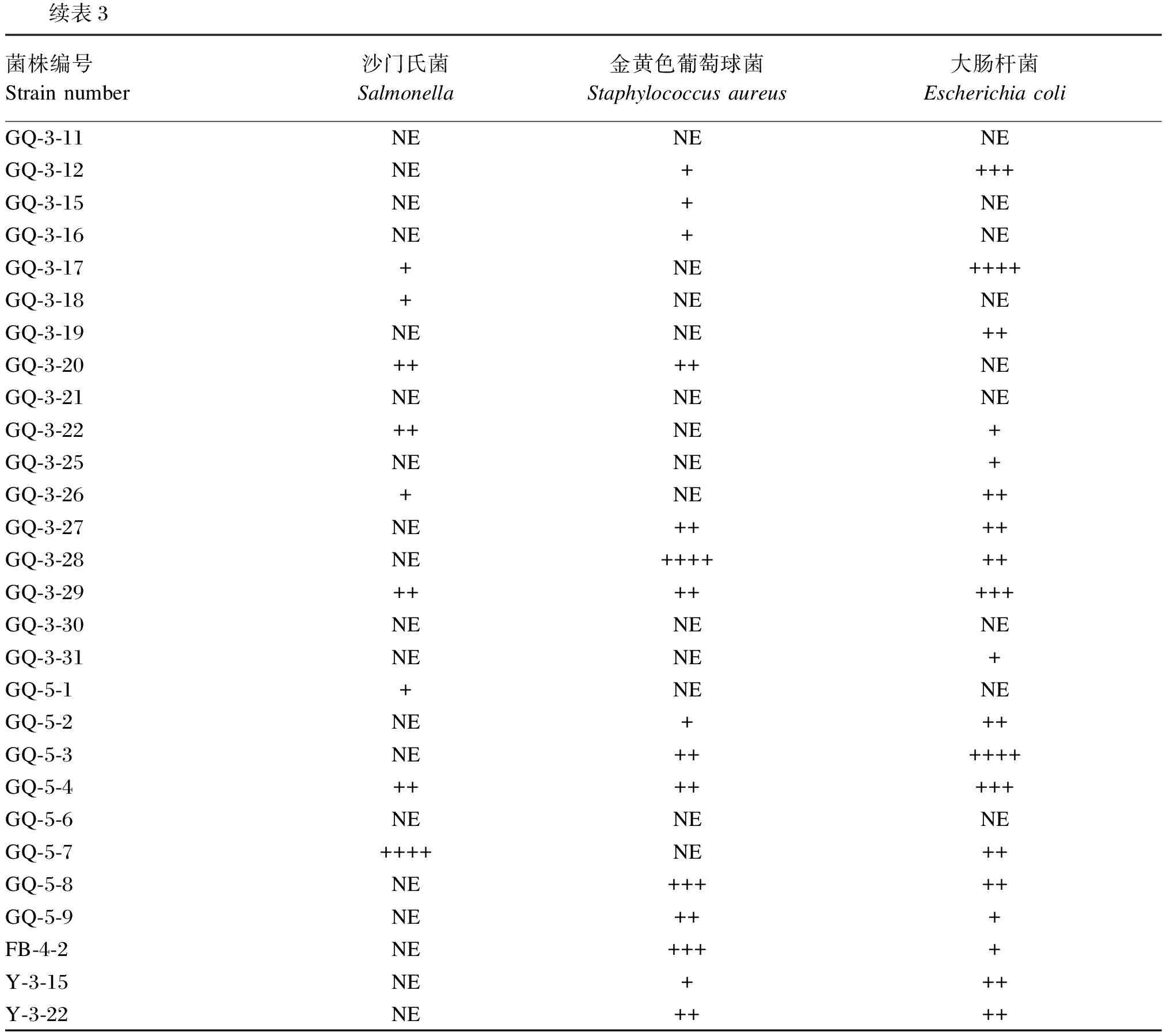
续表3菌株编号Strain number沙门氏菌Salmonella金黄色葡萄球菌Staphylococcus aureus大肠杆菌Escherichia coliGQ-3-11NENENEGQ-3-12NE++++GQ-3-15NE+NEGQ-3-16NE+NEGQ-3-17+NE++++GQ-3-18+NENEGQ-3-19NENE++GQ-3-20++++NEGQ-3-21NENENEGQ-3-22++NE+GQ-3-25NENE+GQ-3-26+NE++GQ-3-27NE++++GQ-3-28NE++++++GQ-3-29+++++++GQ-3-30NENENEGQ-3-31NENE+GQ-5-1+NENEGQ-5-2NE+++GQ-5-3NE++++++GQ-5-4+++++++GQ-5-6NENENEGQ-5-7++++NE++GQ-5-8NE+++++GQ-5-9NE+++FB-4-2NE++++Y-3-15NE+++Y-3-22NE++++
NE:无抑制作用 without inhibition;+:抑菌圈直径8~10 mm inhibition zone diameter 8 to 10 mm;++:抑菌圈直径10~12 mm inhibition zone diameter 10 to 12 mm;+++:抑菌圈直径12~14 mm inhibition zone diameter 12 to 14 mm;++++:抑菌圈直径14~16 mm inhibition zone diameter 14 to 16 mm。

A:沙门氏菌 Salmonella;B:金黄色葡萄球菌 Staphylococcus aureus;C:大肠杆菌 Escherichia coli。
2.7 乳酸菌候选菌株之间拮抗性
图7为候选菌株Y-3-15、GQ-5-4、GQ-3-29、GQ-3-21和GQ-3-2之间的拮抗性分析结果,图7-A显示菌株GQ-5-4、GQ-3-29、GQ-3-21和GQ-3-2与指示菌株Y-3-15之间无拮抗作用;图7-B显示菌株Y-3-15、GQ-3-29、GQ-3-21和GQ-3-2与指示菌株GQ-5-4之间无拮抗作用;图7-C显示菌株Y-3-15、GQ-5-4、GQ-3-21和GQ-3-2与指示菌株GQ-3-29之间无拮抗作用;图7-D显示菌株Y-3-15、GQ-5-4、GQ-3-29、GQ-3-2与指示菌株GQ-3-21之间无拮抗作用;图7-E显示菌株Y-3-15、GQ-5-4、GQ-3-29、GQ-3-21与指示菌株GQ-3-2之间无拮抗作用。5株菌株之间无拮抗作用,各菌株之间不会相互抑制生长。
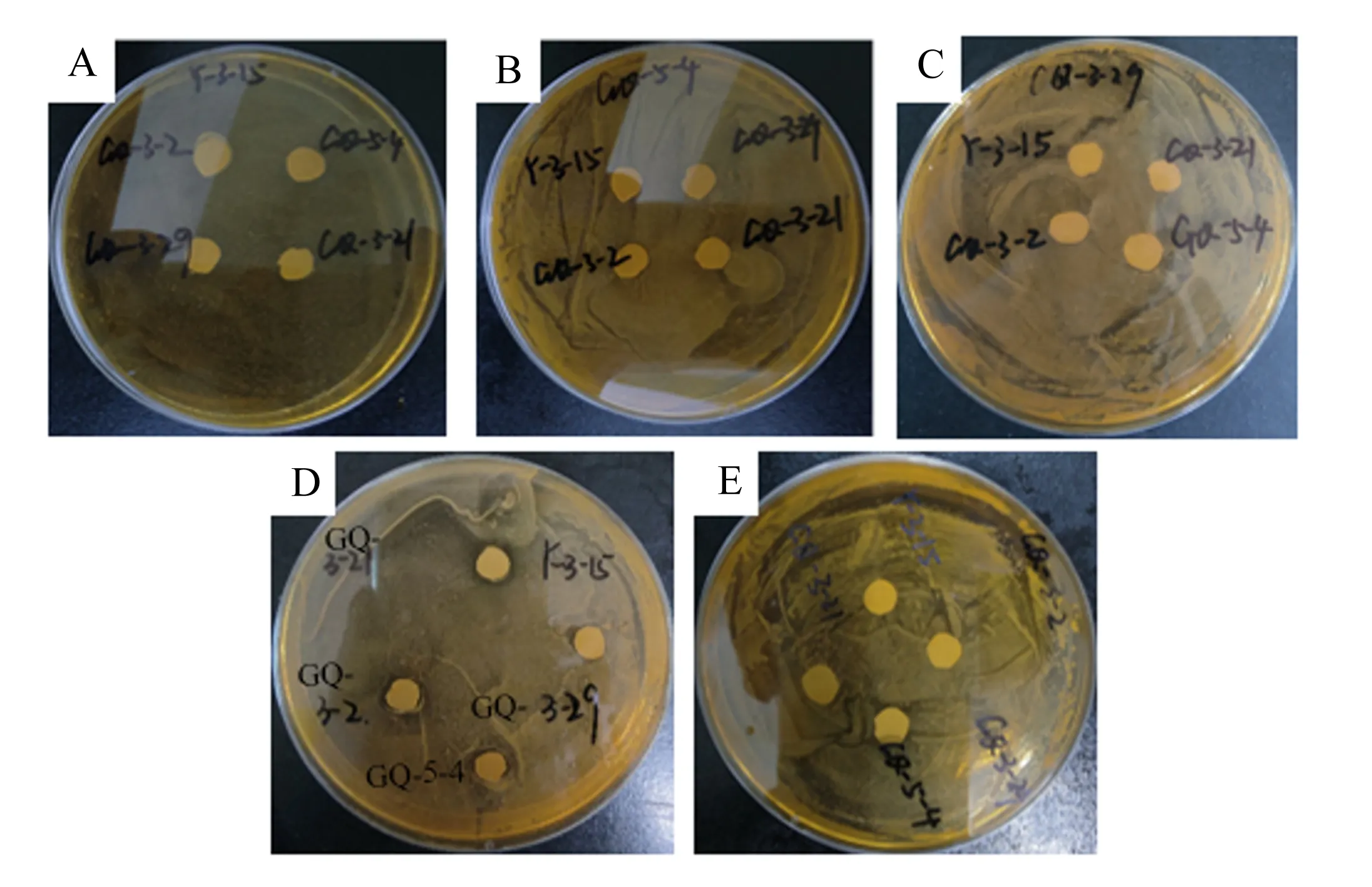
A:菌株Y-3-15 strain Y-3-15;B:菌株GQ-5-4 strain GQ-5-4;C:菌株GQ-3-29 strain GQ-3-29;D:菌株GQ-3-21 strain GQ-3-21;E:菌株GQ-3-2 strain GQ-3-2。
3 讨 论
3.1 乳酸菌菌株分离与鉴定
现有研究发现,青贮发酵可以改善构树的适口性,降低毒性,同时提高营养成分的消化率[13],但由于调制技术和菌株来源不同,造成构树青贮的品质差异较大[14]。乳酸菌为青贮发酵过程中的优势微生物,因此,特异性乳酸菌的筛选对保证构树青贮质量至关重要。本试验分别从构树青贮、玉米青贮和饲喂构树青贮的羔羊粪便中分离出植物乳杆菌、副干酪乳杆菌、布氏乳杆菌和粪肠球菌4种可饲用菌种,经鉴定均为乳杆菌属(Lactobacillus)。其中来自构树青贮的最多,为34株,而来自玉米青贮和饲喂构树青贮的羔羊粪便的相对较少,分别为2株和1株。张红梅等[15]研究也表明,乳杆菌属为青贮发酵期促进青贮发酵的主要微生物。但是,本研究中从玉米青贮中分离得到的乳酸菌较少,分析可能的原因有2个,一个是所采集玉米青贮在调制过程中未添加任何发酵剂;另一个原因是所采集的青贮饲料在青贮塔中已贮存6个月,在低pH和较低水溶性碳水化合物条件下,饲料中存活的乳酸菌较少。因此,后续研究中有必要开展饲料营养价值的评价,以确认添加乳酸菌对青贮质量的影响。
3.2 乳酸菌生长与产酸性能评价
生长和产酸性能是评价青贮用优良乳酸菌的重要指标。生长速度快有助于乳酸菌快速繁殖成为饲料中优势菌群,从而竞争性的抑制其他好氧菌活动[11]。产酸速度快能够促使乳酸生成,进而迅速降低pH,抑制有害微生物生长,降低饲料营养损失。蔡义民等[16]研究显示,乳酸球菌在发酵初期能够快速繁殖,在乳酸发酵中起先导作用。已有研究中,王蔚淼等[13]对从酸奶、酸菜、山芋及青贮来源中分离到的10株菌进行生长特性的评价结果显示,乳酸菌对数生长期为发酵12~24 h,这与本研究结果中副干酪乳杆菌GQ-5-8及植物乳杆菌GQ-3-20结果一致。靳胜男等[14]评价了2株猪源乳酸菌的生长特性,结果显示乳酸菌在发酵4 h时进入对数生长期,生长稳定期于发酵14 h开始。何江波等[11]通过评价青海黑藏羊及西藏白绒山羊瘤胃内容物来源的乳酸菌的生物学特性发现,2株戊糖片球菌在4 h进入对数生长期,16 h进入稳定期,24 h菌液pH小于4.0;1株海氏肠球菌在2 h 进入对数生长期,12 h进入稳定期,24 h后pH小于4.5;2株戊糖乳杆菌均在2 h进入对数生长期,16 h进入稳定期,16 h后pH小于4.0。这与本研究部分菌株结果一致,但本研究分离得到的乳酸菌菌株生长速度各有不同,具有生长速度及产酸能力更强的乳酸菌,生长延滞期更短,具有作为优良青贮接种菌的潜能,植物乳杆菌GQ-3-2、GQ-3-29、GQ-5-4能够最快进入对数生长期,布氏乳杆菌GQ-3-21在6 h后进入对数生长期,最终菌液浓度较高,且上述菌株在发酵12 h时pH均小于4.0。另外本研究中产酸速度最快的菌株是GQ-3-2,pH在发酵2 h已经降至5以下。粪肠球菌Y-3-15发酵开始生长速度很快,进入生长稳定期太早(发酵10 h)导致其稳定期菌液浓度低,相对应的其pH最终未达到3.5以下。这说明菌株GQ-3-2、GQ-3-29及GQ-5-4可作为候选菌株,在青贮发酵初期快速降低pH方面发挥作用。
3.3 乳酸菌耐酸性能评价
耐酸性能是评价青贮用乳酸菌的另一重要标准。根据全株玉米青贮的质量标准(T/CAAA 005—2018),pH小于4.2的全株玉米青贮为优质青贮。而且,良好的耐酸能力有助于乳酸菌适应青贮中的低pH环境,直接影响青贮后期的发酵效果[15]。已有研究中,白长胜等[17]从玉米、酸菜和淘米水中分离得到3株耐酸性能较好的菌株,这3株乳酸菌在pH 3.0的存活率大于10%,说明耐酸能力较强。在本研究中,我们测定了37株乳酸菌对pH 3.0、3.5和4.0的耐受性,发现菌株GQ-3-18、GQ-3-19、GQ-3-29、GQ-5-6、GQ-5-7、Y-3-22在pH 3.5能够较好存活,而当pH降至3.0时,只有粪肠球菌Y-3-15存活率较高。而且,粪肠球菌Y-3-15对酸碱度从pH 4.0至pH 3.0的下降表现不敏感,存活率不会随pH的下降表现明显变化。这说明菌株Y-3-15可作为构树青贮饲料发酵的候选菌株。
3.4 乳酸菌抑菌性能评价
乳酸菌对病原菌和腐败菌的抑菌活性在抑制不良微生物发酵方面具有重要意义。具有良好抑菌性能的菌株通过抑制不良菌株生长而保证饲料的卫生安全[18]和动物肠道健康。已有研究中,郑昕等[19]从健康鸡盲肠内容物中分离的7株乳酸菌对大肠杆菌、沙门氏菌和金黄色葡萄球菌均具有抑制作用。雷晓青等[18]评价3株乳酸菌的抑菌性能,发现3株乳酸菌对金黄色葡萄球菌和大肠杆菌均具有抑制作用。此外,已有研究发现,在大多数菌株中观察到的抗菌活性来自发酵代谢的最终产物[20],包括有机酸、细菌素[21-22]和过氧化氢,但乳酸菌产生积累过氧化氢依赖于环境中较高的氧浓度及较低温度。本研究中,菌株GQ-3-2、GQ-3-29、GQ-5-4对沙门氏菌、金黄色葡萄球菌及大肠杆菌均具有抑制作用,可做为候选菌株用于青贮发酵。这些菌株的抑菌性能除了与产生的有机酸有关外,也可能存在其他化合物参与,有待后续进一步研究 。
3.5 乳酸菌候选菌株之间拮抗性评价
本研究中分别从生长及产酸性能、耐酸性能以及抑菌性能等方面评价筛选后,确定GQ-3-2、GQ-3-29、GQ-5-4、Y-3-15和GQ-3-21作为候选菌株用于后期构树青贮饲料发酵。但是,不同菌株之间的合理配伍是优化发酵饲料品质的前提与关键[17]。因此,为了进一步确定候选菌株粪肠球菌Y-3-15及布氏乳杆菌GQ-3-21与植物乳杆菌GQ-3-2、GQ-3-29、GQ-5-4之间无拮抗作用、不会互相抑制生长,本研究进行菌株拮抗性试验,结果显示各菌株之间不存在抑制作用,可以作为复合制剂的备用菌株。
4 结 论
本试验研究成功筛选出5株优良发酵乳酸菌,其中3株植物乳杆菌、1株粪肠球菌、1株布氏乳杆菌,且菌株之间无拮抗作用,可为下一步乳酸菌复合制剂的制作和应用提供理论依据,为开发构树青贮用乳酸菌提供试验材料。

