丙泊酚后处理对离体培养胎鼠海马神经元凋亡及cPKCγ/GAP-43信号通路的影响*
谭彬彬,张彦,张红霞,陈君
(天津大学附属天津市环湖医院 麻醉科,天津 300350)
新生儿缺氧缺血性脑病(hypoxic-ischaemic encephalopathy, HIE)是指围生期发生窒息,导致胎儿缺氧缺血带来的脑损伤[1]。据统计,高危妊娠产妇生产的新生儿HIE 发病率明显高于正常妊娠产妇[2],此外胎儿宫内窘迫等也会增加HIE 发生风险[3]。妊娠期时,胎儿大脑仍处于发育期,对中枢神经系统的刺激异常敏感,HIE 会导致神经功能障碍,严重时还会发生脑瘫、癫痫等症状,对患儿生活造成严重影响。丙泊酚是一种溶于脂质乳剂的烷基酚衍生物,作为麻醉剂和催眠剂广泛应用于临床,具有起效快、恢复时间短的特点[4]。除麻醉作用之外,临床中也利用丙泊酚的神经保护作用,与右美托咪定联合治疗脑缺血再灌注损伤[5]。有研究表明,丙泊酚可以抑制炎症通路的激活,对大脑中动脉栓塞大鼠模型的神经功能发挥保护作用[6]。因此,本研究将胎鼠海马神经元进行缺氧处理,探究丙泊酚后处理对神经元产生的影响,并对其机制进行初步探究,为HIE 治疗提供新思路。
1 材料与方法
1.1 实验动物
10 只健康SD 孕鼠(孕16~18 d),购自上海睿太莫斯生物科技有限公司,实验动物生产许可证号:SCXK(沪)2021-0001,实验动物使用许可证号:2021-SYDWLL-00489。
1.2 主要试剂及仪器
1.2.1 主要试剂丙泊酚注射液(国药准字H20030115,10 mg/mL,四川国瑞药业有限责任公司),胰蛋白酶-EDTA 处理液(浙江联硕生物科技有限公司),DMEM/F-12 培养基(南京建成生物工程研究所),BrainPhys 神经元培养基(北京友谊中联生物科技有限公司),胎牛血清(德国默克公司),超氧化物歧化酶(superoxide dismutase, SOD)检测试剂盒(上海酶联生物科技有限公司),丙二醛(Malondialdehyde, MDA)检测试剂盒(南京建成生物工程研究所),神经元特异性烯醇化酶(neuron specific enolase, NSE)免疫组织化学试剂盒(上海彩佑实业有限公司),蛋白提取试剂盒、MTT 试剂盒(北京索莱宝科技有限公司),Annexin V-FITC/PI 细胞凋亡检测试剂盒、Hifair®ⅢOne Step RT-qPCR SYBR Green Kit(货号:11143ES50)(上海翌圣生物科技股份有限公司),兔抗大鼠经典型蛋白激酶Cγ(classical protein kinase Cγ ,cPKCγ)、生长相关蛋白-43(growth associated protein-43,GAP-43)单抗、HRP 标记山羊抗兔二抗(美国Abcam 公司)。
1.2.2 主要仪器生物安全柜BSC-1000IIA2(苏州苏洁医疗器械有限公司),二氧化碳培养箱(深圳市瑞沃德生命科技有限公司),酶标分析仪(北京普朗新技术有限公司),Attune 流式细胞仪(赛默飞世尔科技中国有限公司),倒置生物显微镜MI52-M(广州市明美光电技术有限公司),Odyssey 近红外成像系统(美国LI-COR Biosciences 公司)。
1.3 方法
1.3.1 细胞培养采用1%异氟醚麻醉孕鼠,在无菌条件下剖腹手术取出胎鼠。迅速将胎鼠断头,在立体显微镜下分离脑组织中海马体并剪碎,置于离心管中,加入等体积0.25%胰蛋白酶-EDTA 处理液37℃消化15 min,加入无血清DMEM/F-12 培养基终止消化,200 目尼龙网过滤,离心弃上清液,用含10%胎牛血清的DMEM/F-12 培养基吹散细胞,制成细胞悬液并计数。将细胞悬液按5×105个/mL 的密度接种到涂有聚赖氨酸的培养板中,在37℃、5%二氧化碳CO2培养箱中培养,24 h 时将培养基全部换为BrainPhys 神经元培养基,每3 天更换1 次培养基。取培养第7 天的神经元细胞爬片,用NSE 免疫组织化学试剂盒鉴定神经元,加入1∶400 稀释NSE 抗体孵育后,DAB 显色剂显色,在显微镜下观察到海马神经元呈棕褐色。
1.3.2 实验分组将鉴定过的神经元随机分为对照组、缺氧组和丙泊酚组。缺氧组和丙泊酚组放置于90%二氧化氮NO2+10% CO2无氧培养箱中缺氧处理30 min。丙泊酚组在缺氧处理后立即吸出原培养基,加入终浓度为50 μmol/L 的丙泊酚新培养基;对照组和缺氧组换等体积的新培养基,放回37℃,5%CO2恒温培养箱孵育2 h[7]。
1.3.3 MTT法检测神经元存活率孵育2 h 后,取各组细胞加入胰蛋白酶-EDTA 处理液进行消化,将消化后的细胞加入1.5 mL EP 管,1 200 r/min 离心5 min,弃上清液,用培养基将EP 管底部细胞重悬并计数。取96孔板加入各组细胞(180 μL/孔,5 000个细胞),并设置调零孔(无血清DMEM/F-12 培养基、MTT、Formazan 溶解液),以上每组设5 个复孔。各孔中加入90 μL无血清DMEM/F-12培养基和10 μL MTT溶液,培养4 h,吸去上清液,各孔加入110 μL Formazan 溶解液,摇床上震荡10 min 使孔中结晶物质完全溶解[8]。采用酶标仪检测各孔在490 nm处的吸光值(optical density, OD)。按照公式:神经元存活率=样品孔OD 值/对照组OD 值×100%,计算各组神经元存活率。
1.3.4 流式细胞仪检测神经元凋亡率加入胰蛋白酶-EDTA 处理液消化细胞,1 200 r/min 离心5 min收集细胞,用PBS 洗 涤细胞2 次,1 200 r/min 离心5 min 收集细胞,吸去PBS 加 入100 μL Bingding Buffer 将细胞重悬,加入5 μL Annexin V-FITC 和10 μL PI Staining Solution,轻摇混匀,室温下避光反应10 min,加入400 μL Bingding Buffer 混匀,用流式细胞仪检测细胞凋亡率[9]。
1.3.5 比色法检测神经元SOD 活性和MDA 含量用胰蛋白酶-EDTA处理液消化各组细胞,1 200 r/min离心5 min后弃上清液,加入1 mL提取液,在超声机中破碎细胞,具体参数:200 W,3 s/次,超声30次,间隔10 s,冰浴下进行。5 000 r/min 离心10 min,取上清液,检测SOD 活性和MDA 含量[10]。
1.3.6 实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction, qRT-PCR)检 测cPKCγ、GAP-43 mRNA 的表达取1.3.2 中细胞,弃培养液,提取细胞中总RNA,42℃、10 min 逆转录为cDNA。qRT-PCR 扩增反应条件:95℃预变性5 min,95℃变性10 s,60℃退火30 s,共40 个循环。cPKCγ 正向引物序列:5'-GCCGTACCAATAACAT-3',反向引物序列:5'-CAGATACATGACATAG-3',长度411 bp; GAP-43 正向引物序列: 5'-GTTACATAGCATAAGAC-3',反向引物序列:5'-TAACATAGCATTGACAT-3',长度138 bp。以βactin 作为内参基因,采用2-△△Ct法计算目的基因相对表达量。
1.3.7 Western blotting 检测cPKCγ、GAP-43 蛋白的表达吸去各组细胞培养基,分别加入200 μL 细胞裂解液,用移液器吸头混合15 min,吸出至1 mL EP管中,4℃、3 000 r/min 离心10 min,取上清液,用BCA试剂盒测定各组细胞蛋白质浓度。向每个细胞裂解物样品中加入上样缓冲液800 μL,100℃煮沸5 min,加入12% SDS-PAGE 凝胶,将蛋白转移到聚偏二氟乙烯膜(厚0.22 μm)上,5%脱脂牛奶封闭1 h。4℃条件下1∶500 稀释的兔抗大鼠cPKCγ、GAP-43 单抗孵育过夜,TBST 缓冲液冲洗膜,HRP 标记山羊抗兔二抗孵育2 h[11]。在Odysse 系统下观察蛋白条带,并用Image J 软件进行相对定量分析,以β-actin 为内参蛋白。
1.4 统计学方法
数据分析采用SSPS 12.0 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 离体培养神经元鉴定结果
免疫组织化学染色结果显示,神经元胞浆及突触呈棕褐色,细胞形态良好且饱满,轴突清晰,神经元生长状况良好。见图1。

图1 培养第7天的海马神经元(免疫组织化学染色×400)
2.2 3组海马神经元存活率比较
对照组、缺氧组、丙泊酚组海马神经元存活率分别为(100.00±0.00)%、(68.83±1.16)%和(80.17±1.66)%,经方差分析,差异有统计学意义(F=910.339,P=0.000)。进一步两两比较:与对照组相比,缺氧组和丙泊酚组海马神经元存活率降低(P<0.05);与缺氧组比较,丙泊酚组海马神经元存活率升高(P<0.05)。
2.3 3组海马神经元凋亡率比较
对照组、缺氧组、丙泊酚组海马神经元凋亡率分别为(7.18±0.11)%、(11.31±1.11)%和(9.02±0.19)%,经方差分析,差异有统计学意义(F=50.157,P=0.000)。进一步两两比较:与对照组相比,缺氧组和丙泊酚组海马神经元凋亡率升高(P<0.05);与缺氧组比较,丙泊酚组海马神经元凋亡率降低(P<0.05)。
2.4 3组海马神经元SOD活性和MDA含量比较
对照组、缺氧组、丙泊酚组海马神经元SOD 活性和MDA 含量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较:与对照组相比,缺氧组和丙泊酚组海马神经元SOD 活性降低(P<0.05),MDA 含量增加(P<0.05);与缺氧组相比,丙泊酚组海马神经元SOD 活性升高(P<0.05),MDA 含量减少(P<0.05)。见表1。
表1 3组海马神经元SOD活性、MDA含量比较 (±s)
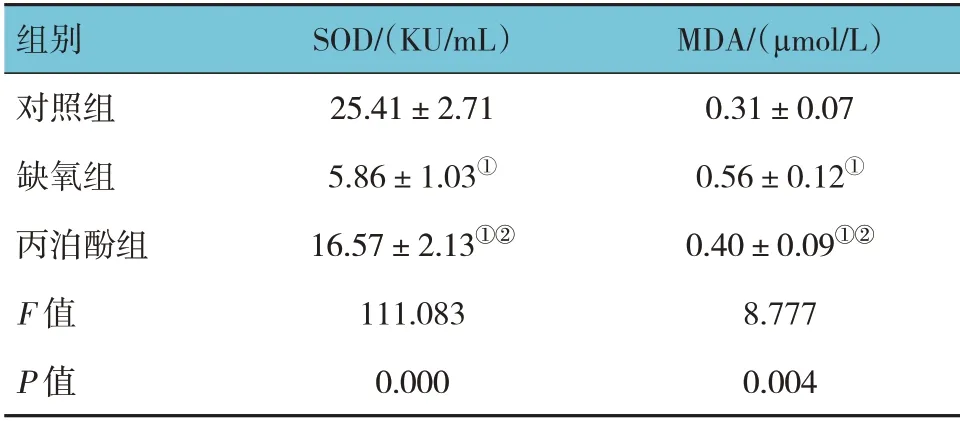
表1 3组海马神经元SOD活性、MDA含量比较 (±s)
注:①与对照组比较,P <0.05;②与缺氧组比较,P <0.05。
组别对照组缺氧组丙泊酚组F 值P 值MDA/(μmol/L)0.31±0.07 0.56±0.12①0.40±0.09①②8.777 0.004 SOD/(KU/mL)25.41±2.71 5.86±1.03①16.57±2.13①②111.083 0.000
2.5 3组海马神经元cPKCγ、GAP-43 mRNA相对表达量比较
对照组、缺氧组、丙泊酚组海马神经元cPKCγ、GAP-43 mRNA 相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较:与对照组比较,缺氧组和丙泊酚组海马神经元cPKCγ、GAP-43 mRNA 相对表达量降低(P<0.05);与缺氧组相比,丙泊酚组海马神经元cPKCγ、GAP-43 mRNA相对表达量升高(P<0.05)。见表2。
表2 3组海马神经元cPKCγ、GAP-43 mRNA相对表达量比较 (±s)

表2 3组海马神经元cPKCγ、GAP-43 mRNA相对表达量比较 (±s)
注:①与对照组比较,P <0.05;②与缺氧组比较,P <0.05。
组别对照组缺氧组丙泊酚组F 值P 值GAP-43 mRNA 1.33±0.19 0.61±0.10①1.10±0.16①②28.291 0.000 cPKCγ mRNA 1.07±0.21 0.58±0.08①0.81±0.11①②14.401 0.001
2.6 3组海马神经元cPKCγ、GAP-43蛋白相对表达量比较
对照组、缺氧组、丙泊酚组海马神经元cPKCγ、GAP-43 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较:与对照组相比,缺氧组和丙泊酚组海马神经元cPKCγ、GAP-43蛋白相对表达量降低(P<0.05);与缺氧组比较,丙泊酚组海马神经元cPKCγ、GAP-43 蛋白相对表达量升高(P<0.05)。见表3。
表3 3组海马神经元cPKCγ、GAP-43蛋白相对表达量比较 (±s)

表3 3组海马神经元cPKCγ、GAP-43蛋白相对表达量比较 (±s)
注:①与对照组比较,P <0.05;②与缺氧组比较,P <0.05。
组别对照组缺氧组丙泊酚组F 值P 值GAP-43蛋白1.17±0.21 0.38±0.09①0.81±0.14①②32.681 0.000 cPKCγ蛋白0.84±0.14 0.31±0.05①0.66±0.10①②33.941 0.000
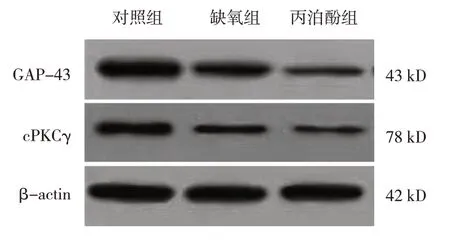
图2 3组海马神经元cPKCγ,GAP-43蛋白的表达
3 讨论
丙泊酚是现代医学中使用最广泛的静脉麻醉剂之一。除麻醉作用外,丙泊酚对脑缺血大鼠还有神经保护作用。有研究显示,丙泊酚可以降低NMDA 受体的磷酸化程度,减少兴奋的传递,从而抑制钙离子通道开放,导致钙超载,减轻神经元损伤[12]。16~18 d 孕期的胎鼠神经系统最为敏感。因此,本研究选取该时间段的胎鼠海马神经元进行体外培养,并进行缺氧处理。
笔者在正式实验前先进行了预实验,设置不同浓度梯度的丙泊酚,分析其对正常海马神经元的影响,结果发现50 μmol/L 丙泊酚可以发挥抗神经元凋亡的作用,升高浓度后,神经元活性开始降低,因此选取50 μmol/L 作为正式研究浓度。本研究结果显示,与对照组比较,缺氧组和丙泊酚组神经元存活率降低,凋亡率上升;缺氧神经元经丙泊酚后处理后,神经元存活率升高,凋亡率下降,说明丙泊酚后处理可以保护神经元。既往研究显示,丙泊酚可以抑制海马神经元凋亡,对持续癫痫大鼠模型具有治疗作用[13]。丙泊酚后处理还可以减弱谷氨酸诱发的PC12 细胞凋亡,缓解细胞自噬[14]。SOD 是抗氧化酶,可以消除过量氧自由基发挥保护神经元的作用[15];MDA 是脂质氧化产物,两者对氧化应激具有指示作用[16]。与对照组比较,缺氧组和丙泊酚组SOD 活性降低,MDA 含量增加;与缺氧组比较,丙泊酚组SOD 活性增加,MDA 含量减少,提示丙泊酚可以提高海马神经元抗氧化能力。有研究显示,丙泊酚对心肌缺血再灌注损伤大鼠模型具有心肌细胞保护作用,同时可以增加受损心肌细胞SOD 活性,降低MDA 含量[17]。一定剂量的丙泊酚与二甲双胍联合使用可显著提高小鼠脑组织SOD 活性并降低血清MDA 含量,促进自由基及其代谢物的清除[18]。结合以上研究与本研究结果,进一步说明丙泊酚后处理可以提高海马神经元抗氧化能力,具有神经保护作用。
本研究结果显示,与对照组相比,缺氧组和丙泊酚组cPKCγ、GAP-43 mRNA 和蛋白相对表达量降低;与缺氧组比较,丙泊酚组cPKCγ、GAP-43 mRNA 和蛋白相对表达量升高。cPKCγ 是经典PKC 亚家族的成员,在中枢神经系统中普遍表达,是参与神经保护的信号转导途径的重要组成部分[19]。上调cPKCγ 可以减轻小鼠皮质神经元缺血性损伤。GAP-43 是cPKCγ 的底物,在神经元中广泛表达。在反应性突触发生、突触前末端的生长、轴突形成和再生,以及突触可塑性的诱导中发挥重要作用[20]。有研究显示中风和外伤性脑损伤会导致GAP-43 下调[21],并且上调GAP-43 的表达可以改善癫痫大鼠的认知功能,增加海马区神经元数量[22]。因此结合本研究结果,缺氧处理的神经元经丙泊酚后处理后,可以上调cPKCγ、GAP-43 mRNA 和蛋白的表达,减轻缺氧带来的神经损伤。
综上所述,丙泊酚后处理可以保护离体培养的胎鼠海马神经元,减轻神经损伤程度,该保护作用可能与激活cPKCγ/GAP-43 信号通路有关。这一结果为临床治疗HIE 提供了实验基础,但丙泊酚激活cPKCγ/GAP-43 信号通路的具体机制尚不明确,仍需进一步研究阐明。

