伴有脑白质高信号的多系统萎缩患者临床特征分析
黄晶晶, 陈志刚, 张新宁, 王 垚, 薛 静 冉维正, 田文杨, 赵倩煜, 郭冰玉, 李学军
多系统萎缩(multiple system atrophy,MSA)是一种罕见的且具有致死性的神经退行性疾病,临床表现可见帕金森样症状、小脑性共济失调和自主神经功能障碍[1]。其主要病理特征是少突胶质细胞内α-突触核蛋白聚集形成包涵体,导致了少突胶质细胞功能障碍,从而引起脱髓鞘改变以及对神经元营养支持作用的减少[2]。因此,除神经元丢失外,白质退行性变可能是MSA的核心特征。脑小血管病(cerebral small vessel diseases,CSVD)是临床常见的脑血管病之一,脑白质高信号(white matter hyperintensity,WMH)是其常见的影像学表现,临床表现可见认知障碍、步态障碍、情感障碍及二便障碍。因此,CSVD共患病可能加重MSA患者的临床症状。本研究通过观察MSA伴WMH患者的临床特征,进一步对不同程度的WMH进行划分,旨在探讨WMH与MSA患者临床症状的相关性,以及MSA患者出现WMH的危险因素。
1 资料与方法
1.1 研究对象 选取2018年5月-2021年8月北京中医药大学东方医院就诊的MSA患者88例。纳入标准:(1)符合2008年Gilman等[1]提出的第二版诊断标准中可能或很可能的MSA;(2)年龄30~80岁。排除标准:(1)其他原因导致的脑白质病变:如多发性硬化、中枢神经系统感染、一氧化碳中毒、脑积水、脑部肿瘤、颅脑外伤等;(2)卒中或心肌梗死病史;(3)合并严重心肝肾脏器功能障碍或恶性肿瘤;(4)有精神疾病或不能配合认知测试者。本研究通过了北京中医药大学东方医院伦理委员会批准,所有患者均签署了知情同意书。
1.2 资料采集 收集患者的一般人口学信息和脑血管病危险因素相关的既往病史。
采用统一多系统萎缩量表(unified multiple system atrophy rating scale,UMSARS)总分、UMSARS第四部分整体失能等级(UMSARS Ⅳ)评估患者整体病情严重程度。采用蒙特利尔认知评估量表(the Montreal cognitive assessment scale,MoCA)评估认知功能。运动症状评估采用UMSARS第二部分运动检查(UMSARS Ⅱ),分别记录UMSARSⅡ总分及震颤、强直、运动迟缓、共济失调、步态姿势异常的亚分数。其中震颤=2.4静止性震颤+2.5动作性震颤;强直=2.6张力增高;运动迟缓=2.7快速轮替+2.8轻叩对指+2.9腿部灵活度+2.11从座位上站起;共济失调=2.7快速轮替+2.8轻叩对指+2.9腿部灵活度+2.10跟膝胫试验;步态姿势异常=2.12姿势+2.13身体摇晃+2.14步态。
采用膀胱过度活动症症状评分(the overactive bladder symptom score,OABSS)评估受试者尿频尿急症状,采用国际尿失禁咨询问卷简表(the International Consultation on Incontinence Questionnaire-Short Form,ICIQ-SF)评估尿失禁症状,采用Wexner便秘评分评估便秘症状,并统计受试者有无大便失禁症状。
回顾患者量表评估前后3个月内的MRI检查结果,结合T1WI、T2WI和T2FLAIR序列,由两名经过培训的神经内科医生进行Fazekas量表评分,分为脑室周围白质高信号(periventricular white matter hyperintensity,PVH)0~3分,和深部白质高信号(deep white matter hyperintensity,DWMH)0~3分[3,4]。
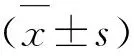
2 结 果
2.1 基线资料分析 本研究共纳入研究对象88例,男性61例,女性27例;年龄40~78岁,平均(56.57±8.14)岁;发病年龄39~77岁,平均(53.95±7.93)岁;MSA-帕金森型(MSA-Parkinsonian subtype,MSA-P)27例(30.68%),MSA-小脑共济失调型(MSA-cerebellar ataxia,MSA-C)61例(69.32%);可能的MSA29例(32.95%),很可能的MSA59例(67.05%)。PVH评分0分23例(26.14%),1分57例(64.77%),2分8例(9.09%),无3分患者。DWMH评分0分41例(46.59%),1分39例(44.32%),2分8例(9.09%),无3分患者(见表1、表3)。
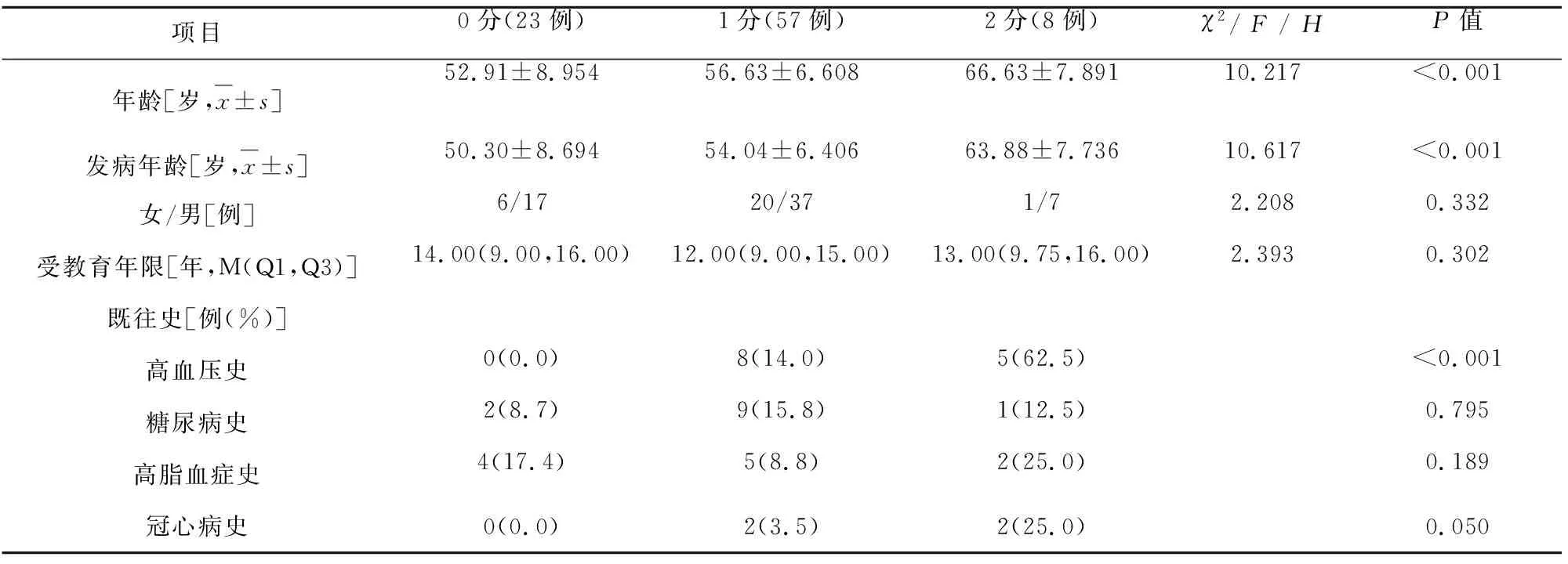
表1 PVH不同等级患者一般资料的比较
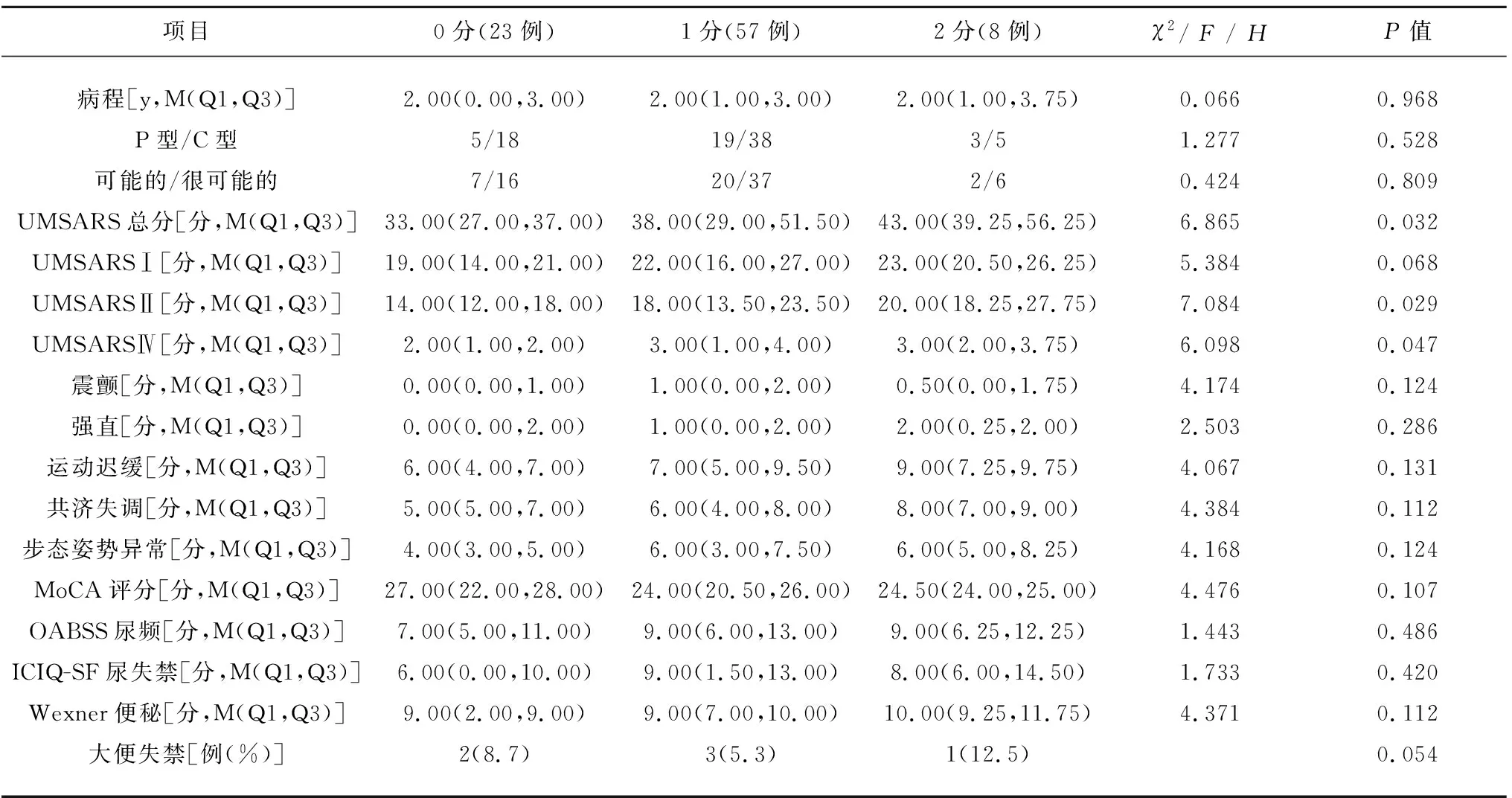
表2 PVH不同等级患者临床特征的比较
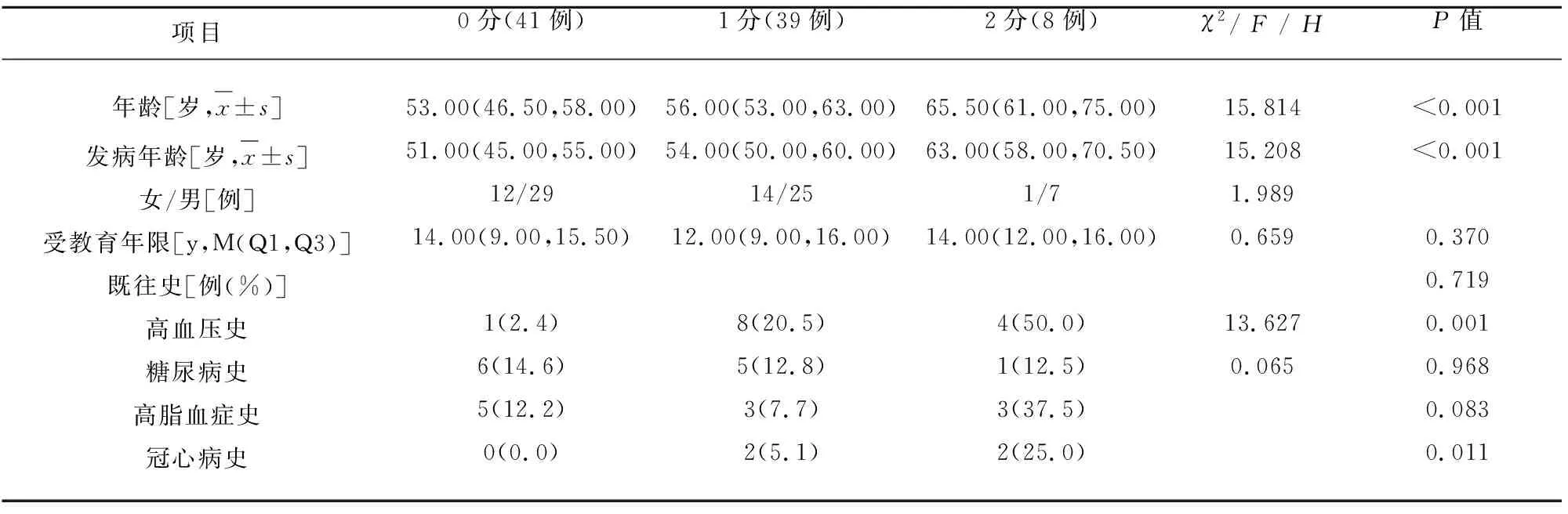
表3 DWMH不同等级患者一般资料的比较
2.2 PVH不同等级患者临床特征的比较 PVH不同等级患者在UMSARS总分、UMSARS Ⅱ、UMSARS Ⅳ评分方面存在显著性差异(P<0.05),在病程、临床亚型、诊断等级、UMSARS Ⅰ、震颤、强直、运动迟缓、共济失调、步态姿势异常、MoCA、OABSS、ICIQ-SF、Wexner得分、大便失禁方面差异无统计学意义(见表2)。
2.3 DWMH不同等级患者临床特征的比较 DWMH不同等级患者在UMSARS总分、UMSARSⅠ、UMSARSⅡ、UMSARS Ⅳ评分方面存在显著性差异(P<0.05),在病程、临床亚型、诊断等级、震颤、强直、运动迟缓、共济失调、步态姿势异常、MoCA、OABSS、ICIQ-SF、Wexner得分、大便失禁方面差异无统计学意义(见表4)。

表4 DWMH不同等级患者临床特征的比较
2.4 MSA患者发生WMH危险因素的有序Logistic回归分析 分别以PVH、DWMH评分作为因变量,对一般资料的单因素分析中P<0.05的指标进一步行有序Logistic回归分析。因发病年龄与入组年龄存在相关性,因而只纳入入组年龄。结果显示,入组年龄、高血压史是MSA患者发生PVH或DWMH的独立危险因素(见表5、表6)。
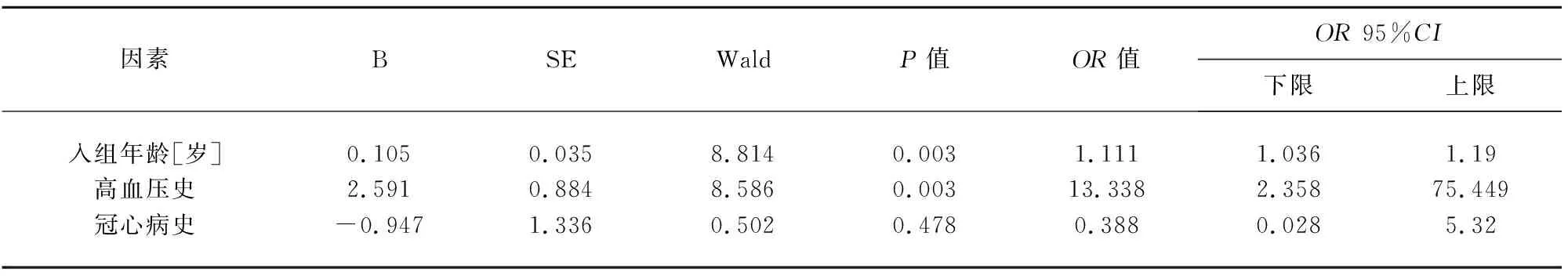
表5 MSA患者发生PVH危险因素的有序Logistic回归分析
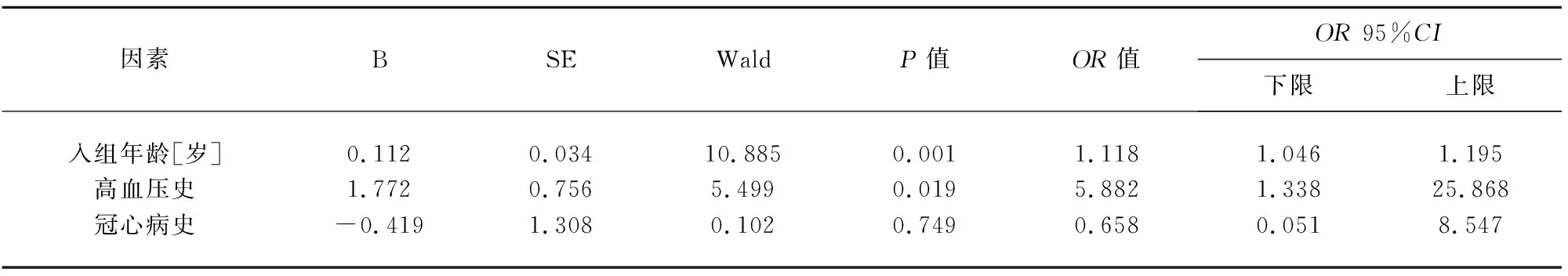
表6 MSA患者发生DWMH危险因素的有序Logistic回归分析
3 讨 论
MSA是一种进行性神经退行性疾病,以自主神经功能障碍、帕金森综合征、小脑性共济失调为特征,病情进展迅速,目前缺乏有效的治疗手段,预后极差[5]。既往研究发现,MSA患者中存在广泛的白质损害,这是MSA特有的表现。一种解释是,MSA中的白质异常最初可能高度局限于大脑的脆弱区域,随疾病的发展而扩大;另一种观点认为,白质异常一开始就是弥散性的,随着疾病的发展变得越来越严重[6]。这反映了α-syn在少突胶质细胞中的广泛聚集,从而导致少突胶质细胞功能障碍和进行性脱髓鞘[7]。Del Campo等研究表明,MSA患者存在普遍的白质微结构异常,与运动症状和认知功能相关[6]。因此,MSA患者的白质损害值得重视。
本研究纳入88例MSA患者,其中65例(73.86%)伴PVH,47例(53.41%)伴DWMH。Hatakeyama等纳入59例MSA患者,进行PVH分级的中位数为1(1~2),DWMH分级的中位数为1(0.75~2)[8]。Rulseh等纳入20名MSA患者和20名健康对照组行DTI检查,发现两组受试者间的白质存在广泛的差异,主要体现在增加的RD值和MD值上,MD值是白质的敏感性但非特异性标记,RD值已被证明与髓鞘的完整性相关[9]。这提示白质可能是MSA患者不良预后的重要因素。
本研究发现,PVH、DWMH分级均与患者的UMSARS总分及Ⅳ分数相关,DWMH分级又与UMSARSⅠ相关,提示WMH与患者的病情严重程度相关。未发现WMH评分与病程、临床亚型、诊断等级间的相关性,提示白质损害在不同分型、不同诊断等级的MSA患者中普遍存在。白质受损可能参与了MSA的发病过程,且与病程无关,提示可能是发病因素,并非继发性改变,可能是预测MSA进展和预后的潜在生物标志物。
已有研究表明,MSA患者存在全脑弥散性白质异常,与运动症状(UMSARS Ⅱ)有关[6]。一项基于体素的形态计量学研究对14例MSA患者和14例健康对照组研究发现,小脑和部分皮质区的灰质减少,小脑、小脑脚和脑干的白质减少,进一步随访1 y发现,MSA患者有额外的胼胝体白质受损,这可能反映了神经退行性变和皮质萎缩的一种特异性疾病模式,也与MSA患者的运动功能损害相符[10]。本研究发现,脑室旁WMH和深部WMH均与MSA患者的运动症状相关,随WMH评分升高运动症状加重。其机制可能与WMH累及与运动相关的神经网络有关,白质纤维束损伤影响脊髓对运动的控制[11~13],白质纤维束微结构的完整性被破坏,导致结构网络效率降低,从而影响运动任务中最佳信息的处理和整合[11,14,15]。
既往研究表明,MSA的认知损害可能与皮质下网络功能障碍与皮质萎缩之前的脑白质变性相关[16]。Hatakeyama等研究发现,WMH是MSA患者额叶功能障碍的预测因子,但并未发现白质退行性变与快速进展性认知障碍之间的关联,可能是由于白质损伤的特点更容易引起额叶功能障碍而不是整体认知功能受损[8]。Griffanti等具体研究WMH不同的病变部位对认知功能发现,相比DWMH而言,PVH与认知水平及下降速度显著相关[17],其病理机制可能与胼胝体、后扣带白质纤维改变、楔叶和额中回功能连接受损密切相关。本研究结果提示,高PVH分级、高DWMH分级均与MSA患者的认知功能无关,可能与本研究选用MoCA量表评估患者的整体认知功能有关,今后的研究中需要更详尽的认知测评,且进行随访以探索WMH与患者认知障碍进展的关系。
WMH的发生存在多种潜在的危险因素,加深对其危险因素的了解有助于进行早期临床干预。Indelicato等研究发现,MSA患者的卧位高血压与脑白质损害有关[18]。Lim等研究也表明,卧位收缩压是WMH严重程度的主要影响因素,提示MSA患者存在脑靶器官损害[19]。本研究对MSA患者不同部位、不同严重程度WMH的危险因素进行单独探究发现,年龄、高血压史均是MSA患者伴发PVH或DWMH的独立危险因素。但值得注意的是,对MSA患者血压的管理要更为谨慎,尤其是体位性低血压严重的患者,卧位血压非常高,而立位血压却低于正常范围,盲目降压可能会给患者带来生命危险,未来需要进一步开发有效的超高血压和低血压的治疗策略。此外,动态血压波动对脑血流灌注及WMH的影响尚需进一步研究,也不应排除少突胶质细胞退变与WMH相关的可能性[20]。
综上所述,本研究结果显示,部分MSA患者可见WMH、PVH、DWMH分级与患者的运动症状及病情严重程度相关。年龄和高血压病史是MSA伴发PVH、DWMH的独立危险因素,可能与其发病机制和预后有关。目前MSA的病因和发病机制尚不明确,治疗手段有限,研究MSA发生、进展和预后的影响因素可为明确其发病机制和治疗策略提供依据。由于本研究为单中心的回顾性研究,且MSA为罕见病,样本量较少,研究结果存在一定的局限性,未来还需要更全面的纵向研究支持。

