血清G-17、PG与Hp联合检测在胃癌癌前病变及早期胃癌筛查中的应用价值
周 铃,刘冬梅
(1. 重庆北部宽仁医院,重庆 400000 ;2. 重庆市南川区人民医院,重庆 408400)
胃癌是一种发生在胃黏膜上皮的消化系统恶性肿瘤。研究指出,在所有的恶性肿瘤中,胃癌的致死率居第二位[1-2]。近年来随着人们饮食结构和生活习惯的改变,胃癌的发病率逐年升高,且此病患者的发病年龄趋于年轻化。早期胃癌患者的症状相对隐匿,其病情的确诊率较低。多数胃癌在发现时已处于中晚期,错失了最佳的治疗时机,导致此病患者的预后不理想[3]。因此,早期准确诊断是决定胃癌患者预后的关键。本文主要是探讨血清胃泌素-17(G-17)、胃蛋白酶原(PG)与幽门螺杆菌(Hp)联合检测在胃癌癌前病变及早期胃癌筛查中的应用价值。
1 资料与方法
1.1 一般资料
选择2020 年1 月至2021 年5 月我院收治的66例胃部疾病患者作为研究对象。其纳入标准是:临床资料完整;患有胃部疾病,包括胃部良性病变、胃癌癌前病变和早期胃癌(胃癌的诊断依据为《中国早期胃癌筛查及内镜诊治共识意见》);胃肠道的状态较好,可经鼻胃管行肠内营养支持;自愿参与本研究,并签署了书面协议。其排除标准是:有消化道恶性肿瘤史;在参与本研究前的4 周内使用过华法林、阿司匹林或非甾体类抗炎药;近3 周内使用过抗生素或质子泵抑制剂;存在严重的心、肝、肾等器官功能障碍;正在接受放疗或化疗;合并有其他严重的器质性疾病,预计的生存期短于本次试验的时间。在这些患者中,有男38 例,女28 例;其平均年龄为(62.46±3.94)岁。根据这些患者的年龄将其分为老年组(n=36)和中青年组(n=30)。
1.2 方法
对两组患者均进行血清G-17、PG 〔包括胃蛋白酶原Ⅰ(PG Ⅰ)、胃蛋白酶原Ⅱ(PG Ⅱ)、胃蛋白酶原比值(PGR)〕、Hp 检测及胃镜检查、病理学检查,比较其检测/ 检查结果,并以胃镜检查和病理学检查的结果为依据,统计用血清G-17、PGR 与Hp联合检测诊断胃癌癌前病变及早期胃癌的效能。对患者进行血清G-17、PG 检测的方法是:采集其清晨空腹状态下的外周静脉血5 mL,对血液标本进行离心处理,分离出血清。采用国产的化学发光仪(生产厂家:深圳市新产业生物医学工程股份有限公司;型号:MAGLUMI X8)测定血清中G-17、PG Ⅰ、PG Ⅱ的水平,并计算PGR(即PG Ⅰ与PG Ⅱ的比值)。对患者进行Hp 检测的方法是:采用13C 尿素呼气试验对其实施Hp 定性检测,其中12C/13C 的比值超过4 表示检测结果呈阳性。对患者进行胃镜检查和病理学检查的方法是:对其实施胃镜检查,分别在胃大弯、胃小弯及胃角处取活检组织(需达到胃黏膜肌层),获取标本后制成石蜡切片,常规行病理学检查,并由2 名经验丰富的病理学医师共同分析检查结果。
1.3 观察指标
观察并记录对两组患者进行胃镜检查及病理学检查的结果。比较两组患者中胃部良性病变、胃癌癌前病变、早期胃癌患者的基础资料。比较两组患者中胃部良性病变、胃癌癌前病变、早期胃癌患者血清G-17、PG Ⅰ、PG Ⅱ的水平、PGR 及Hp 的检出率。观察并统计用血清G-17、PGR 与Hp 联合检测诊断胃癌癌前病变及早期胃癌的效能〔包括ROC 曲线下面积(AUC)、灵敏度、特异度、约登指数〕。
1.4 统计学方法
用SPSS 22.0 软件处理本研究中的数据(数据由两人录入、核对),计数资料用% 表示,用χ² 检验,计量资料用均数± 标准差(±s)表示,用t检验,采用ROC 曲线分析用血清G-17、PGR 与Hp 联合检测诊断胃癌癌前病变及早期胃癌的效能,P<0.05 表示差异有统计学意义。
2 结果
2.1 对两组患者进行胃镜检查及病理学检查的结果
对两组患者进行胃镜检查及病理学检查的结果显示,其中胃部良性病变、胃癌癌前病变、早期胃癌患者分别有20 例、22 例、24 例。其中,老年组患者中胃部良性病变、胃癌癌前病变、早期胃癌患者分别有11 例、12 例、13 例,中青年组患者中胃部良性病变、胃癌癌前病变、早期胃癌患者分别有9 例、10 例、11 例。
2.2 两组患者中胃部良性病变、胃癌癌前病变、早期胃癌患者基础资料的对比
两组患者中胃部良性病变、胃癌癌前病变、早期胃癌患者的性别、BMI、吸烟史、饮酒史相比,差异无统计学意义(P>0.05)。与老年组患者相比,中青年组患者中有胃癌家族史患者的占比更高,差异有统计学意义(P<0.05)。详见表1。
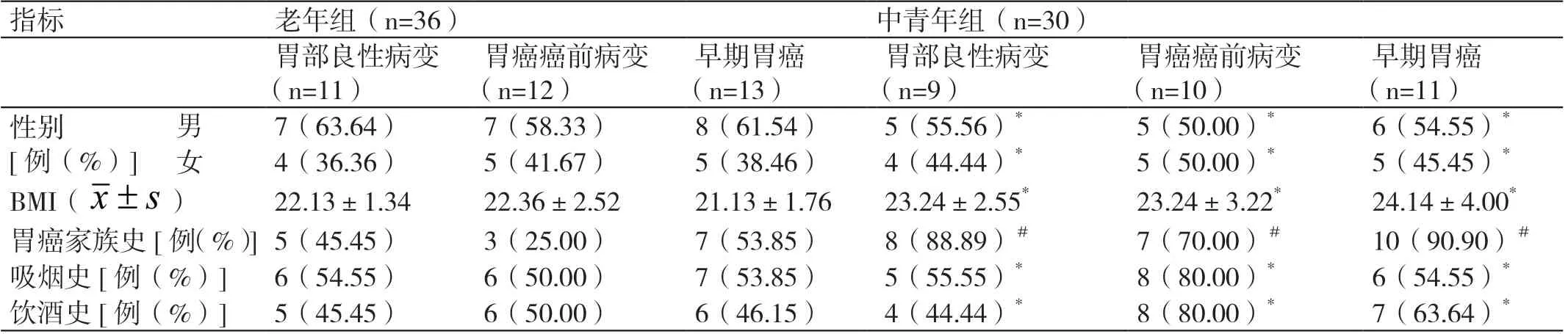
表1 两组患者中胃部良性病变、胃癌癌前病变、早期胃癌患者基础资料的对比
2.3 两组患者血清G-17、PG、Hp 检测结果的比较
在老年组患者中,胃部良性病变患者Hp 的检出率、血清G-17 和PG Ⅱ的水平均低于胃癌癌前病变患者和早期胃癌患者,其PGR 高于胃癌癌前病变患者和早期胃癌患者,差异有统计学意义(P<0.05)。在中青年组患者中,胃部良性病变患者Hp 的检出率低于胃癌癌前病变患者和早期胃癌患者,差异有统计学意义(P<0.05)。两组患者中,胃部良性病变患者Hp 的检出率、血清G-17、PG Ⅰ、PG Ⅱ的水平、PGR 相比,差异无统计学意义(P>0.05);中青年组患者中胃癌癌前病变患者和早期胃癌患者血清G-17、PG Ⅰ、PG Ⅱ的水平均低于老年组患者中的胃部良性病变患者与胃癌癌前病变患者,其PGR 高于老年组患者中的胃部良性病变患者与胃癌癌前病变患者,差异有统计学意义(P<0.05)。详见表2。

表2 两组患者血清G-17、PG、Hp 检测结果的比较
2.4 用血清G-17、PGR 与Hp 联合检测诊断胃癌癌前病变及早期胃癌的效能
用血清G-17、PGR 与Hp 联合检测诊断胃癌癌前病变的AUC、灵敏度、特异度、约登指数分别为0.759、75.21%、66.31%、0.552 ;用 血 清G-17、PGR 与Hp 联合检测诊断早期胃癌的AUC、灵敏度、特异度、约登指数分别为0.664、79.15%、73.78%、0.531。详见表3。

表3 用血清G-17、PGR 与Hp 联合检测诊断胃癌癌前病变及早期胃癌的效能
3 讨论
胃癌是一种发病率较高的消化系统恶性肿瘤,具有治愈困难、易转移和复发、致死率高等特点。胃癌好发于贲门、胃窦处,且男性的患病率明显高于女性,这主要是因为男性多有吸烟、饮酒史。胃癌进展及侵袭周围重要器官和组织的速度较快,恶性程度较高。目前,临床上尚未彻底阐明胃癌的发病原因,但已明确感染Hp 是诱发胃癌的独立危险因素。早期胃癌患者缺乏典型的症状,部分患者会出现腹胀、腹痛、纳差等症状,但均无特异性,因此其病情的早期确诊率较低。许多胃癌患者在确诊时病情已处于晚期,其预后较差[4]。据统计,早期胃癌患者术后的5 年生存率为90%,而晚期胃癌患者的5 年生存率不足20%。因此,早期诊断胃癌对延长患者的生存期至关重要[5-6]。进行胃镜检查和病理学检查是临床上诊断胃癌的“金标准”,但具有一定的创伤性,且检查费用较高,因此其普及率不高。血清学检查具有操作简单、无创、费用低、灵敏度高等优点,近年来在胃癌癌前病变及早期胃癌筛查中的应用较为广泛。本研究的结果显示,在老年组患者中,胃部良性病变患者Hp 的检出率、血清G-17 和PG Ⅱ的水平均低于胃癌癌前病变患者和早期胃癌患者,其PGR 高于胃癌癌前病变患者和早期胃癌患者,P<0.05。在中青年组患者中,胃部良性病变患者Hp 的检出率低于胃癌癌前病变患者和早期胃癌患者,P<0.05。中青年组患者中胃癌癌前病变患者和早期胃癌患者血清G-17、PG Ⅰ、PG Ⅱ的水平均低于老年组患者中的此类患者,其PGR 高于老年组患者中的此类患者,P<0.05。用血清G-17、PGR 与Hp 联合检测诊断胃癌癌前病变的AUC、灵敏度、特异度、约登指数分别为0.759、75.21%、66.31%、0.552 ;用血清G-17、PGR 与Hp 联合检测诊断早期胃癌的AUC、灵敏度、特异度、约登指数分别为0.664、79.15%、73.78%、0.531。提示用血清G-17、PG 与Hp 联合检测可对胃癌癌前病变及早期胃癌进行有效的筛查。PG 可分为PG Ⅰ、PG Ⅱ两类。生理状态下,血清中PG Ⅰ、PG Ⅱ的水平相对稳定,但当胃黏膜发生萎缩或癌病变时,PG 就会大量进入到血液中,导致血液中PG Ⅰ、PG Ⅱ的水平显著升高[7-8]。G-17 是由胃窦G 细胞分泌的具有促进消化道平滑肌收缩作用的胃肠激素。生理状态下,G-17可促使胃酸分泌和胃黏膜细胞的增殖,改善胃窦的分泌功能。当患者罹患萎缩性胃炎、胃癌癌前病变或胃癌时,其血液中G-17 的水平可明显升高。G-17 是反映胃黏膜结构和功能状态的非侵入性生物学指标。PGR 是指PG Ⅰ与PG Ⅱ的比值,其正常值在7.5 左右。Hp 感染是引起胃癌癌前病变和胃癌的独立危险因素,故进行Hp 检测有助于诊断胃癌癌前病变和胃癌。
综上所述,血清G-17、PG 与Hp 联合检测在胃癌癌前病变及早期胃癌的筛查中具有较高的应用价值。

