基于多重PCR技术的西瓜噬酸菌分组检测方法及其应用
杨玉文, 乔 培, 刘德华, 费诺亚, 关 巍, 赵廷昌*
(1. 中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193; 2. 吉林农业大学, 长春 130118; 3. 沈阳农业大学, 沈阳 110866)
瓜类细菌性果斑病(bacterial fruit blotch, BFB)是瓜类作物上重要的种传细菌性病害,病原菌为西瓜噬酸菌Acidovoraxcitrulli[1]。该病害在世界多个国家发生,主要危害叶片和果实,严重影响西瓜、甜瓜等葫芦科作物的产量和质量[2],同时阻碍西瓜、甜瓜种子产业的健康发展[3-4]。Somodi等[5]首次提出西瓜噬酸菌存在多样性。之后,各国学者纷纷对世界各地西瓜噬酸菌的种内遗传多样性进行了分析,将所有供试菌株分成了至少两个组[6-10],Ⅰ组的菌株主要分离自甜瓜及南瓜等寄主,Ⅱ组的菌株主要分离自西瓜。西瓜噬酸菌两个组的菌株在致病力和抗铜性等方面存在较多差异。Ⅰ组菌株对甜瓜和西瓜均具有较强的致病力,而Ⅱ组菌株对西瓜的致病力较强,对甜瓜的致病力较弱[7];Ⅰ组菌株对硫酸铜的敏感性明显低于Ⅱ组菌株[11]。了解西瓜噬酸菌对铜制剂敏感性的差异对田间防治过程中铜制剂的施用量具有重要的指导意义。因此,快速准确地区分Ⅰ组和Ⅱ组菌株对该病害的综合防治非常重要。
西瓜噬酸菌是我国进境植物检疫性有害生物之一,种子带菌是其最主要的初侵染源和远距离传播的重要途径,健康种子种苗生产是病害防治的重要手段,而快速准确的检测则是保证种子种苗健康的重要技术措施。目前,关于西瓜噬酸菌的检测大多局限于种的水平。根据16S rDNA[6,12-13]、Aave_4063和Aave_4064基因[14]、BOX-PCR片段[15]、hrpB2基因[16]序列设计特异性引物,能够有效地将其他植物病原细菌与西瓜噬酸菌区分开来。免疫学技术也已经广泛运用于西瓜噬酸菌的种间检测,单克隆抗体免疫磁珠吸附与PCR相结合的技术[6]、选择性培养基富集结合PCR形成的BIO-PCR技术[17]大大提高了检测的灵敏度;胶体金免疫层析法与PCR相结合的GICA-PCR检测技术[18]能够在蛋白和核酸两个层面上进行病原菌的检测。关于西瓜噬酸菌种内分组检测的研究仅在近年来有少量报道,根据pilL基因[19]、Ⅲ型分泌系统效应子基因Aave_2166[20]、pilA基因[21]序列的差异设计的种内引物可区分西瓜噬酸菌的两个组。然而,这3个种内分组方法均仅用于种内分组的检测,研究并没有报道这些分组引物对西瓜噬酸菌与其他植物病原菌尤其是西瓜噬酸菌近缘种的区分情况。按照目前的检测方法,西瓜噬酸菌检测到不同的组需要两个步骤,即先确定是否为西瓜噬酸菌,再区分其分组情况,过程较为复杂,费时费力。因此,建立一个能够通过一次PCR直接确定西瓜噬酸菌且准确分组的检测技术体系是非常必要的。
本研究拟将西瓜噬酸菌的种特异性引物和分组特异性引物组合起来,建立和优化一个能够一步检测西瓜噬酸菌且准确分组的多重PCR体系。通过对带菌种子浸出液、感病叶片和果实等植物组织进行直接检测,证实该多重PCR体系在生产上的准确性和可靠性,使瓜类细菌性果斑病的早期诊断更加省时省力且快速准确。
1 材料与方法
1.1 菌株
本研究所用的21株供试菌株均为本实验室保存,其中西瓜噬酸菌A.citrulli10株,其他常见植物病原细菌及西瓜噬酸菌近缘种11株,菌株的具体信息见表1。

表1 本研究所用的供试菌株Table 1 The bacterial strains used in this study
1.2 主要试剂和仪器
KOD DNA 聚合酶购自东洋纺(上海)生物科技有限公司;DNA Marker 2000+ 购自北京博迈德生物技术有限公司;抗生素购自Sigma公司;引物合成由北京六合华大基因有限公司完成。主要仪器:恒温培养箱(Thermo),摇床(上海智诚),超净工作台(上海智诚),紫外分光光度计(Thermo),PCR扩增仪(ABI),电泳仪(北京六一仪器厂),凝胶成像仪(BIO-RAD),超低温冰箱(SONY)。
1.3 培养基和菌株培养条件
西瓜噬酸菌于KB (Ampr)固体培养基(蛋白胨20 g,琼脂15 g,K2HPO41.5 g,MgSO4·7H2O 1.5 g,丙三醇15.0 mL;加去离子水至1 L,pH=7.0)上28℃培养48~60 h;挑取单菌落于KB液体(Ampr) 培养基,28℃,200 r/min培养过夜。菌液调OD600=0.3(约108cfu/mL)备用。培养基中氨苄青霉素(ampicillin)的工作浓度为100 μg/mL。
1.4 多重PCR扩增体系的建立与优化
多重PCR体系所用引物是由Yang 等[21]的西瓜噬酸菌分组引物和Bahar等[15]的西瓜噬酸菌种特异性引物组合建立的。其中,种内分组引物BFB/BFB1/BFB2是根据西瓜噬酸菌不同组pilA基因的差异设计的,通过扩增片段的大小来分组;BX-L1/BX-S-R2为西瓜噬酸菌的种特异性引物。引物具体信息见表2。

表2 西瓜噬酸菌分组检测所用引物信息Table 2 Information of primers for grouping Acidovorax citrulli
PCR扩增条件:95℃ 3 min;95℃ 30 s,55℃ 30 s,72℃ 40 s,35个循环;72℃延伸7 min;4℃保存。
试验对引物的浓度进行了优化,共设9个处理,每条引物的量如表3所示。反应体系(25 μL):10×PCR buffer 2.5 μL,dNTPs 2.5 μL,MgSO41.5 μL,KOD酶0.5 μL,5×GC enhancer 5 μL,BFB/BFB1/BFB2引物每条1 μL,BX-L1/BX-S-R2引物每条0.3 μL,模板菌液1.0 μL,超纯水补足至25 μL。取5 μL扩增产物进行1.5%琼脂糖凝胶电泳,100 V下电泳45 min,采用Bio-Rad公司的凝胶分析系统进行照相分析。

表3 多重PCR扩增体系引物浓度优化Table 3 Optimization of primer concentration in the multiplex PCR assay
1.5 多重PCR的特异性检测
以西瓜噬酸菌Ⅰ组、Ⅱ组菌株、其他植物病原细菌及西瓜噬酸菌近缘种(表1)菌液为模板,按照1.4中的扩增条件和优化后反应体系进行PCR扩增,检测体系的特异性。
1.6 多重PCR的灵敏度检测
选取西瓜噬酸菌Ⅰ组菌株pslb65和Ⅱ组菌株Aac5进行多重PCR的灵敏度检测。分别将两个菌株菌液浓度稀释为10~108cfu/mL,以其作为模板,按照1.4的扩增条件和优化后的反应体系进行PCR扩增,检测体系的灵敏度。
1.7 带菌种子检测
取10 μL 浓度为108cfu/mL 的Ⅰ组菌株pslb65菌液滴于甜瓜种子上,取10 μL 浓度为108cfu/mL 的Ⅱ组菌株Aac5菌液滴于西瓜种子上。每种菌液分别接种25粒种子,置于超净工作台中过夜阴干。自然带菌西瓜种子由北京市农林科学院和吉林农业大学惠赠,各取25粒进行检测。
取1 mL 超纯水于2 mL离心管中,放入1粒人工接菌或自然带菌的甜瓜或西瓜种子,28℃ 200 r/min振荡1 h。取上清液作为待测PCR模板,按照1.4的扩增条件和优化后的反应体系进行PCR扩增检测。
1.8 植物感病组织PCR检测
分别采集海南省自然感病的甜瓜叶片和果实各1份,以及吉林省的西瓜叶片和果实各1份。剪取自然感病的西瓜或甜瓜病健交界处1 cm2见方的叶片或果实,将其浸泡于75%乙醇,表面消毒2 min,无菌水清洗3次,放入2 mL离心管中,加入800 μL无菌水,玻璃棒充分研磨后静置30 min,取上清作为待测PCR模板。将200 mL 浓度为108cfu/mL的Ⅰ组代表菌株pslb65和Ⅱ组代表菌株Aac5,分别人工喷雾接种于出苗15 d的西瓜、甜瓜苗,7 d后取感病叶片病健交界处1 cm2见方的叶片,按照上述方法处理后作为待测模板。按照1.4的扩增条件和优化后的反应体系进行PCR扩增,使用1.5%琼脂糖凝胶电泳观察扩增结果。
1.9 西瓜、甜瓜种苗的带菌检测
用5×105cfu/mL的pslb65和Aac5菌液分别浸泡甜瓜和西瓜种子各50粒,30 min后将种子取出,在超净工作台中过夜阴干。将晾干的甜瓜和西瓜种子分别种在直径10 cm的盆中,每盆5棵,放置于光照培养箱中,25℃光照12 h,18℃黑暗12 h,相对湿度90%。自子叶出土起,每日各取甜瓜和西瓜3株,每片子叶用直径5 mm的打孔器随机打孔2个,分别将打孔所得西瓜和甜瓜子叶样品置于2 mL离心管中,加800 μL无菌水研磨,取上清液为待测模板。按照1.4的方法进行多重PCR扩增,电泳观察检测结果。试验重复3次。
2 结果与分析
2.1 多重PCR体系的构建
本研究将西瓜噬酸菌特异性引物BX-L1/BX-S-R2和分组引物BFB/BFB1/BFB2组合成一个多重PCR体系,以Ⅰ组代表菌株pslb65、Ⅱ组代表菌株Aac5为模板进行PCR扩增,结果显示:Ⅰ组代表菌株pslb65产生了两个条带,一个是西瓜噬酸菌的特异性条带(279 bp),一个是Ⅰ组菌株的特异条带(348 bp);Ⅱ组代表菌株Aac5同样产生了两个条带,一个是西瓜噬酸菌的特异性条带(279 bp),另一个是Ⅱ组菌株的特异条带(507 bp);pslb65和Aac5等量混合后扩增产生了3个条带,第一个是西瓜噬酸菌的特异性条带(279 bp),第二个是Ⅰ组菌株的特异条带(348 bp),第三个是Ⅱ组菌株的特异条带(507 bp),3个条带清晰可见,能够较好地区分开来。将多重PCR的扩增结果与两组引物单独扩增的结果相比较,各条带大小一致,能够很好地相互区分。说明由西瓜噬酸菌特异性引物BX-L1/BX-S-R2和西瓜噬酸菌分组引物BFB/BFB1/BFB2构成的该多重PCR是稳定可行的。
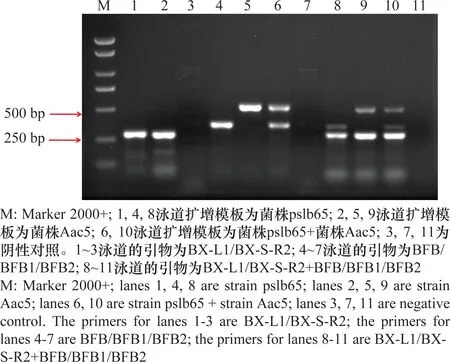
图1 多重PCR对两组西瓜噬酸菌的扩增结果Fig.1 Amplification results of two groups of Acidovorax citrulli strains by the multiplex PCR assay
2.2 多重PCR体系引物配比的优化
为了减少多条引物之间的相互干扰,实现良好的扩增效果,本研究对体系中的引物浓度进行了优化。BX-L1/BX-S-R2采用每条引物0.7、0.5、0.3 μL 3个浓度梯度,BFB/BFB1/BFB2 采用每条引物1、1.2、1.5 μL 3个浓度梯度,共有T1~T99个处理(具体引物浓度见表3)。模板分别为Ⅰ组代表菌株pslb65、Ⅱ组代表菌株Aac5和两者等比例混合菌液,不同处理的PCR结果如图2所示。从PCR结果可以看出,T1、T2、T3处理均具有较好的扩增效果,考虑到T3处理(BFB/BFB1/BFB2 每条引物1 μL,BX-L1/BX-S-R2每条引物0.3 μL)引物的用量低,因此认为T3处理的引物浓度最为合适。
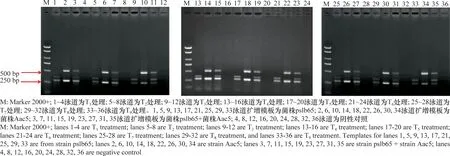
图2 多重PCR体系引物配比的优化结果Fig.2 Optimization of primers in the multiplex PCR assay
2.3 多重PCR体系特异性检测结果
使用该多重PCR体系对10株不同组的西瓜噬酸菌和11株其他植物病原细菌进行扩增,结果(图3)表明:测试的5株西瓜噬酸菌Ⅰ组菌株均出现2条特异条带,一条为西瓜噬酸菌的279 bp的特异性条带,另一条为Ⅰ组菌株特异条带(348 bp)。测试的5株西瓜噬酸菌Ⅱ组菌株均出现2条特异性条带,一条为西瓜噬酸菌的279 bp的特异性条带,另一条为Ⅱ组菌株特异条带(507 bp)。在3个近缘种中,3183扩增出1条348 bp的条带,而没有出现279 bp的西瓜噬酸菌特异条带,其他两个近缘种2826、7733均无扩增条带;8个其他属的植物病原菌也均未扩增到条带。试验结果说明该多重PCR能够特异性地扩增西瓜噬酸菌,同时实现种内亚组的区分。

图3 多重PCR对不同组西瓜噬酸菌的特异性扩增结果Fig.3 Specific amplification results of the multiplex PCR assay for different groups of Acidovorax citrulli
2.4 多重PCR的灵敏度检测结果
从图4可以看出,菌液模板浓度为105cfu/mL时,Ⅰ组和Ⅱ组菌株均有较清晰的扩增条带,在104cfu/mL时,果斑病特异条带仍然清晰可见,而分组的特异条带则较为模糊,综合两者,认为该多重PCR体系对于西瓜噬酸菌菌液分组的检测灵敏度为105cfu/mL。

图4 多重PCR对不同组西瓜噬酸菌菌株的灵敏度检测结果Fig.4 Sensitivity detection results of the multiple PCR assay for different groups of Acidovorax citrulli
2.5 种子带菌检测结果
带菌种子检测结果如图5所示,所有带菌的种子,无论是接种Ⅰ组代表菌株pslb65、Ⅱ组代表菌株Aac5,还是田间自然带菌种子,均有清晰的特异性扩增条带。pslb65菌液接种的甜瓜种子检测结果显示,均扩增出279 bp和348 bp两个条带;Aac5菌液接种的西瓜种子检测结果显示,均扩增出279 bp和507 bp两个条带;来自北京和吉林的两份自然带菌的西瓜种子的检测结果显示,均得到清晰的西瓜噬酸菌279 bp特异条带和Ⅱ组菌株的507 bp的特异条带,说明这2份自然带菌种子样品均为西瓜噬酸菌Ⅱ组菌株侵染。试验结果证实了该检测技术能够检测出单粒的人工接菌种子和田间自然带菌的种子,具有一定的应用潜力。
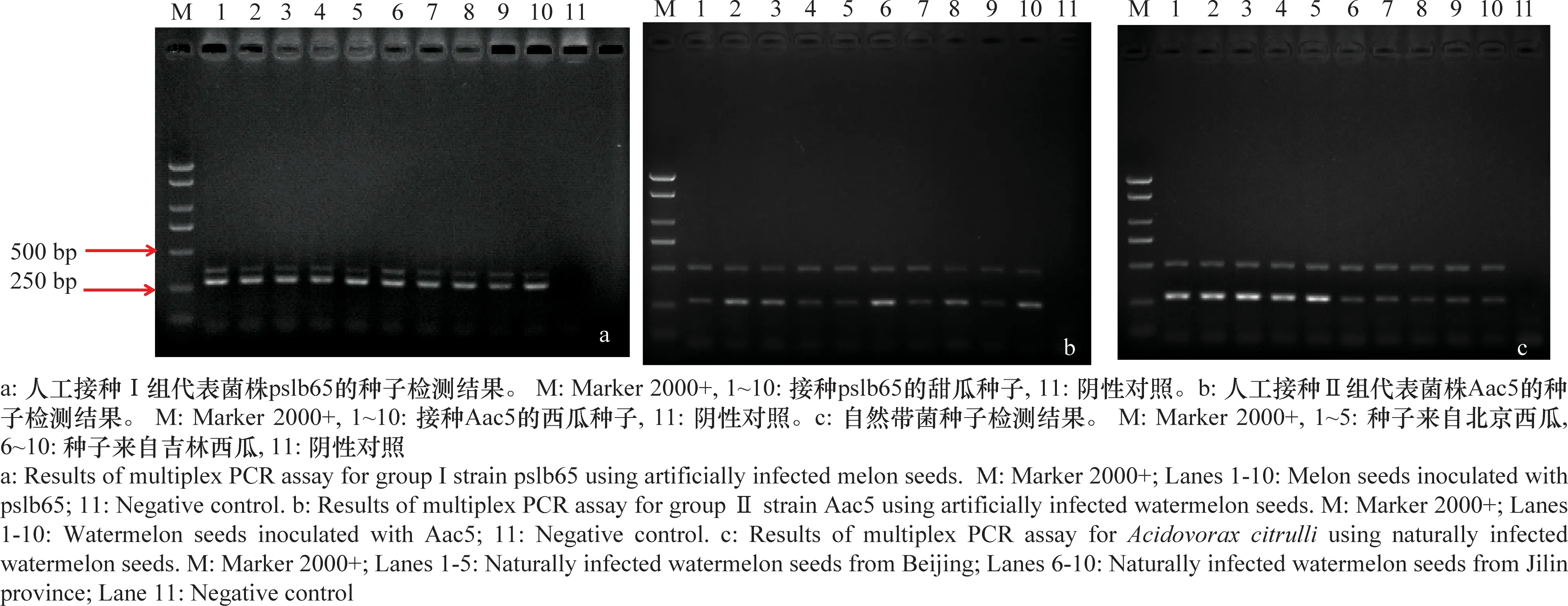
图5 多重PCR对携带不同组西瓜噬酸菌种子的检测结果Fig.5 Results of multiplex PCR assays for two groups of Acidovorax citrulli using bacteria-carrying seeds
2.6 西瓜、甜瓜病组织带菌检测结果
对采集自海南省和吉林省自然发病的甜瓜和西瓜叶片和果实的病组织研磨液直接检测,结果表明:采集自海南省甜瓜的叶片和果实均扩增出西瓜噬酸菌特异条带和Ⅰ组特异条带;采集自吉林省西瓜的叶片和果实均扩增出西瓜噬酸菌特异条带和Ⅱ组特异条带。pslb65和Aac5分别人工喷雾接种的甜瓜和西瓜叶片均能检测到各自的特异性条带(图6)。说明,该多重PCR体系能够在寄主感病组织中检测到西瓜噬酸菌,并准确分组。
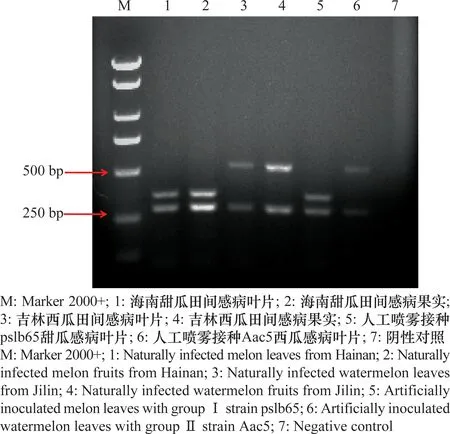
图6 多重PCR对甜瓜、西瓜感病叶片和果实中携带不同组西瓜噬酸菌的检测结果Fig.6 Results of multiplex PCR assays differentiating Acidovorax citrulli groups in infected fruit and leaf tissues of melon and watermelon
2.7 西瓜、甜瓜种苗带菌检测结果
甜瓜种子人工接菌之后,出苗后第3天开始出现水渍状病斑,第4天开始出现坏死病斑(图7)。多重PCR的检测结果显示:从出苗后第2天的甜瓜子叶研磨液中就可扩增出清晰的西瓜噬酸菌特异条带,出苗第3天的子叶中全部检出西瓜噬酸菌且均为Ⅰ组菌株(图9)。

图7 西瓜噬酸菌Ⅰ组菌株pslb65接种甜瓜种子出苗后的子叶症状Fig.7 Cotyledon symptoms of melon seedlings inoculated with Acidovorax citrulli group Ⅰ strain pslb65
西瓜种子人工接菌之后,出苗第4天开始出现水渍状病斑,第5天开始出现坏死病斑(图8)。多重PCR检测结果显示:从接种后第3天的子叶研磨液中可扩增出西瓜噬酸菌特异条带,出苗第4天的西瓜子叶中全部检出西瓜噬酸菌且均为Ⅱ组菌株(图9)。

图8 西瓜噬酸菌Ⅱ组菌株Aac5接种西瓜种子出苗后的子叶症状Fig.8 Cotyledon symptoms of watermelon seedlings inoculated with Acidovorax citrulli group Ⅱ strain Aac5

图9 带菌种子出苗后子叶多重PCR检测结果Fig.9 Results of multiplex PCR assays in sweet melon and watermelon cotyledons from contaminated seeds
3 讨论
瓜类细菌性果斑病是西瓜、甜瓜等葫芦科作物上最重要、危害最严重的病害之一,每年对我国的西瓜、甜瓜产业造成巨大的经济损失,同时影响着我国西瓜、甜瓜种业的健康发展。其病原菌西瓜噬酸菌是我国进境植物检疫性有害生物,快速准确的检测和分组是保证我国西瓜、甜瓜产业健康发展的重要技术措施。
目前,西瓜噬酸菌的分组检测报道较少,其中,Zhong等[19]利用基于pilL基因的特异引物,通过Ⅱ组菌株产生扩增条带,而Ⅰ组菌株无扩增来区分两组菌株。Zivanovic等[20]利用引物G2AcFwd/G12AcRev可从Ⅱ组菌株AAC00-1中扩增出291 bp的片段,利用引物G12AcFwd/G12AcRev可从Ⅰ组菌株M6和Ⅱ组菌株AAC00-1得到254 bp的片段,由于两个条带大小相近,很难区分。因此,这两组引物不适用于本研究拟建立的多重PCR体系来一步检测西瓜噬酸菌并准确分组。Yang等[21]筛选出BFB/BFB1/BFB2/BFB3引物组,建立了一个多重PCR体系,根据条带的大小差异,能够将西瓜噬酸菌分成3个组,具有很好的特异性和稳定性。在实际的检测应用中,本研究考虑到第3组菌株的数量非常少,且均为同一年分离自同一地区的不同地块,在实际生产中意义较小,同时考虑到多重PCR体系中引物之间的相互影响,为了保证多重PCR的稳定性和灵敏度,本研究只选取了Ⅰ组和Ⅱ组的特异性引物,而没有加入Ⅲ组特异性引物。BFB/BFB1/BFB2/BFB3引物组构建的多重PCR体系的缺陷是燕麦噬酸菌同Ⅰ组菌株一样也能产生348 bp的条带,从而不能与Ⅰ组菌株区分开来。为了弥补这一缺陷,本研究在西瓜噬酸菌特异性引物的选择中,首先考虑了能否很好地区分西瓜噬酸菌与燕麦噬酸菌等近缘种,同时考虑扩增条带的大小要与分组特异性引物的条带有一定的差异,使鉴定结果有较好的区分度。鉴于此,本研究选取了引物BX-L1/BX-S-R2[15],能够将西瓜噬酸菌及其近缘种很好地区分开来,且条带大小为279 bp,与Yang等[21]Ⅰ组特异条带的348 bp和Ⅱ组特异条带的507 bp有比较好的区分度。本研究为了实现带菌种子和田间感病组织的直接检测,在多重PCR建立和优化的过程中,扩增模板均为不同植物病原细菌纯培养的菌液,并没有进行预处理,这可能是造成检测灵敏度偏低的原因之一。
在测试样品的选择中,本研究分别选择了西瓜噬酸菌Ⅰ组和Ⅱ组菌株各5株,每组菌株均分离自西瓜和甜瓜两种寄主,区域来源于我国不同的省份,包括新疆、内蒙古、山东、海南、台湾、黑龙江、广东等省区,且Ⅰ组和Ⅱ组均有一株来自国外的菌株。3株西瓜噬酸菌的近缘种为燕麦噬酸菌、卡特莱兰噬酸菌和魔芋噬酸菌,还选择了包括假单胞菌、黄单胞菌等8个其他属的常见植物病原细菌。因此,样品的选择具有典型性和全面性。
瓜类细菌性果斑病为种传细菌性病害,种子种苗带菌是其最重要的初侵染源,种子种苗带菌与否对当年的产量有着至关重要的影响。因此,带菌种子种苗的快速准确检测对西瓜、甜瓜产业的健康发展尤为重要。该多重PCR体系能够直接从带菌种子浸泡液或寄主植物感病组织研磨液中检测到病原细菌,省略了细菌从种子或寄主组织中分离再纯培养的过程,有效地缩短2~3 d的检测时间。通过对人工接菌和自然带菌的单粒种子的检测,证实了多重PCR体系的特异性、准确性和稳定性,同时苗期检测试验结果表明,子叶不显症的时候就能够检测到病菌的存在,且准确分组,这将为病害的早期防控争得宝贵的时间。多重PCR检测体系的建立将为果斑病的快速诊断提供新的技术支撑。

