宁夏地区稗草种群对五氟磺草胺的抗性机制研究
于晓玥, 马洪文, 杨永杰, 张建萍, 陆永良*, 唐 伟*
(1. 中国水稻研究所,水稻生物学国家重点实验室, 杭州 310006; 2. 宁夏农林科学院农作物研究所, 银川 750105)
近年来,随着水稻轻减化和机械化种植的发展和农村劳动力缺失等问题的出现,杂草对水稻生产的危害也越来越严重。稗Echinochloacrus-galli是禾本科稗属杂草,是一种在全世界普遍发生的田间恶性杂草,严重影响水稻生产[1-2]。生产上主要通过化学除草剂来防治稗草,目前我国已经登记的用于防治稗草的除草剂主要有丁草胺、丙草胺、五氟磺草胺、双草醚、噁唑酰草胺、氰氟草酯、敌稗、二氯喹啉酸、噁草酮、嘧啶肟草醚等[3]。近年来杂草的抗药性问题日益严重,目前在水稻田中已经发现的抗药性杂草涉及的除草剂包括乙酰乳酸合酶(acetolactate synthase,ALS)抑制剂类除草剂,乙酰辅酶A羧化酶(acetyl co-enzyme A carboxylase, ACCase)抑制剂类除草剂和激素类除草剂[4]。
五氟磺草胺属于ALS抑制剂类除草剂,可以有效防除水稻田中稗草及部分阔叶类杂草及莎草[5]。ALS是植物体内支链氨基酸合成途径的关键酶,在黄素腺嘌呤二核苷酸(FAD),硫胺素焦磷酸(TPP),Mg2+等的作用下发挥催化活性。研究人员通过构建拟南芥ALS蛋白与五氟磺草胺的复合物晶体,发现五氟磺草胺与ALS酶的特定位点结合时,会激发ALS酶两个催化中心的氧原子,释放O2,使FAD被氧化,并且改变硫胺素焦磷酸的化学结构,导致ALS酶催化反应无法正常进行,造成植株死亡[6];当ALS酶与五氟磺草胺结合位点发生突变时,五氟磺草胺不能破坏ALS酶的催化反应,突变植株生长不受影响从而表现出抗药性。目前在杂草中已发现的ALS类除草剂的抗性突变位点有:Ala122、Pro197、Ala205、Asp376、Arg377、Trp574、Ser653和Gly654(根据拟南芥ALS蛋白的氨基酸编号)[7]。
近年来稗草的抗性问题越来越严重,2015年安徽发现了对五氟磺草胺和氰氟草酯产生抗性的稗草种群[8];2016年宁夏稻区发现了多个对五氟磺草胺表现中高抗性水平的稗草种群[9];2017年报道了辽宁和黑龙江地区的稗草对噁唑酰草胺产生抗性[10];2018年上海发现了对五氟磺草胺、氰氟草酯和二氯喹啉酸表现抗性的稗草种群[11];2020年广东发现对五氟磺草胺,双草醚和二氯喹啉酸表现抗性的稗草种群[12]。
宁夏是我国主要的水稻生产地,该地区水稻田的杂草防控主要依赖化学除草剂,近年来由于除草剂的单一使用,在多地发现了五氟磺草胺的抗性种群,但并未对抗性机理进行深入研究。宁夏稻区的稗草种类多为稗原变种或无芒稗[13],在前期研究中,我们测定了采自宁夏稻田的12个稗原变种E.crus-gallivar.crus-galli种群对五氟磺草胺的敏感性,有7个种群在田间推荐剂量下的鲜重防效达到95%以上,为敏感种群;有5个种群在5倍田间推荐剂量下的鲜重防效小于50%,为疑似抗性种群。本研究以这5个疑似抗性种群和1个敏感种群为研究对象,明确不同种群对五氟磺草胺的抗性水平并探索其抗性机制。
1 材料与方法
1.1 供试材料
本研究中所采用的稗草种群均为2015年在宁夏采集,于2016年在中国水稻研究所(30.04°N, 119.55°E)网室中用田间推荐剂量的五氟磺草胺处理后,保留存活的植株收种留用,编号及初始采集地信息如表1所示,其中N43为敏感种群,其余为疑似抗性种群。

表1 稗草样本采集地信息Table 1 Locations of collected Echinochloa crus-galli var. crus-galli populations
1.2 稗草对五氟磺草胺的抗性及马拉硫磷对其抗性水平的影响
采用整株生物测定法测定不同稗草种群对五氟磺草胺的抗性水平及马拉硫磷对其抗性的影响。将稗草种子置于铺有2层湿润滤纸的培养皿中,在昼夜温度为30℃/20℃,光周期L∥D=12 h∥12 h的培养箱中催芽2 d,将萌发的种子移植于高9 cm,直径11 cm的含土盆钵中,置于网室内培养,生长条件为白天(30±5)℃,夜间(15±5)℃,相对湿度为(80±5)%,光照约14 h。出苗后每盆保留3株长势相近的植株,待植株生长至3~4叶期喷施不同剂量的待测药剂,每个处理组包含5个重复。喷施仪器为3WP-2000型行走式喷雾塔(农业农村部南京农业机械化研究所),喷液压力为0.28 MPa,喷液量为450 L/hm2。
稗草对五氟磺草胺抗性测定:选用25 g/L五氟磺草胺可分散油悬浮剂(陶氏益农),施药剂量为0,1.875,3.75,7.5,15,30,60,120,240 g/hm2(有效成分剂量,下同),施药后14 d取稗草植株地上部分称重。
马拉硫磷对五氟磺草胺毒力的影响:预试验表明单独喷施1 000 g/hm2的马拉硫磷对稗草的生长没有显著影响。将1 000 g/hm2的马拉硫磷喷施在所有待测植株上,1 h后喷施不同剂量的五氟磺草胺,剂量设置同上,施药后14 d取稗草植株地上部分称重。
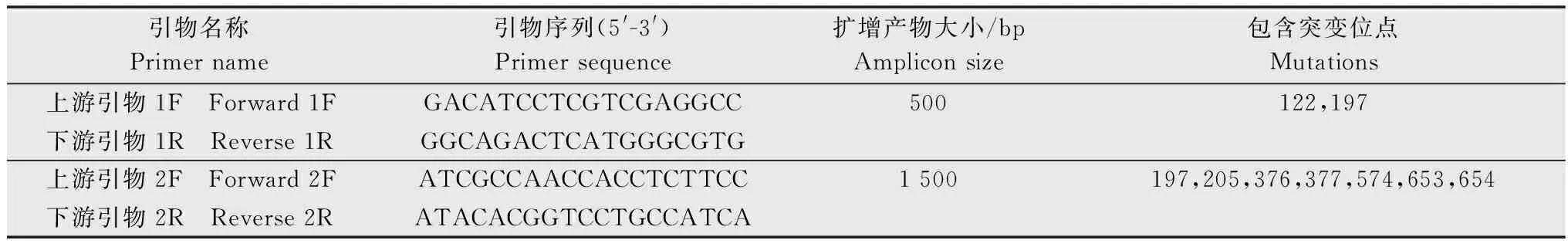
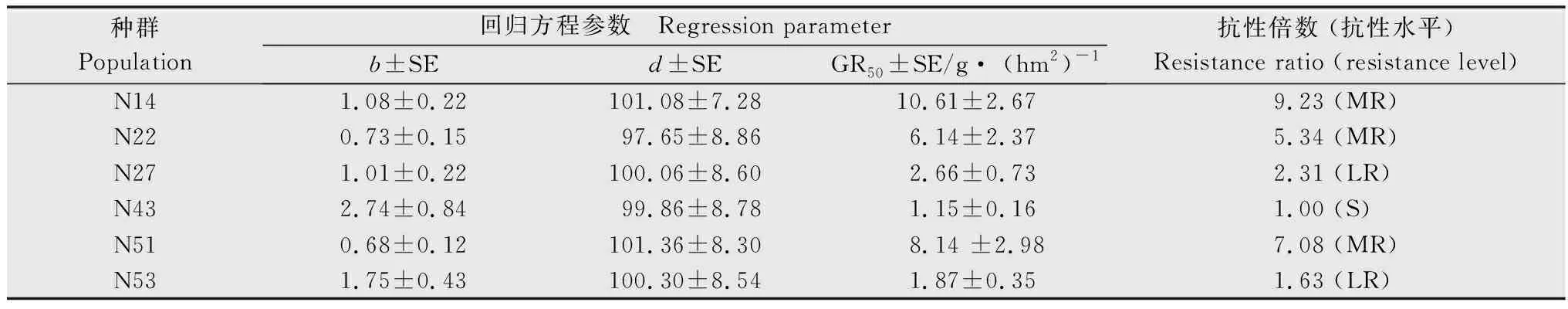
参考Chen等[14]的方法,采用R软件,根据非线性回归公式y=d/[1+(x/GR50)b]计算药剂对稗草种群的GR50,其中y为处理组稗草相对于对照组稗草鲜重的百分比,d为相对鲜重的上限,x为除草剂剂量,GR50为相对鲜重为50%时的除草剂剂量,b为斜率。以GR50最低的种群为敏感种群(S),根据其他种群与敏感种群GR50的比值(RI)判定抗性水平,RI≥10.0为高抗种群(HR),5.0 取3~4叶期的稗草叶片组织0.5 g,液氮速冻并研磨,按照新型植物基因组提取试剂盒(天根生化科技(北京)有限公司)的操作步骤提取基因组DNA,每个种群选取5个单株样本进行基因组提取。根据已经发表的稗草ALS基因(GenBank登录号 KY071206.1)序列设计能够包含所有已知突变位点的上下游引物,引物信息见表2。PCR反应体系如下:LaTaq(5 U/μL)0.5 μL,GC buffer 25 μL,dNTPs 8 μL,10 μmol/L上、下游引物各 1 μL,模板 1 μL,加水定容至50 μL。反应条件如下:95℃ 预变性 5 min;95℃变性 30 s,53℃ 退火30 s,72℃延伸 100 s,35个循环;72℃ 延伸10 min。PCR产物通过1%的琼脂糖凝胶电泳进行检测,将纯化后的PCR产物送杭州尚亚测序公司测序。根据测序结果的色谱图,对其中出现双峰的样本进行TA克隆测序。PCR产物经过纯化回收,将目的条带连接到pMD19-T载体,每个样本至少测定8个阳性转化子插入片段的DNA序列,测序结果使用BioEdit software 7.2.5软件进行序列比对。 表2 用于稗草ALS基因扩增的引物信息1)Table 2 Information of primers for amplification of ALS gene from Echinochloa crus-galli var. crus-galli 待测稗草种群生长至3~5叶期时,称取3 g新鲜叶片组织,液氮速冻保存,稗草种群ALS酶的提取方法与离体活性的测定参考Yu等的方法[15]。98%五氟磺草胺原药(Aladdin)溶于丙酮溶液中,配制成浓度为10 mol/L的母液,在200 μL的ALS粗酶液中加入100 μL的五氟磺草胺稀释溶液及400 μL的ALS酶反应液 (5 mmol/L氯化镁,100 mmol/L丙酮酸钠,1 mmol/L硫胺素焦磷酸,0.01 mmol/L黄素腺嘌呤二核苷酸的磷酸缓冲液,pH 7.5),五氟磺草胺的终浓度为0.01,0.1,1,10,102,103,104,105,106nmol/L,对照组为等体积的丙酮溶液,每个处理组和对照组包含3个重复,然后进行ALS酶的离体活性显色反应,反应结束后在525 nm 测定吸光度。以98%的3-羟基-2-丁酮标准品(Aladdin)为底物,建立3-羟基-2-丁酮的标准曲线[y=3.706 7x+0.004 3,R2=0.980 5,其中x为3-羟基-2-丁酮浓度 (nmol/L),y为吸光度];用考马斯亮蓝法测定粗酶液的蛋白浓度,计算得到不同处理条件下反应液中3-羟基-2-丁酮的含量(nmol/mg protein),以此计算对ALS酶的抑制中浓度(IC50),计算公式y=c+{ (d-c)/[1+(x/IC50)b]},其中y为处理组乙偶姻含量相对于对照组乙偶姻含量的百分比,c为相对含量的下限,d为相对含量的上限,b为斜率,x为五氟磺草胺浓度,IC50为3-羟基-2-丁酮相对含量为50%时的五氟磺草胺浓度。每个种群包含3个生物学重复。 采用整株生物测定法测定了五氟磺草胺对6个稗草种群的GR50,结果如表3所示。5个疑似抗性种群对五氟磺草胺均表现出不同水平的抗性,五氟磺草胺对种群N14,N22,N51,N53 的GR50相对于敏感种群(N43)的GR50(3.59 g/hm2)而言,已经达到高抗水平(抗性倍数10.18倍~32.71倍),种群N27相对于敏感种群为低抗水平(4.20倍)。 表3 五氟磺草胺对稗草种群的GR50及稗草的抗性水平1)Table 3 GR50 values of penoxsulam and resistance indices of Echinochloa crus-galli var. crus-galli populations to penoxsulam 利用PCR技术扩增6个种群的ALS基因,PCR产物的测序结果显示,稗草种群N14,N22,N27和N51的序列色谱图显示编码第574位氨基酸(根据拟南芥ALS蛋白序列编号)的密码子呈现双峰,存在TGG和TTG两种形式,即574位氨基酸存在色氨酸(Trp)和亮氨酸(Leu),为574位突变杂合子;种群N53的序列色谱图显示编码第197位氨基酸的密码子呈现双峰,存在CCC和CTC两种形式,即197位氨基酸存在脯氨酸(Pro)和亮氨酸(Leu),为197位突变杂合子。从每个种群中随机选择5个单株进行测序,结果显示同种群的5个单株突变类型一致,表明抗性种群的纯度较高。敏感种群N43的ALS基因在197位和574位氨基酸的密码子均为单峰,编码的氨基酸分别为Pro和Trp(图1)。进一步测定各样本ALS基因的亚克隆转化子,转化子中也存在突变和未突变两种序列,再次证实了上述ALS基因的突变。 图1 稗草种群ALS基因突变位置的序列色谱图Fig.1 Sequence chromatograms at the mutation sites of ALS gene in Echinochloa crus-galli var. crus-galli populations 我们测定了离体条件下ALS酶对五氟磺草胺的敏感性(表4),结果显示五氟磺草胺对抗性种群ALS酶的抑制程度均小于敏感种群,即抗性种群的IC50大于敏感种群N43,其中高抗种群N14,N22,N51,N53的ALS酶活性的IC50分别是敏感种群的4.20,4.92,3.48,3.88倍,低抗种群N27的ALS酶活性的IC50是敏感种群的2.22倍。这一结果说明抗性种群中的ALS基因突变导致ALS酶对五氟磺草胺的敏感性降低,进而引起种群对五氟磺草胺的抗性反应。 表4 稗草种群乙酰乳酸合酶(ALS)的离体活性1)Table 4 In vitro activity of ALS from Echinochloa crus-galli var. crus-galli populations 用P450抑制剂马拉硫磷和五氟磺草胺共同处理各稗草种群,结果表明在马拉硫磷作用下,五氟磺草胺对各种群的GR50相比单独喷施五氟磺草胺的GR50均有不同幅度的降低,其中,N14,N22,N51的抗性倍数下降到中抗水平(9.23,5.34,7.08倍),N53的抗性倍数下降到低抗水平(1.63倍),N27的抗性倍数也降低但依然维持在低抗水平(2.31倍),说明P450抑制剂马拉硫磷会提高抗性稗草种群对五氟磺草胺的敏感性。 表5 在马拉硫磷作用下五氟磺草胺对稗草种群的GR50及稗草的抗性水平Table 5 GR50 values of penoxsulam and resistance indices of Echinochloa crus-galli var. crus-galli populations to penoxsulam under the affect of malathion ALS抑制剂类除草剂的药剂种类丰富,使用范围广,但作用位点单一,在全世界多个国家均有抗药性问题的报道,经统计全世界范围内抗ALS类除草剂的杂草已超过160种,远远多于其他作用机制除草剂的抗性杂草种类数量[7]。在我国水稻田中常见的抗ALS除草剂的杂草包括久雨花Monochoriakorsakowii、野慈姑Sagittariatrifolia、鳢肠Ecliptaprostrata、稗草等[4]。五氟磺草胺是美国陶氏益农公司开发的三唑嘧啶类化合物,于2008年在我国登记,优势在于杀草谱广,且对水稻生长安全,因此被广泛应用于防治水稻田中的恶性杂草。近年来稗草对五氟磺草胺的抗药性在我国多个地区均有报道,马洪文等在宁夏地区采集了21份稗草种群,通过种子催芽法测定其对五氟磺草胺的抗性水平,结果发现有12个种群对五氟磺草胺产生不同程度的抗性,这说明宁夏地区的稗草对五氟磺草胺的确存在较高的抗性水平[9],但对其抗性机制并未进行深入研究。在前期试验中,我们在宁夏多地采集到了多个稗草种群,用高剂量的五氟磺草胺筛选种群的抗性水平,结果发现有5个种群为疑似抗性种群。本文采用整株生物测定法测定了它们对五氟磺草胺的GR50,这种方法相比于种子催芽法能更真实准确地反映稗草在成株期对五氟磺草胺的抗性水平。结果表明,在5个疑似抗性稗草种群中,有4个为高抗种群,1个为低抗种群,最高抗性倍数达到32.71倍。 ALS抑制剂类除草剂根据化学结构可以分为5类:磺酰脲类、咪唑啉酮类、三唑嘧啶类、嘧啶水杨酸类、磺酰胺三唑啉酮类。以拟南芥的ALS蛋白(AtALS)为例,AtALS由4个亚基组成,每个亚基含有三个结构域:α-domain(氨基酸86-280)、β-domain(氨基酸281-451)、γ-domain(氨基酸463-639),以及一个C末端(648-668)[16]。由于不同化学结构的除草剂与ALS蛋白结合的氨基酸位点存在差异,导致ALS蛋白上不同位点的氨基酸突变造成的抗药性类型也存在差异。例如,Ala122和Ser653突变会对咪唑啉酮类除草剂产生抗性,而不会对磺酰脲类除草剂产生抗性;Pro197突变会对磺酰脲类除草剂产生抗性,而不易对咪唑啉酮类除草剂产生抗性;Trp574突变会产生对磺酰脲类和咪唑啉酮类除草剂的抗性[16-17]。此外,不同物种的ALS蛋白与同一除草剂结合的氨基酸位点也存在差异,研究人员分别构建了五氟磺草胺与酵母ALS蛋白(ScALS)和拟南芥ALS蛋白(AtALS)的晶体复合物,结果发现有部分氨基酸结合位点是保守的,如Phe206,Arg377,Met570,Val571,Trp574(根据拟南芥的氨基酸编号),但是有些氨基酸结合位点在两个蛋白中存在差异,如AtALS的Arg199,Met200和Ser653可以与五氟磺草胺结合,ScALS的这三个位点并不与五氟磺草胺结合[6]。不同的ALS基因突变位点在杂草中的发生频率也是不同的,例如Trp574Leu突变包含38种杂草,Pro197Ser突变包含27种杂草,Pro197Thr突变包含14种杂草。目前还没有研究证明稗草的ALS蛋白与五氟磺草胺的结合位点有哪些,迄今为止在稗草中已发现的ALS基因突变包括4个位点的5种突变形式:Ala122Thr,Ala122Gly,Ala205Val,Pro197Ser,Trp574Leu[18-22]。本研究中,分析5个抗性种群的ALS基因序列发现的突变位点为Pro197Ser和Trp574Leu,同时抗性种群的ALS酶在离体条件下也对五氟磺草胺的敏感性下降,进一步说明抗性种群靶标基因的突变导致靶标酶与五氟磺草胺的亲和力下降是导致抗药性产生的原因,这也是首次在宁夏地区发现靶基因突变的抗性稗草种群。值得注意的是,不同突变位点的稗草种群对五氟磺草胺的抗性水平存在差异,例如574位突变的N22的抗性倍数高于197位突变的N53,这可能由于不同位点与五氟磺草胺结合的亲和性不同所导致的;而相同突变位点的稗草种群对五氟磺草胺的抗性水平也存在差异,例如574位突变的N22,N14,N51为高抗种群,而同样574位突变的N27为低抗种群,这有可能是由于抗性种群代谢五氟磺草胺的能力存在差异,即非靶标抗性机制不同。 非靶标抗性的主要机制包括:细胞色素P450和谷胱甘肽转移酶GST介导的代谢解毒作用,以及细胞转运蛋白ABC介导的转运作用[23]。本研究中,在P450抑制剂马拉硫磷的作用下,5个种群对五氟磺草胺的抗性表现出不同程度的下降,说明P450酶系介导的代谢抗性也是引起稗草抗性的原因之一。值得注意的是,马拉硫磷对不同种群抗性水平的影响存在明显差异,在马拉硫磷的作用下,五氟磺草胺对N22和N53的 GR50与单独使用五氟磺草胺处理的GR50相比下降了约95%,而对N14,N27,N51的GR50只下降了79%~83%。马拉硫磷处理后五氟磺草胺对敏感种群N43的GR50也有一定程度的降低,降低了68%。说明稗草体内的P450酶系在介导五氟磺草胺的代谢方面的能力是不同的。P450酶系在植物体内包含大量基因,P450基因过量表达会导致杂草代谢除草剂的能力增加,例如,CYP81A12 和CYP81A21 在抗双草醚的稻稗Echinochloaphyllopogon中显著上调表达,这两个基因的过表达拟南芥突变体同样表现出对双草醚和五氟磺草胺较高的耐受性,证明这两个基因的确与除草剂的代谢抗性相关[24]。我们推测不同抗性稗草种群在五氟磺草胺刺激条件下,P450基因的表达量存在差异,或者诱导表达的P450基因数量及功能存在差异,所以导致P450酶系介导的代谢抗性存在差异。另一种推测是,在抗性稗草中GST酶系和ABC转运蛋白也发挥了代谢解毒作用,所以只是抑制P450酶并不能完全改变稗草对五氟磺草胺的抗性,这些推测还需要下一步的试验进行验证。1.3 稗草ALS基因的扩增与序列比对
1.4 稗草种群ALS酶离体活性测定
2 结果与分析
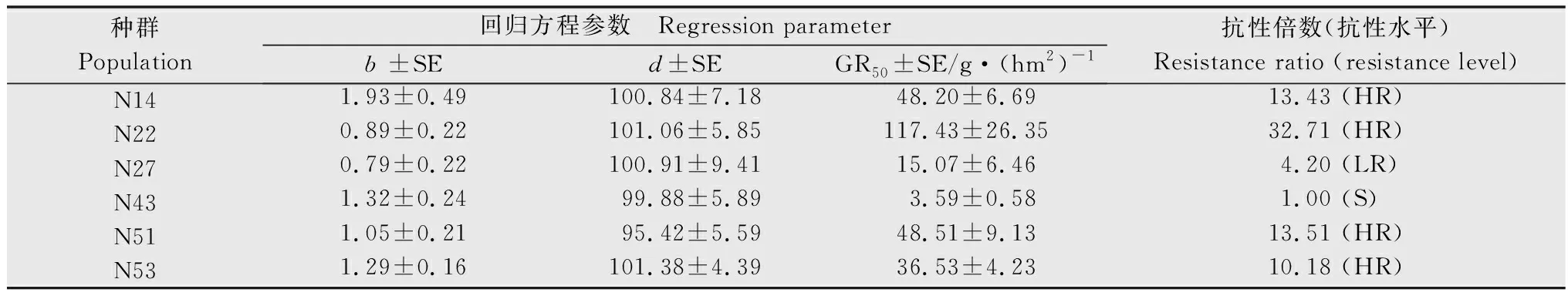
2.1 整株法测定稗草种群对五氟磺草胺的抗性倍数
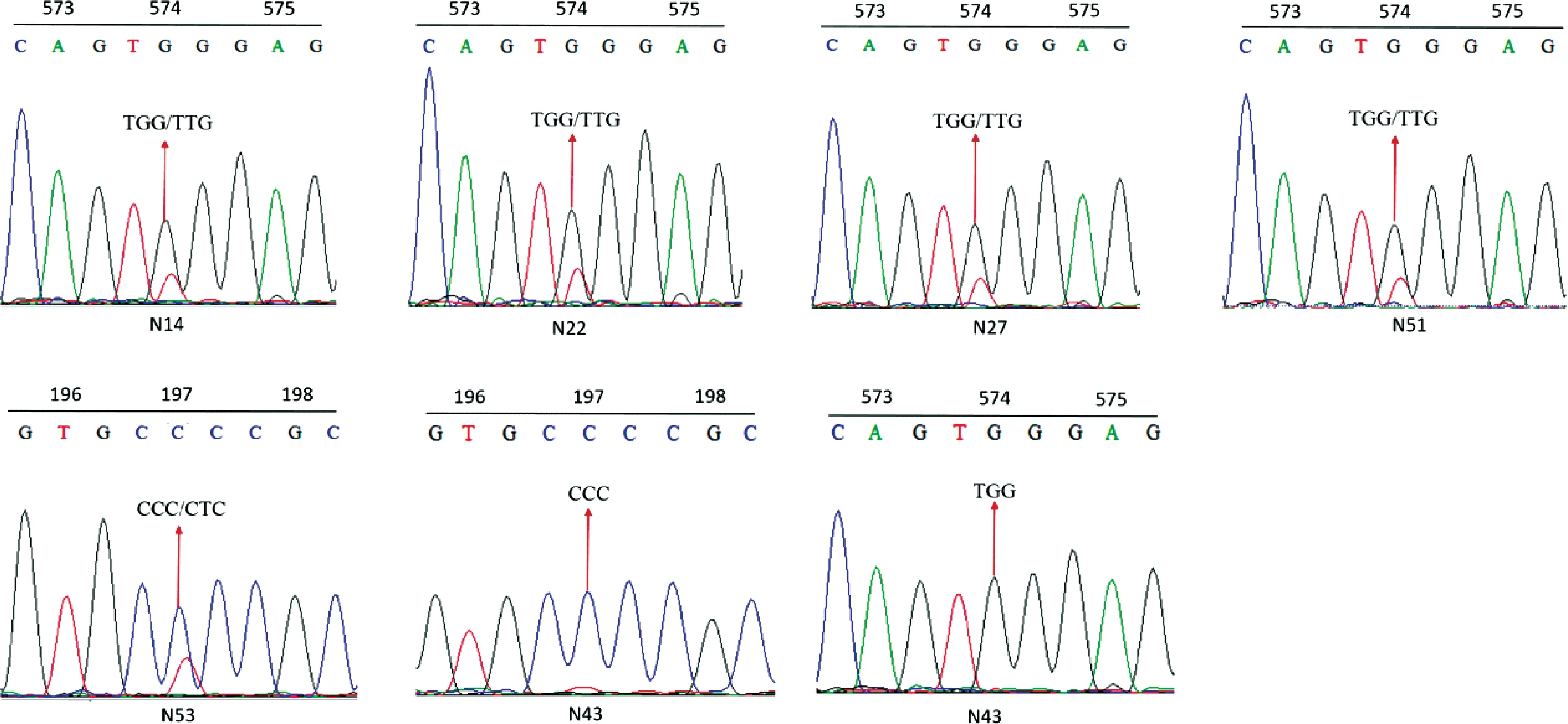
2.2 抗性种群的靶标基因ALS的克隆与序列分析
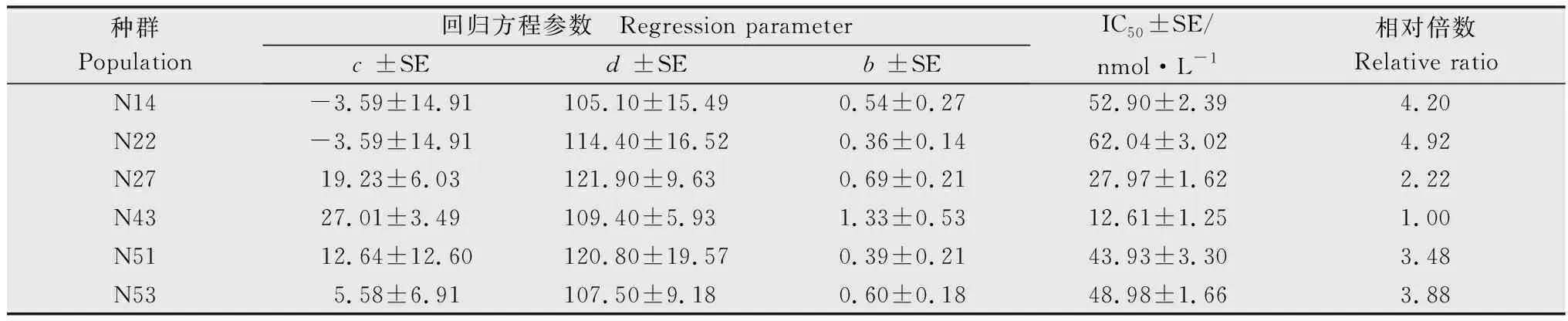
2.3 离体条件下五氟磺草胺对稗草种群ALS酶抑制程度的分析
2.4 马拉硫磷对稗草种群敏感性的影响
3 结论与讨论

