超灵敏检测血清中葡萄糖的中空介孔普鲁士蓝@葡萄糖氧化酶电化学发光传感器
仉华,申聪聪,陈粤华,樊思敏
(河南师范大学 化学化工学院,河南 新乡 453007)
葡萄糖作为生物体内能量的主要来源,对维持生命健康至关重要.近年来,糖尿病的发病率持续增加,作为一种常见的致死性慢性疾病可能引发尿毒症、高血压、心血管及并发症,严重影响患者的生命健康[1-3].血液中的葡萄糖含量即血糖,成为糖尿病检测的重要靶标,开发一种简单、快速、准确的葡萄糖检测方法有利于实现糖尿病的早期诊断.目前已报道的葡萄糖分析方法有比色法、分光光度法、化学发光法、电化学法、电化学发光法等[1-2,4-6],其中电化学发光技术(Electrochemiluminescence,ECL)集电化学传感和化学发光为一体,兼具高灵敏度、操作简单、响应时间快、成本低等优点,在临床检验诊断、食品安全检测和环境污染监测等领域具有广阔的应用前景.传统的电化学酶传感器是通过天然的葡萄糖氧化酶特异性,高效地催化氧化D-葡萄糖为D-葡萄糖酸内酯和H2O2,直接进行电化学检测或通过引入氧化还原介质进一步催化H2O2氧化生成活性氧级联放大电化学发光信号强度,从而实现对葡萄糖的高选择性、高灵敏度检测,使其成为葡萄糖酶传感器研究最广泛的生物酶之一[7-9].文献[10]将葡萄糖氧化酶和葡萄糖在溶液中混合直接产生H2O2增强鲁米诺的ECL性能,同时测定H2O2,葡萄糖及葡萄糖氧化酶的活性.该方法操作简单,应用广泛,然而生成的H2O2与电极反应界面距离远、易分解,限制了检测灵敏度的提高.通过引入载体固定生物酶不仅可以提高酶的负载效率,而且还能缩短酶催化反应在电极表面的电子传递距离.文献[11]合成具有ECL特性的CdS量子点负载葡萄糖氧化酶,使得H2O2在电极表面原位生成,有效增强了CdS的发光效率,但CdS的生物毒性限制了该方法在生物检测方面应用,同时生物酶需要适当的固定化手段来保证其高效的催化活性.随着纳米材料的进一步研究,科研工作者通过开发一系列纳米模拟酶催化葡萄糖分解来检测葡萄糖含量,如文献[12]设计合成了3D Cu-Flo.@AuNPs复合纳米材料构建无酶葡萄糖ECL传感器,该方法无须考虑酶活性因素,拓宽了测试条件,然而小颗粒的纳米材料易团聚制约了其催化的稳定性.因此,鉴于生物酶良好的催化活性和优异的选择性,设计高效、生物安全性好的酶固定化手段能够显著提高实际样品中葡萄糖的测定效率.
立方体结构的普鲁士蓝(Prussian Blue,PB)是由铁和亚铁氰化物组成的金属有机框架材料,能够作为氧化还原介质高效催化H2O2,被称为“人工过氧化物酶”,在光物理、生物医学和电化学等领域已得到了广泛应用.由于其具有良好的生物相容性于2010年被美国食品药品监督管理局(FDA)批准为铊的解毒剂[5,13].已有基于PB的过氧化物酶特性构建电化学葡萄糖酶传感器用于临床和环境分析的报道[14].为提高催化效率,常引入导电性好的碳纳米材料作为载体将PB固定在电极表面,如用PB纳米颗粒填充碳纳米管,在微碳纤维上垂直排列普鲁士蓝/碳纳米管复合物作为超灵敏检测葡萄糖的生物载体[15-18].以上方法虽然提高了葡萄糖的检测灵敏度,因其需要载体、氧化还原介质和GOx,构建过程相对复杂.已有文献报道HMPB纳米颗粒由于空隙多、比表面积大、生物相容性好等优势被用作肿瘤治疗剂的纳米载体,具有良好的载药量和治疗性能[13,19-21].HMPB优越的载体及过氧化物酶性质为设计双功能HMPB@GOx纳米复合材料,构建电化学发光传感器提供了思路.
本文通过模板法制备出80 nm左右的立方体PB纳米颗粒,控制盐酸刻蚀时间调控合成HMPB的中心空腔大小,并以此作为GOx的载体及H2O2氧化还原介质,以鲁米诺-H2O2电化学发光体系为基础构建电化学发光酶传感器级联放大电信号超灵敏检测葡萄糖.为了进一步增强电极的导电性及HMPB@GOx在电极表面的负载效率,本文通过电沉积技术将带正电的导电聚合物聚苯胺(PAA)镀在电极表面上一层,通过静电作用将HMPB@GOx修饰在电极表面构建电化学发光葡萄糖传感器.测试结果表明,基于HMPB@GOx构建的ECL传感体系在其他电活性物质如抗坏血酸(AA),多巴胺(DA)和尿酸(UA)共存时仍对葡萄糖具有良好的选择性,高的灵敏度和低的检出限,进一步实现了实际血清中葡萄糖含量的测定.因此,该HMPB@GOx电化学发光传感体系具有成为糖尿病患者血清中葡萄糖便携检测器件的潜力.
1 实验部分
1.1 材料制备
1.1.1PB及HMPB纳米颗粒的合成
PB的合成:称取6.0 g聚乙烯吡咯烷酮(PVP)和220 mg铁氰化钾(K3[Fe(CN)6]),加入到80 mL,0.010 mol/L的盐酸中混合搅匀,并在室温下搅拌0.5 h得到黄色的溶液.然后将混合溶液放入聚四氟乙烯反应釜中,在烘箱中80 ℃反应 24 h,自然冷却至室温.最后用一定量丙酮、二次水多次离心、洗涤,得到蓝色的PB纳米颗粒.
中空介孔普鲁士蓝(HMPB)的合成:在60 mL 1.0 mol/L 的HCl中加入300 mg 的PVP和60 mg 的PB纳米颗粒,将混合液密封在聚四氟乙烯反应釜中,140 ℃反应4 h.然后用水和乙醇多次离心、洗涤沉淀物,于真空干燥箱中过夜干燥,得到了HMPB.为验证空心程度对GOx负载效率及ECL信号强度的影响,本文控制刻蚀时间为0,1.0,2.0,4.5和8.0 h作为对照合成材料.
1.1.2HMPB@GOx的合成
将10 mg的GOx和1.0 mg的HMPB溶解在0.5 mL的PBS中,在4 ℃条件下震荡过夜.用二次水离心、洗涤多次以除去多余的GOx,重新分散在0.5 mL二次水中,制得HMPB@GOx复合物于4 ℃冰箱中备用.
1.2 材料表征
用日立SU8010场发射扫描电子显微镜(SEM)对PB的微观表面形貌进行表征;通过JEM-2100高分辨率透射电子显微镜(TEM)观察HMPB材料内部微观结构;利用Zeta电位及阻抗表征HMPB@GOx的复合材料及ECL传感体系的构建过程.
1.3 ECL传感器构建及电化学测试条件优化
1.3.1ECL传感器的构建
利用上海辰华电化学工作站CHI760E,在室温下采用标准的三电极体系(直径为3 mm的玻碳电极为工作电极,Ag/AgCl电极为参比电极,铂柱为对电极),在10 mmol/L的磷酸盐缓冲溶液(PBS)中进行电化学性能测定.
将用α-Al2O3打磨好玻碳电极浸入25 mmol/L的苯胺溶液(用0.5 mol/L H2SO4稀释),在-0.2~1.0 V的电压范围内扫描5圈,在电极表面制备出聚苯胺(PAA)导电薄膜.移液枪吸取7.5 μL上述制备好的HMPB@GOx复合纳米材料滴加在玻碳电极表面,室温下干燥备用.
1.3.2条件优化
电极表面PAA量的优化:将打磨干净的工作、参比和对电极浸没在苯胺溶液中,通过控制扫描圈数分别为1,2,5,10,15,30调控电极表面PAA的量.将电聚合PAA后的玻碳电极浸入含有50 μmol/L鲁米诺和6.7 μmol/L葡萄糖溶液中,设置光电倍增管高压为600 V,测定鲁米诺的电化学发光强度.
pH优化:配置pH分别为5.3,6.3,7.0,8.0,8.3,9.0的PBS缓冲液(5 mmol/L磷酸二氢钠,5 mmol/L磷酸氢二钠和100 mmol/L氯化钠),用于鲁米诺(0.01 mol/L)的稀释.将HMPB@GOx修饰好的电极置于含有50 μmol/L鲁米诺和6.7 μmol/L葡萄糖溶液中,设置光电倍增管高压,测定鲁米诺的电化学发光强度.
鲁米诺浓度优化:用PBS(pH 8.3)将鲁米诺分别稀释成10,25,40,50,75和100 μmol/L.将HMPB@GOx修饰好的电极置于鲁米诺和6.7 μmol/L葡萄糖溶液中,设置光电倍增管高压,测定鲁米诺的电化学发光强度.
GOx浓度优化:将1.0 mg的HMPB和1.0,5.0,10.0,15.0,20.0,30.0 mg的GOx溶解在1.0 mL的PBS中,按照以上步骤合成不同GOx负载量的HMPB@GOx复合物并修饰于电极表面.将修饰好的电极置于含有50 μmol/L鲁米诺和6.7 μmol/L葡萄糖溶液中,设置光电倍增管高压,测定鲁米诺的电化学发光强度.
PB刻蚀时间优化:将不同刻蚀时间的HMPB按照以上方法与GOx混合形成HMPB@GOx复合物并修饰于电极表面,设置光电倍增管高压,测定鲁米诺的电化学发光强度.
1.4 葡萄糖测定
按照以上最优条件,将HMPB@GOx复合物修饰好玻碳电极浸入含有不同浓度葡萄糖(依次为0,3.3×10-2,3.3×10-1,1.7,3.3,6.7,16.6,50.0,100.0和167.0 μmol/L)的鲁米诺溶液中,设置光电倍增管高压为600 V,测定鲁米诺的电化学发光强度.
1.5 选择性测定
按照以上最优条件,将HMPB@GOx复合物修饰好玻碳电极浸入pH 8.3的鲁米诺溶液中,连续滴加6.7 μmol/L的葡萄糖,抗坏血酸、尿酸或多巴胺,设置光电倍增管高压为600 V,测定鲁米诺的电化学发光强度.
1.6 实际样品测定
从新乡医学院第三附属医院取得全血3份,在4 ℃条件下3 000 r/min 离心15 min,取得上层淡黄色血清,分别将血清10倍,100倍,1 000倍,5 000倍和10 000倍稀释,用本方案构建的ECL传感器测定其葡萄糖含量.选取1 000倍稀释的血清为实际样品,用本方法构建的ECL传感器测定其葡萄糖含量并与血糖仪测定结果做对比.
2 结果与讨论
2.1 ECL传感器构建及机理探究
HMPB金属有机框架大的比表面积和过氧化物酶特性在葡萄糖、H2O2等生物分子检测领域发挥着重要作用.因此,本文基于HMPB@GOx复合物原位生成并迅速催化H2O2分解设计了一种ECL传感器用于葡萄糖的超灵敏检测.图1为HMPB@GOx复合物的合成及表征图.以K3[Fe(CN)6]和PVP为原料合成了立方体PB纳米颗粒,通过调控HCl刻蚀时间获得合适的中空介孔普鲁士蓝.然后将HMPB与葡萄糖氧化酶(GOx)混合过夜,形成HMPB@GOx复合纳米材料(图1(A)),并将该复合纳米材料通过静电吸附修饰在电聚合PAA的玻碳电极表面构建葡萄糖传感器.通过扫描电子显微镜(SEM),透射电子显微镜(TEM)对PB及HMPB的形貌及内部结构进行表征,从图1(B,C)可以看出,合成的PB是粒径为80 nm左右均匀的立方体,刻蚀后HMPB的棱角变得柔和且中间出现大的空腔结构,表明刻蚀成功.进而通过Zeta电位和电极表面阻抗谱的变化来探究HMPB@GOx复合物的形成及ECL传感器的构建过程,结果表明,带负电荷PB经过刻蚀,质子由于静电吸附残留在HMPB中使其所带负电荷急剧减少,当GOx与HMPB复合之后,所带的负电荷反而增加,这是由于带较多负电荷的GOx负载在HMPB的空腔及表面增加了复合物的Zeta电势(图1(D)),证明HMPB@GOx成功合成.提高导电性及酶在电极表面的固载效率是增强电化学传感器灵敏度的关键因素,本文通过测定工作电极表面的阻抗探究电化学传感器的构建过程,如图1(E)所示,相比干净的玻碳电极,电聚合PAA之后阻抗有所减小,当HMPB@GOx修饰在电极表面后阻抗显著增大(内插图为玻碳电极和聚合PAA后的放大图),这是由于导电聚合物PAA薄膜的引入加速了溶液中电荷在电极表面的聚集和电子的转移速率,而HMPB表面负载大量的生物分子GOx抑制了电子的快速转移,表明基于HMPB@GOx的葡萄糖电化学传感器构建成功.


2.2 条件优化
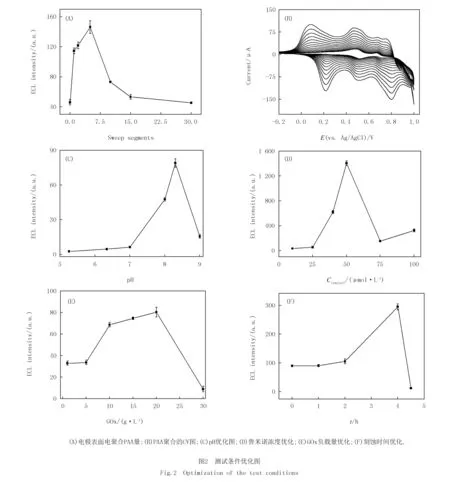
测试条件的优化对ECL传感器灵敏度、稳定性提高至关重要,本文主要从电聚合PAA量、电解液pH、发光试剂鲁米诺浓度、GOx在HMPB上的负载量和HMPB的刻蚀时间等方面进行测试条件优化.
2.2.1电聚合PAA量的优化
玻碳电极作为ECL传感器的反应基底,适当的改性能显著增强鲁米诺的ECL的发光强度.本文通过控制电聚合时间对电极表面PAA的量进行优化,如图2(A)所示,从0到5圈随着聚合时间的增加ECL强度逐渐增大,随后ECL强度迅速降低,这是由于PAA厚度过大使反应物与电极之间的距离变大减缓其电子转移速率,实验证明电聚合5圈PAA的电极对HMPB@GOx吸附量及导电性能最好.图2(B)为PAA电聚合过程的循环伏安图,第一次电位扫描时苯胺聚合的氧化峰电位出现在较低的0.80 V,该电位与铂电极和石墨烯电极(0.76 V)基本一致,在随后的循环中,此电位保持不变,但电流随循环次数的增加而增大.当电位反向扫描时,曲线上出现两个还原峰,其峰电流强度也随着扫描次数的增加而增大,这是由于电极表面生成聚苯胺量在增加,这两个还原峰是由生成的氧化掺杂态聚苯胺的还原而引起的.
2.2.2测试pH的优化
鲁米诺作为化学发光的主体,其ECL强度与电解液pH有关,为提高该ECL葡萄糖传感器的灵敏度,本文对电极修饰后测试pH进行优化.如图2(C)所示,pH在5.3~7.0范围内鲁米诺的电化学发光信号较弱,碱性环境下鲁米诺的电化学发光强度迅速增大,至pH为8.3时达到最大,之后ECL强度迅速降低,这是由于葡萄糖氧化酶在强碱性条件下会迅速失活,因此选择pH为8.3作为最优的测试条件.
2.2.3鲁米诺浓度的优化
鲁米诺作为电化学发光体,其浓度大小是决定其ECL强度最主要的因素.如图2(D)所示,增加鲁米诺浓度可增强ECL发光,当其浓度为50 μmol/L时,ECL信号强度最高,即该传感器灵敏度最大.这是由于在等量的共反应剂条件下,高浓度的鲁米诺会发生部分聚集,限制了其ECL的增强幅度.
2.2.4GOx负载量的优化
GOx作为葡萄糖的特异性催化剂,HMPB上的负载量的优化是提高电化学发光性能重点考察因素之一.图2(E)结果表明,随着GOx质量浓度增大,在HMPB表面上的负载效率增加,质量浓度为20 g/L时负载量适中,其催化性能最优,当GOx质量浓度继续增大,电极表面电子的传递速率降低,而且包裹在内部的HMPB不能有效催化H2O2分解使得ECL强度迅速降低.
2.2.5HMPB刻蚀时间优化
HMPB比表面积的优化是提高GOx负载量的关键,本文通过调控HCl对PB的刻蚀时间来控制HMPB空腔大小.图2(F)结果表明,随着刻蚀时间的增加HMPB的空腔逐渐增大,对GOx的负载量增多,能够有效增强鲁米诺的ECL强度,4.0 h为最佳.当刻蚀时间达到4.5 h时,HMPB的产率和ECL强度均迅速降低,表明部分PB被刻蚀完全,HMPB的立方结构出现残缺导致负载的GOx的泄露.当刻蚀时间为8.0 h时,PB被刻蚀完全,无法形成HMPB.
2.3 葡萄糖测定
在上述最优条件下,该HMPB@GOx传感器对葡萄糖进行了定量测定.如图3所示,ECL强度随着葡萄糖浓度增加逐渐增强,仅在4 s达到最大,且ECL强度在葡萄糖浓度为3.3×10-2~167.0 μmol/L范围成良好的线性关系,线性相关系数R2达到0.99,检出限为2.1×10-2μmol/L(LOD=3S/N),这与以往报道的葡萄糖检测体系相比,表现出较高的灵敏度和较低的检测限(表1).这是由于双功能的HMPB作为GOx的载体在不降低酶活性的前提下提高了GOx在电极表面的固载效率,同时催化原位生成的H2O2快速分解产生活性氧使得鲁米诺的电化学发光强度级联放大,从而实现对葡萄糖的超灵敏测定.

表1 葡萄糖检测方法与报道的ECL葡萄糖生物传感器分析性能比较
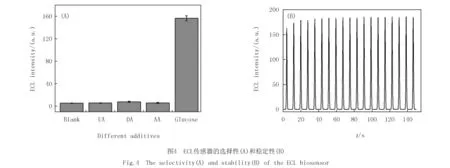
2.4 选择性和稳定性研究
生物体液中存在多种电化学活性的物质,如抗坏血酸(AA)、尿酸(UA)和多巴胺(DA)等,这些物质在葡萄糖检测过程中会成为重要的干扰因素.因此,良好的葡萄糖选择性是血糖检测非常重要的指标.如图4(A)所示,加入6.7 μmol/L的 AA,DA,UA后,该传感器的ECL强度几乎不发生变化,当加入6.7 μmol/L葡萄糖后,传感器的ECL强度显著增加,结果表明,AA,DA,UA对葡萄糖检测的影响可忽略不计,该传感器具有良好的抗干扰能力.同时,考察了该ECL传感器的稳定性,在6.7 μmol/L的葡萄糖溶液中经过19次循环,ECL强度仍保持在95%以上,且相对标准偏差为2.74%(图4(B)),表明传感器具有较好的稳定性及抗干扰能力.
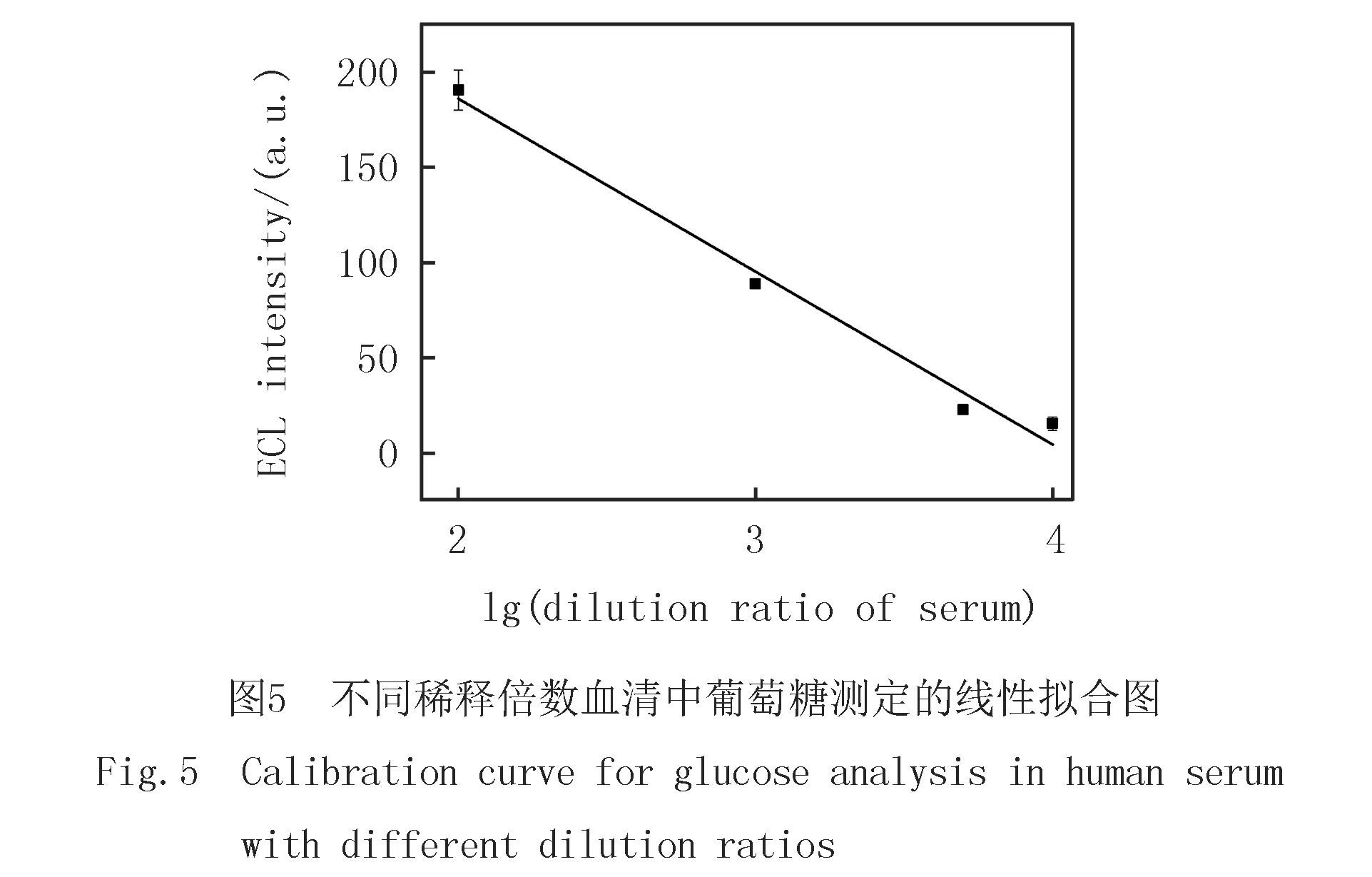
2.5 实际样品测定
为评价该传感器在实际样品中的检测能力,分别将正常人的血清用PBS缓冲溶液(pH=8.3)10倍,100倍,1 000倍,5 000倍和10 000倍稀释后检测葡萄糖含量.如图5所示,ECL强度与血清稀释倍数在100~10 000倍范围内呈线性关系,线性相关性系数R2=0.97,说明本文构建的传感器对血清中的葡萄糖检测非常灵敏.实际工作中,选取1 000倍稀释的血清作为实际样品进行测试(表2),结果与临床结果基本吻合,表明基于HMPB@GOx构建的ECL传感器具有临床检测的应用潜力.
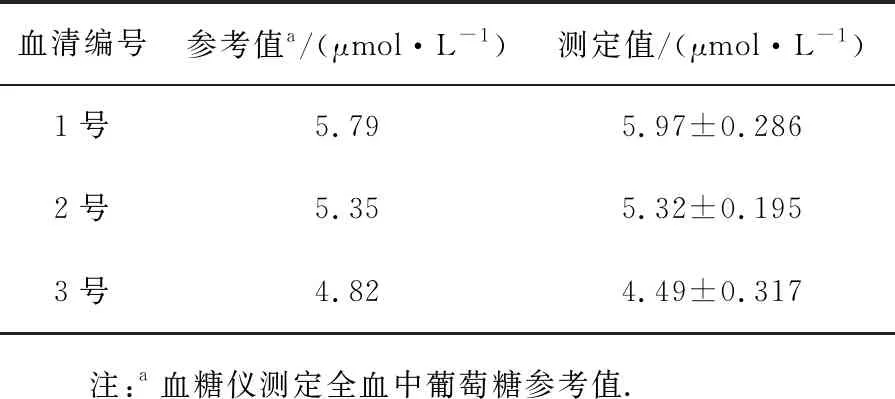
表2 1 000倍稀释血清中葡萄糖测定

3 结 论
本文通过简单的水热-刻蚀法合成了一种立方结构的中空介孔HMPB纳米颗粒,控制刻蚀时间调控其空腔及比表面积,负载大量的GOx制备出HMPB@GOx纳米复合物,进而结合经典的鲁米诺-H2O2电化学发光体系构建超灵敏葡萄糖传感器.电化学测试结果表明该ECL传感体系对葡萄糖的检测范围为3.3×10-2~167.0 μmol/L,检测限低至2.1×10-2μmol/L,成功检测实际血清中的葡萄糖含量.而且该传感体系在其他电活性物质如抗坏血酸(AA),多巴胺(DA)和尿酸(UA)共存时仍对葡萄糖具有良好的选择性和稳定性.这些优异特性主要归因于具有良好生物相容性的HMPB作为载体大量负载高活性的GOx催化葡萄糖氧化在电极表面原位生成H2O2,进而作为H2O2的模拟酶迅速催化H2O2分解产生活性氧,级联增强鲁米诺的电化学发光强度.本研究拓宽了酶及纳米材料在H2O2,葡萄糖检测中的应用,该传感器检测速度快、构造简单、灵敏度高,具有开发糖尿病患者血清中葡萄糖便携检测器件的潜力.