加酶挤压对小麦淀粉结构和理化性质的影响
陈彩雯,李丹丹, ,陶 阳,谢广杰,2,韩永斌,
(1.南京农业大学食品科技学院,江苏南京 210095;2.镇江市智农食品有限公司,江苏镇江 212000)
在我国,小麦是仅次于稻谷的第二大谷物,小麦粉是食品工业的重要原料。小麦粉中淀粉含量为70%~80%左右,是淀粉最重要的来源之一。为了满足不同食品对小麦粉加工工艺性能的不同需要,减少加工助剂和食品添加剂的使用,通常采用淀粉改性的方式提高小麦粉的加工特性[1]。淀粉改性是指利用物理、化学和生物方法作用于天然的淀粉颗粒,从而改变其结构和功能特性[2]。物理法利用水、热等破坏淀粉结构;化学法利用化学试剂改变淀粉官能团;生物法则利用各类淀粉酶作用于淀粉分子链[3]。其中预糊化淀粉是一种物理变性淀粉,具有冷水可溶性、高黏度、高膨胀性、易成膜性、抗老化性等特点[4]。添加预糊化淀粉可以改善谷物的蒸煮特性、提高烘培食品的松软性和速冻食品的冻融稳定性以及防止淀粉基食品老化并延长其货架期等[5]。
目前,预糊化淀粉的生产工艺有:滚筒干燥法、挤压膨化法、喷雾干燥法、脉冲喷气法和微波法等[6]。其中,挤压膨化技术由于其成本低、能耗低和方便快捷等特点在食品、化工等领域有着较为广泛的应用[7−8]。Franklyn 等[9]发现挤压处理可提高藜麦等杂粮产品的理化及营养特性。Tobias 等[10]利用挤压技术改性聚乳酸及其与丙烯腈-丁二烯-苯乙烯的熔融共混,改善了材料的断裂行为等。
然而,经挤压膨化的糊粉类食品存在冲调分散性差等缺陷。加酶挤压技术是一种将高温短时挤压与酶催化作用相结合的新型挤压技术。目前,加酶挤压技术在食品领域被用于改善淀粉[11−12]、蛋白[13]、纤维素[14]等物质的特性,其中应用于淀粉方面显示出能够抑制回生[15]、降低冷糊黏度[16]、改善后续的糖化和发酵[17]、提高谷物粉水溶性、降低冲调黏度等优点。例如,马永轩等[18]利用高温α-淀粉酶-挤压膨化耦合处理糙米粉发现其糊化度、吸水指数、分散时间、结块率、冲调黏度均呈下降的趋势。刘磊等[19]利用预酶解-挤压膨化工艺改善了玉米全粉冲调分散性,提高了其食用品质。Li 等[20]的研究表明高温α-淀粉酶增加了挤出面条的多孔结构,使其再水化和适口性得到改善。但是,目前的研究侧重于关注加酶挤压对产品品质的影响,其中的机理尚需进一步探究。淀粉作为小麦、米粉以及杂粮等的主要成分,其在加酶挤压过程中结构和理化性质的变化规律尚待探究。基于此,本文以小麦淀粉为原料,应用挤压-淀粉酶复合改性的方法,研究加酶挤出物的超微结构、热力学特性、糊化特性等,从而为加酶挤压技术在淀粉基食品领域的应用提供科学依据。
1 材料与方法
1.1 材料与仪器
小麦淀粉(淀粉含量98%以上) 海安海益食品有限公司;高温α-淀粉酶(酶活力≥10000 U)、DNS试剂 上海源叶生物有限公司;柠檬酸钠、盐酸、氢氧化钠等常规试剂 国药集团化学试剂有限公司;所有试剂均为分析纯。
DSE-20 型双螺杆挤压机 德国Brabender 公司;DHG-9030A 电热鼓风干燥箱 上海一恒科学仪器有限公司;EVO-LS10 扫描电子显微镜 德国卡尔·蔡司股份有限公司;D2 PHASER X-射线衍射仪美国Bruker 仪器公司;Q20 差示扫描量热仪 美国TA 仪器公司;RVA 4500 快速粘度分析仪 澳大利亚Perten 公司;GL-20G-H 高速离心机 上海安亭科学仪器厂。
1.2 实验方法
1.2.1 加酶挤压处理 小麦淀粉与0.1%、0.2%、0.5%、1%、2%的α-淀粉酶混匀后,调整水分含量45%,过夜平衡12 h。设置六个加热模块的挤压温度分别为40、60、60、70、90、90 ℃,进料速度20 g/min,螺杆转速150 r/min。挤出物40 ℃烘48 h 后,粉碎过100目筛,备用。未经处理的小麦淀粉为对照组(CK),实验组为挤压淀粉样品(extrusion starch sample,ESS)以及0.1%、0.2%、0.5%、1%、2%加酶挤压淀粉样品(enzyme extrusion starch sample,EESS)。
1.2.2 堆积密度的测定 测定堆积密度(bulk density,BD)能够反映挤压后淀粉的膨胀程度,测定方法参考赵淑娜等[21]的研究方法。称取约10 g 样品于50 mL 的量筒中,在水平台上来回平移至颗粒间没有较大空隙,缓慢倒入二甲基硅油至50 mL 处,再将二甲基硅油倒入另一量筒中,计算公式如下:

式中:m 为试样质量,g;V1为试样与二甲基硅油的总体积,mL;V2为二甲基硅油的体积,mL。
1.2.3 糊化度的测定 采用酶水解法测定糊化度(gelatinization degree,GE),参考赵淑娜等[21]的测定方法。用天平分别称取两份1 g 样品置于锥形瓶中,再各加入50 mL 水。取其中一份沸水加热30 min,使其充分糊化后,迅速冷却至20 °C,以此为标准,将其糊化度定为100%。另一组为实验组,不做糊化处理。向两组样品中分别加入5 mL 淀粉酶溶液,放入37℃的恒温振荡水浴锅中保持120 min 后,加2 mL 2 mol/L HCl 停止酶解作用。加2 mL 2 mol/L NaOH中和pH 后,转移至100 mL 容量瓶中,加水定容,过滤。用DNS 法测定过滤后上清液的还原糖含量,实验组还原糖含量占标准组还原糖含量的百分比即糊化度,计算公式如下:
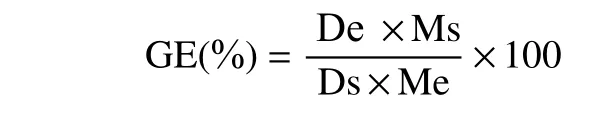
式中:Ds、De 分别表示标准组、实验组的还原糖含量,mg/mL;Ms、Me 分别表示标准组、实验组的样品质量,g。
1.2.4 吸水性指数和水溶性指数的测定 淀粉的吸水指数(water absorption index,WAI)是挤压后挤出物吸收水分的程度,反映在一定范围内淀粉的糊化能力。淀粉的水溶性指数(water solubility index,WSI)反映淀粉降解程度,取决于可溶性物质的数量。参考赵淑娜等[21]的测定方法。称取1 g 样品于已恒重的离心管中,加入12 mL、pH3.5 的柠檬酸钠缓冲液,混合均匀以灭活耐高温淀粉酶,置于30 ℃水浴振摇30 min 后,放入离心机中7500 r/min 离心5 min,将上清液倒入已恒重的铝盒中,在105 ℃下烘干4 h至恒重。WAI 和WSI 的计算公式如下:

式中:m 为试样重量,g;m1为沉淀物与离心管恒重重量,g;m2为可溶物与铝盒恒重重量,g;ma为离心管重量,g;mb为铝盒重量,g;mc为12 mL 柠檬酸钠缓冲液烘干后恒重重量,g。
1.2.5 扫描电镜观察 利用扫描电镜(scanning electron microscopy,SEM)能够很好地反映样品表面状态,参考Li 等[22]的方法。将烘干粉碎后的挤出物粉末用牙签均匀分散在双面导电胶上,吹去不牢固粉末,真空状态下喷金,在放大1000 倍、5000 倍状态下观察颗粒表面状态。
1.2.6 X-射线衍射分析 利用X-射线衍射仪(X-ray diffractometer,XRD)分析淀粉的半结晶结构,参考Li 等[22]的方法。样品放入盛有饱和食盐水的平衡器中平衡水分7 d,利用XRD 对样品半结晶结构进行分析。X-射线为Cu Kα射线(波长λ=0.028nm),扫描速度4°/min,测量范围(2θ)4~40°,功率1600 W,管压40 kV,管流40 mA。使用MDI-Jade 6.0 软件,分析图谱结晶晶型,计算相对结晶度(relative crystallinity,Rc),计算公式如下:

式中:Ac为结晶区含量;Aa为无定形区含量。
1.2.7 差示扫描量热分析 通过差示扫描量热仪(differential scanning calorimeter,DSC)测量加酶挤出物的热力学特性,测定方法参考Li 等[23]的报道。用分析天平称取3 mg 样品于铝坩埚中,加入6 μL去离子水将样品压片制样后,4 ℃条件下平衡12 h。分析条件为:扫描速率10 ℃/min,扫描范围25~100 ℃,氮气流速20 mL/min。以空皿为空白组。
1.2.8 快速粘度分析 利用快速粘度分析仪(rapid visco analyzer,RVA)测定加酶挤出物的糊化特性。参考GB/T 24853-2010 的测定方法[24],分析天平加酶挤出物3 g 于专用样品盒中,加入25 mL 去离子水混合均匀,启动标准程序1。
1.3 数据处理
所有实验均设置三组重复以减小偶然误差,实验结果表示为平均值±误差值。图片绘制使用软件Origin 2021b。数据差异性分析使用SPSS 21.0 软件,通过方差分析表征数据误差,选择LSD 法分析,置信水平为0.95(P<0.05)。
2 结果与分析
2.1 加酶挤压处理对小麦淀粉堆积密度和糊化度的影响
糊化度是指淀粉中糊化淀粉与全部淀粉量之比的百分数。表1 反映了不同处理小麦淀粉的糊化度,除了对照组的糊化度明显较低(24.74%)外,其它处理之间没有明显差异(95.31%~99.38%),趋于完全糊化。这是由于挤压过程中会产生高压、高温和高剪切力能比较完全地破坏淀粉颗粒的完整性,从而淀粉分子溶胀分裂、原有结晶结构中结晶区的支链分子与直链分子之间的连接被破坏。Kuo 等[25]在研究挤压发酵用糙米时也有相同的结果,糊化度达到95%以上。堆积密度能够反映挤压后淀粉的膨胀程度。从表1 的数据还可以看出,挤压和加酶挤压对小麦淀粉的堆积密度没有显著影响(P>0.05),变化区间为0.31~0.34,该结果说明挤压或加酶挤压可能对小麦粉的空间空隙影响不大。
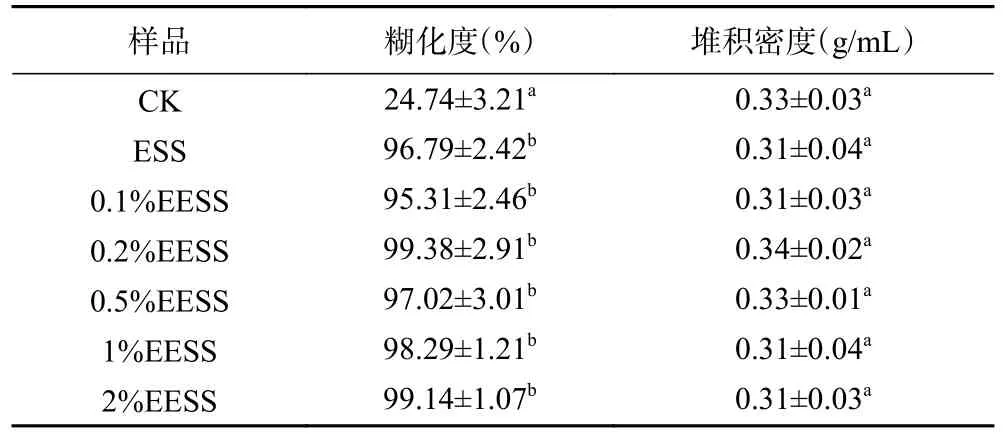
表1 不同处理条件下小麦淀粉糊化度和堆积密度Table 1 Degree of gelatinization and bulk density of wheat starch under different treatment conditions
2.2 加酶挤压处理对小麦淀粉水合特性的影响
淀粉的结晶结构和分子成分影响淀粉对水的吸收能力及其水溶性程度。吸水性指数反映的是样品中不溶性成分的吸水能力;水溶性指数反映的是样品中可溶性成分的数量,即样品的水解情况[26]。从图1的WAI 曲线可知,EESS 的WAI 与原淀粉差异不明显,但随着加酶量的增加,EESS 的WAI 值逐渐下降,该结果说明随着加酶量的增加,样品中具有糊化能力的成分越来越少。但值得注意的是,ESS 的WAI远远大于原淀粉和EESS,增加了2~3 倍。徐恩波[27]也报道挤压淀粉的吸水性指数远大于原淀粉和加酶挤压淀粉的吸水性指数,造成这种情况的原因可能是淀粉在膨化重组后形成持水力较强的淀粉碳骨架或局部组织,使得吸水性指数增大,而淀粉酶的加入影响了这种碳骨架的形成,因此吸水性指数又降低。对于WSI 曲线,整个曲线随挤压、加酶量的增大呈上升趋势,说明样品中的可溶性成分越来越多。这是因为加入耐高温α-淀粉酶后,淀粉分子被降解,与挤压工艺耦合后,淀粉微晶束大量解体,氢键断裂、小分子糖类溶出,更易与水分子结合,水溶性指数升高。谢天等[28]也发现挤压后玉米淀粉的水溶性指数远高于原淀粉。此外,从WAI 和WSI 两条曲线可以明显看出,ESS 和0.1%EESS 之间的差异大于其它处理组间,说明在挤压工艺中加入适量的酶能够明显降低样品吸水性和提高其水溶性。

图1 不同处理条件小麦淀粉的吸水性指数和水溶性指数Fig.1 Water absorption index and water solubility index of wheat strach under different treatment conditions
2.3 加酶挤压处理对小麦淀粉微观结构的影响
扫描电镜图片能够直观地反映出不同加酶挤压处理后的淀粉微观结构。图2 为原淀粉、ESS、EESS在1000×和5000×扫描电镜下的图片。原小麦淀粉图片准确反映出了小麦淀粉粒的特点,表面光滑,双峰粒径分布,大团粒圆盘形,小团粒球形,与Punia等[29]的报道一致。经过挤压处理后淀粉的团粒结构被完全破坏,团聚成较大的不规则淀粉块,且淀粉块表面还有明显的孔洞。ESS 的淀粉块变大,这是因为被破坏的淀粉分子粘连成大于原淀粉颗粒的大块状;而EESS 随着加酶量的增大淀粉块开始裂解,淀粉块的大小越来越小,表面孔洞越来越多且呈现出许多不规则的凸起,这是由于酶的作用使淀粉分解,淀粉结构被完全破坏。马成业等[30]利用加酶挤压技术处理玉米淀粉颗粒也有相似的发现,不加酶挤压淀粉汇聚成团,加酶挤压淀粉团聚情况明显改善,颗粒呈多角。总之,EESS 的微观结构显示出加酶挤压能更大程度破坏淀粉颗粒结构,具有更优越的加工性能,改善糊粉类产品的冲调性。

图2 不同处理后小麦淀粉的扫描电镜图Fig.2 SEM images of wheat starch under different treatment conditions
2.4 加酶挤压处理对小麦淀粉结晶结构的影响
自然界的淀粉晶体结构可分为A 型、B 型、C 型三种,而经某些物理化学的人工处理后还可得到V 型淀粉结构[31−32]。A 型为单斜晶体结构,主要是谷类淀粉,在15°、17°、18°、23°有较强衍射峰;B 型晶体为六方晶体,主要是块茎类淀粉,在5.6°、17°、18°、22°、24°有较强衍射峰;C 型晶体是同时含有A 型和B 型晶体,在5.6°、17°、18°、23°有较强衍射峰;而V 型晶体主要是螺旋直链淀粉配合物即直链淀粉与脂肪等的混合物,在8°、12°、19°、22°有较强的衍射峰[33]。由图3 可以看出该样品在15°、23°左右有明显的单衍射峰、在17°、18°左右有突出的双衍射峰,是典型的A 型结晶结构,与谷类淀粉为A 型结晶结构的结论相符,挤压和加酶挤压处理未改变淀粉晶型。Wu 等[34]和Chen 等[35]报道超声波辅助酶解后,淀粉的结晶类型也未发生变化。

图3 不同处理后小麦淀粉的XRD 衍射曲线Fig.3 XRD curves of wheat starch under different treatment conditions
利用Jade 软件计算样品的结晶度,结果如表2所示。挤压和加酶挤压淀粉的相对结晶度均小于原淀粉。随着加酶量从0.1%到0.5%,淀粉相对结晶度的变化不大,均在14%左右;而当加酶量为1%和2%时,相对结晶度降至10%左右,说明此时淀粉的晶体结构被大大破坏。与原淀粉以及EESS 相比,ESS 的相对结晶度最小,仅为4.15%,说明单纯的挤压处理比加酶挤压处理对淀粉的结晶结构破坏的更加彻底。于双双等[36]运用XRD 分析相对结晶度时也有相同的发现,加酶挤压样品结晶度反而高于挤压样品,其猜测为形成了具有更高热稳定性结晶结构的淀粉-脂类复合物等物质。Zhao 等[37]的研究表明可能是由于酶作用于淀粉的无定形区,无定形区的优先分解导致结晶区比例增加,相对结晶度增大。吴文琪[38]认为加酶后的淀粉由于产生了小分子等在挤压机中呈现“半液体”的状态,对比挤压淀粉其受到的剪切力更小,因此结晶结构保持的更好。此外,也有报道表明水解淀粉的分子链可能发生重新排列,从而导致淀粉相对结晶度的增加[39]。为了探明本文中加酶挤压导致淀粉相对结晶度变化的原因,后续将结合淀粉的糊化特性结果进一步分析。
2.5 加酶挤压对小麦淀粉热性质的影响
DSC 结果能够反映淀粉颗粒的热稳定性。表2为不同处理后小麦淀粉热性质的相关参数,包含起始温度T0、峰值温度Tp、终止温度Tc、糊化焓ΔH;图4为相应的DSC 曲线。与原淀粉相比,ESS 的T0、Tp、Tc均有不同程度地增大,表现为吸热峰右移。例如,ESS 的T0从原淀粉的57.35 ℃增加到了73.78 ℃。但是,ESS 的焓值远低于原淀粉(7.89 J/g),仅为0.24 J/g。这是由于挤压过程中产生的高温、高压和高剪切力作用破坏了大多数易糊化淀粉的颗粒和结晶结构,仅剩余少部分难糊化的、热稳定性较好的淀粉颗粒。方浩标等[40]研究挤压膨化对紫糙米粉糊化性质的影响时也发现,DSC 曲线上挤压糙米粉的糊化焓较小且糊化温度升高至80 ℃左右。
在挤压过程中引入α-淀粉酶将会对淀粉的结构和糊化性质造成影响。由图4 和表2 可知,与原淀粉相比,EESS 的糊化温度显著增加而糊化焓值大大降低。根据方浩标等[40]的报道,该现象是由挤压过程中剩余的难糊化淀粉导致的。然而,表1 结果表明ESS 和EESS 的糊化度相差不明显,表2 结果却显示与ESS 相比,EESS 糊化焓显著增加至1.50~2.59 J/g。这说明EESS 的DSC 曲线上的吸热峰与ESS 的形成原因不一致。更可能地,这是由于α-淀粉酶的引入可能会加速挤压过程中小麦淀粉的水解,导致其链结构与ESS 样品存在差异,酶解得到的淀粉分子链更易重新有序排列形成热稳定性较强的新的晶体结构,该结构的稳定性比原淀粉更强。糊化焓的变化结果与XRD 的相对结晶度结果一致,也有研究表明淀粉的糊化转变温度与双螺旋结构有关[41]。
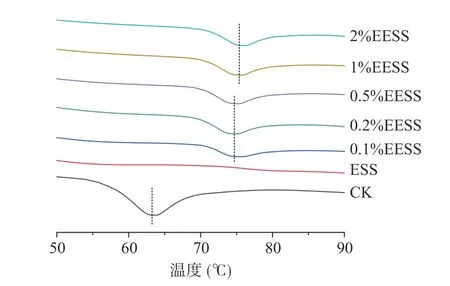
图4 不同处理后小麦淀粉的DSC 曲线Fig.4 DSC curves of wheat starch under different treatment conditions

表2 不同处理后小麦淀粉热性质参数Table 2 Thermal parameters of wheat starch under different treatment conditions
2.6 加酶挤压处理对小麦淀粉糊化特性的影响
RVA 结果可以反映不同处理后淀粉的糊化特性。表3 为RVA 的相关糊化特性参数,包括峰值粘度、谷值粘度、最终粘度、崩解值、回生值和糊化温度。图5 为对应的原淀粉、ESS、EESS 的RVA 曲线。由图5 和表3 可知,ESS 和EESS 的峰值、谷值、最终粘度、崩解值和回生值都大幅度低于原淀粉,随着挤压处理和加酶量从0%增加到2%,峰值粘度从2505 cP 逐渐降低到0,谷值粘度从2218 cP降低到0,最终粘度从2628.5 cP 降低到0,崩解值从287 cP 降低到16 cP,回生值从410.5 cP 降低到3.5 cP,且基本呈现出不同加酶量EESS 之间无显著差异(P>0.05)而与ESS 和CK 有显著差异(P<0.05)。这是由于挤压使淀粉分子结构被破坏,糊化度增大,粘度减小;而酶的作用使无定形区的直链分子也被水解,破坏程度更高,糊化峰几乎不可见。同时,由于分子链的破坏,支链与直链之间作用力降低,回生值降低,淀粉不易回生老化[42−43]。
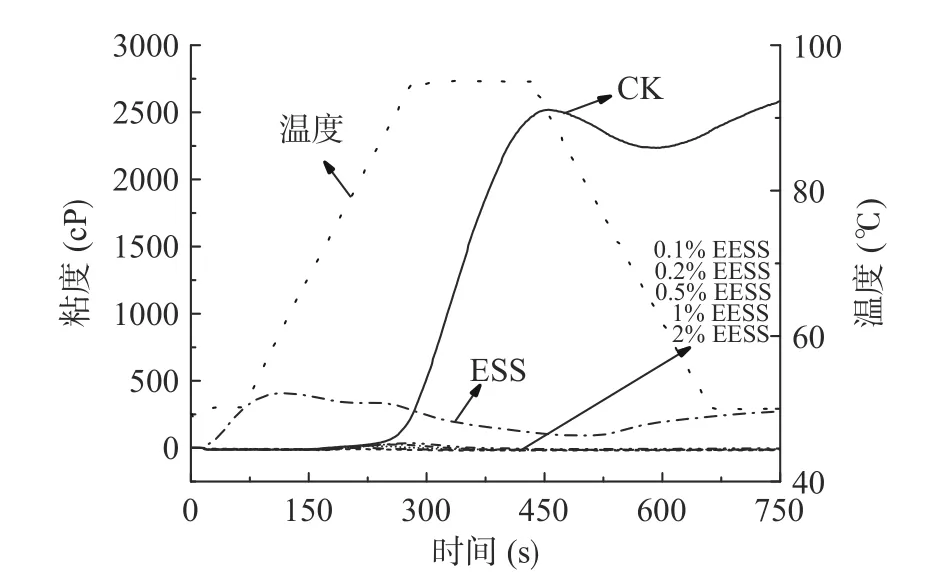
图5 不同处理后小麦淀粉的RVA 粘度曲线Fig.5 RVA curves of wheat starch under different treatment conditions

表3 不同处理后小麦淀粉糊化特性参数Table 3 Characteristics and parameters of wheat starch gelatinization after different treatments
在达到峰值之前,淀粉分子开始膨胀破裂,粘度开始上升的温度称为糊化温度。加酶挤压的粘度值几乎为零,其糊化温度数据不准确,而对比原淀粉糊化温度69.05 ℃,ESS 糊化温度大幅度下降至49.9 ℃。这是由于挤压后小麦淀粉基本完全糊化了,表1 可知挤压小麦淀粉的糊化度达96.79%。此时的糊化温度与DSC 测得的糊化温度呈现完全相反的变化趋势。这是由于DSC 峰是由挤压过程中未被糊化的、热稳定性高的淀粉吸热产生的,而RVA 测定的是绝大多数淀粉的糊化温度,该部分淀粉经挤压处理后其原有的颗粒和结晶结构已被完全破坏(图2),热稳定性降低。
3 结论
加酶挤压可显著影响小麦淀粉的结构和理化性质,且与加酶量有关。加酶挤压处理后的淀粉,与原淀粉相比,堆积密度无显著差异(P>0.05),吸水指数与加酶量呈负相关,水合指数与加酶量呈正相关,接近完全糊化;与挤压淀粉相比,吸水指数显著下降,水合指数显著上升(P<0.05)。SEM 结果表明,挤压后淀粉的颗粒结构被完全破坏并粘连成大块状,而随着加酶量增大,淀粉颗粒粒径逐渐减小。XRD 结果表明,挤压和加酶挤压不会改变淀粉的结晶晶型,挤压淀粉的相对结晶度最低,仅为4.15%;加酶挤压淀粉的相对结晶度大于挤压淀粉,且随着加酶量增大逐渐下降(14.42%~10.29%)。DSC 结果表明,挤压淀粉的糊化焓显著下降(P<0.05),焓值最低,仅为0.24 J/g;加酶挤压淀粉的焓值高于挤压淀粉,随着加酶量的增加,淀粉的焓值上升至2.5 J/g 左右。RVA 的结果则表明,淀粉的峰值粘度、谷值粘度、最终粘度、崩解值和回生值、糊化温度经挤压后显著降低(P<0.05),且加酶挤压淀粉的粘度峰几乎不可见,粘度为0。总的来说,与原淀粉、挤压淀粉相比,加酶挤压对淀粉的微观结构和理化性质都有明显改变,液化降解作用增强,微观颗粒变小,因此生产中可添加适量的酶预酶解淀粉后,进行挤压膨化生产变性淀粉,改善产品冲调性和糊化特性。

