桑黄素抑制巨噬细胞氧化应激反应的体外研究※
于 婧 冯丹丹 赵 靖 潘文森△
(1.河北医科大学第二医院呼吸与危重症医学二科,河北 石家庄 050000;2.河北医科大学基础医学院生物化学与分子生物学研究室,河北 石家庄 050017)
急性肺损伤(acute lung injury,ALI)通常可由多种疾病触发,包括休克、败血症、肺炎、胰腺炎、输血、药物过量、严重创伤和外科手术等,是临床常见的危重症疾病之一。ALI这一名词虽然至今未在中医学中有所记载,但关于ALI的症状已在多部中医古籍中描述。如《素问·咳论》载 “肺咳之状,咳而喘息有音,甚则唾血”,又如《灵枢·五阅五使》载“故肺病者,喘息鼻张”,《灵枢·本脏》“肺高则上气,肩息咳”。同时,有学者将ALI症状总结为“喘”“昏”“满”“热”四证[1]。现代医学认为,ALI患者可能出现胸痛、胸闷、气短,严重时会出现咯血、呼吸窘迫、呼吸衰竭、嗜睡甚至昏迷等症状。对于ALI的治疗,尽管目前呼吸支持及重症监护患者管理技术的发展取得了进步,但死亡率仍然高达40%以上[2]。近年来,随着人们对中医药治疗ALI的不断探索,发现单味中药或者复方制剂在清热解毒、通腑泻肺、活血化瘀、益气扶正等多方面对ALI的治疗取得一定疗效[3]。桑黄素(Morin)(2',3,4',5,7-五羟基黄酮)是从多种植物中分离得到的天然活性物质,属于黄酮类化合物。已有大量研究表明,Morin具有抗炎、抗氧化及抗凋亡等多种特性[4-5],且有证据表明氧化应激(oxidative stress)是参与ALI病理进展的关键事件之一[6-7]。
本研究通过使用脂多糖(LPS)诱导体外培养的RAW 264.7巨噬细胞极化,模仿LPS诱导的ALI发生时巨噬细胞的变化,旨在观察Morin对LPS诱导的巨噬细胞氧化应激反应的影响,为寻找ALI有效治疗方法提供新思路。
1 材料与方法
1.1 材料
1.1.1 细胞 小鼠巨噬细胞RAW 264.7(Procell CL-0190),购自武汉普诺赛生命科技有限公司;RAW 264.7细胞株,培养于含有青霉素、链霉素及10%胎牛血清的DMEM培养基中,待细胞融合达80%时,吸走部分培养基,然后用无菌细胞刮将细胞刮落,吹打后接种到新的装有新鲜培养液的培养瓶中。放置于37 ℃、含5%二氧化碳(CO2)的细胞培养箱中继续培养。
1.1.2 试剂 Morin、脂多糖(lipopolysaccharide,LPS)、二甲基亚砜(methyl sulfoxide,DMSO)、细胞裂解液和四唑盐(MTT),均购自美国Sigma公司,货号分别为M4008、L2880、D2650、R0278和M2003;还原型辅酶Ⅱ(NADPH)氧化酶1(NADPH oxidase 1, NOX1)抗体、NADPH氧化酶4(NADPH oxidase 4, NOX4)抗体、核因子2相关因子2(Nuclear factor erythroid 2-related factor 2, Nrf2)抗体、血红素加氧酶1(heme oxygenase-1,HO-1)抗体和β-actin抗体,均购自武汉三鹰生物技术有限公司,货号分别为17772-1-AP、14347-1-AP、16396-1-AP、10701-1-AP和66009-1-Ig;Total RNA提取试剂盒(美国OMEGA公司,货号R6934);反转录试剂盒(美国ThermoFisher公司,货号K1622);SYBR Green Master Mix(美国Invitrogen公司,货号A25778);台盼蓝(美国Invitrogen公司,货号T10282)。
1.1.3 仪器 NanoDrop 2000超微量分光光度计(美国Thermo公司);实时荧光定量聚合酶链式反应(qRT-PCR)仪(美国Bio-Rad公司);电泳仪及电泳槽(美国Bio-Rad公司);电化学发光仪(法国Vilber Lourmat公司);全自动酶标仪(美国Molecular Devices公司);Countess自动细胞计数仪(美国Invitrogen公司)。
1.2 方法
1.2.1 细胞分组和处理 预先使用12.5 μmol/L和25.0 μmol/L 2种浓度的Morin单独作用或与LPS(1 mg/L)共同处理巨噬细胞,发现对巨噬细胞活力均未造成影响,实验中我们选用25.0 μmol/L作为Morin的处理浓度。巨噬细胞RAW 264.7分为DMSO组(DMSO)、LPS组(LPS 1 mg/L)、Morin组(Morin 25.0 μmol/L)、LPS+Morin组(LPS 1 mg/L + Morin 25.0 μmol/L)。观察Morin对LPS诱导的巨噬细胞的作用。取对数生长期的巨噬细胞,计数后,按所需密度接种于6孔板或细胞培养皿中,待细胞长至密度约为80%~90%时,用Morin(25.0 μmol/L)预处理RAW 264.7细胞后,予LPS(1 mg/L)刺激24 h,收集细胞用于后续实验。
1.2.2 3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化四氮唑溴盐(MTT)比色法 按照1×104个/孔的细胞浓度将RAW 264.7细胞接种于96孔板上,待细胞充分贴壁后,按照实验设计予细胞刺激24 h。随后,将培养基更换为100 μL无血清DMEM,并加入MTT染色液10 μL,放回培养箱中避光37 ℃培养4 h。设置全自动酶标仪检测波长为490 nm,并放置细胞进行吸光度值检测。每个处理样品设置5个复孔,实验重复3次。
1.2.3 蛋白免疫印迹(western blot,WB)检测 收取各组细胞于离心管中,根据细胞数量加入合适剂量的蛋白裂解液,充分震荡后超声裂解细胞,提取细胞总蛋白,二辛可宁酸(bicinchoninicacid,BCA)法定量,加入上样缓冲液(稀释5倍)充分混匀后沸水浴5 min。10%分离胶十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)电泳分离蛋白,经转膜、牛奶封闭、一抗孵育4 ℃过夜、二抗孵育后进行化学发光。Image J图像处理系统分析条带灰度值。
1.2.4 实时荧光定量聚合酶链式反应(qRT-PCR)检测 将各组细胞收集于EP管中,根据细胞数量加入适量Trizol处理液,总RNA提取按照Total RNA提取试剂盒说明书的步骤进行。反转录后获得cDNA。加入引物和荧光PCR染料法混合物SYBR mix配置RT-PCR反应体系,每组样本设置3个副孔,反应条件为95 ℃,30 s;95 ℃,5 s;60 ℃,30 s,循环39次。引物由生工生物工程(上海)股份有限公司设计并合成,各基因引物序列见表1。
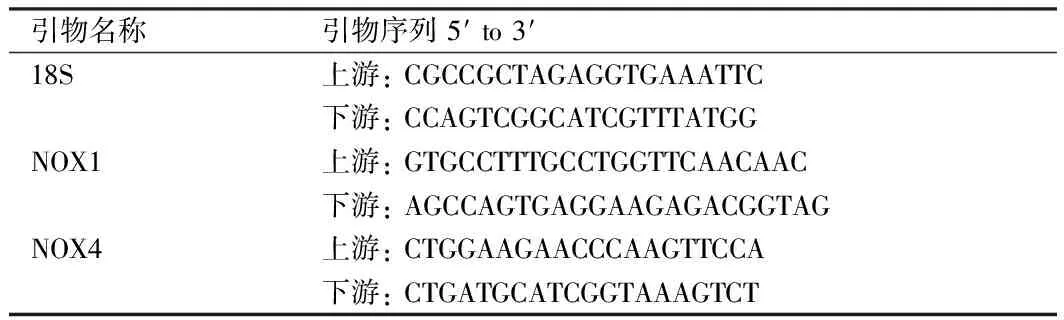
表1 各基因引物序列

2 结果
2.1 Morin对巨噬细胞活力影响 Morin在12.5 μmol/L和25.0 μmol/L 浓度剂量下,单独作用或与LPS(1 mg/L)共同处理巨噬细胞24 h,均未对巨噬细胞活力造成显著影响(P>0.05)。后续实验中选用25.0 μmol/L作为Morin的处理浓度。MTT比色法检测不同处理对巨噬细胞活力影响见图1。

图1 MTT比色法检测不同处理对巨噬细胞活力的影响
2.2 Morin对LPS刺激下巨噬细胞NOX1 mRNA、NOX4 mRNA表达水平影响 与DMSO组比较,LPS处理组巨噬细胞中NOX1 mRNA和NOX4 mRNA水平较DMSO处理显著上调(P<0.05,P<0.01),单独予Morin处理对巨噬细胞中NOX1 mRNA和NOX4 mRNA水平影响无统计学意义(P>0.05)。与LPS处理组比较,Morin给药组巨噬细胞中NOX1 mRNA和NOX4 mRNA水平显著降低(P<0.05)。各组巨噬细胞中NOX1 mRNA和NOX4 mRNA表达情况见图2。
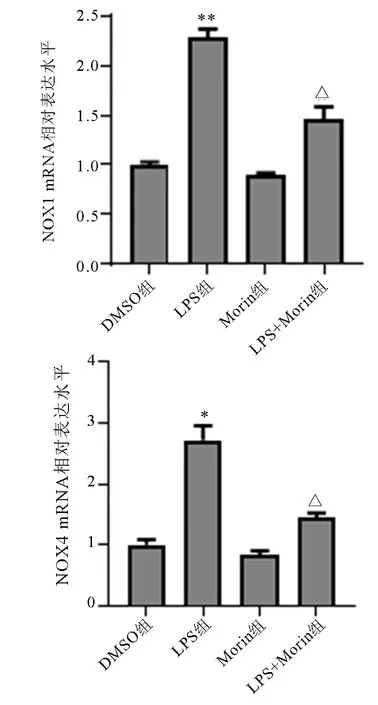
与DMSO组比较,*P<0.05,**P<0.01;与LPS组比较,△P<0.05
2.3 Morin对LPS刺激下巨噬细胞NOX1和NOX4蛋白表达水平的影响 与DMSO组比较,LPS组巨噬细胞中NOX1和NOX4蛋白水平显著上调(P<0.01),单独予Morin处理对巨噬细胞中NOX1和NOX4 蛋白水平影响无统计学意义(P>0.05)。与LPS组比较,Morin组巨噬细胞中NOX1和NOX4的蛋白水平显著降低(P<0.01)。各组巨噬细胞中NOX1和NOX4蛋白表达情况见图3。
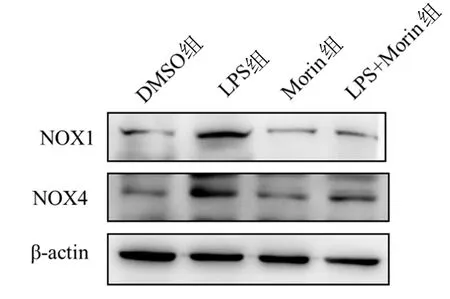
与DMSO组比较,**P<0.01;与LPS组比较,△△P<0.01
2.4 Morin对LPS刺激下巨噬细胞中Nrf2/HO-1信号通路的影响 与DMSO组比较,LPS处理或Morin处理后巨噬细胞中抗氧化应激指标Nrf2和HO-1蛋白水平显著增加(P<0.01,P<0.001)。与LPS处理组比较,LPS+Morin处理组Nrf2和HO-1的蛋白表达水平进一步增加(P<0.01)。各组巨噬细胞中Nrf2和HO-1的蛋白表达情况见图4。
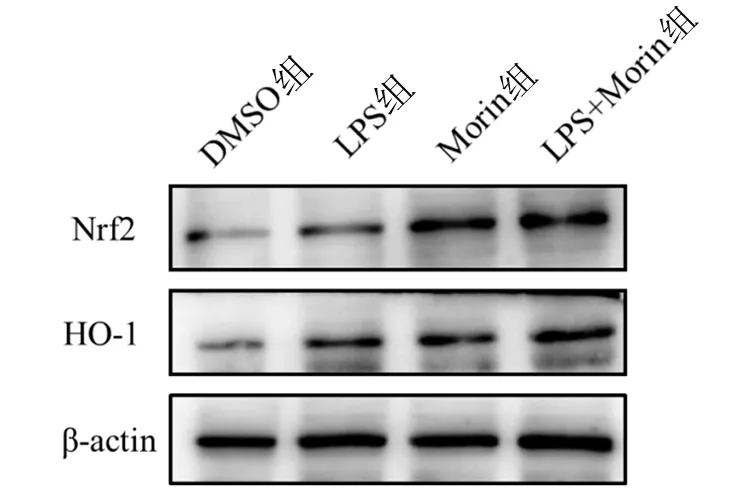
与DMSO组比较,**P<0.01,***P<0.001;与LPS组比较,△△P<0.01
2.5 Morin缓解LPS诱导的巨噬细胞氧化应激的示意图 见图5。
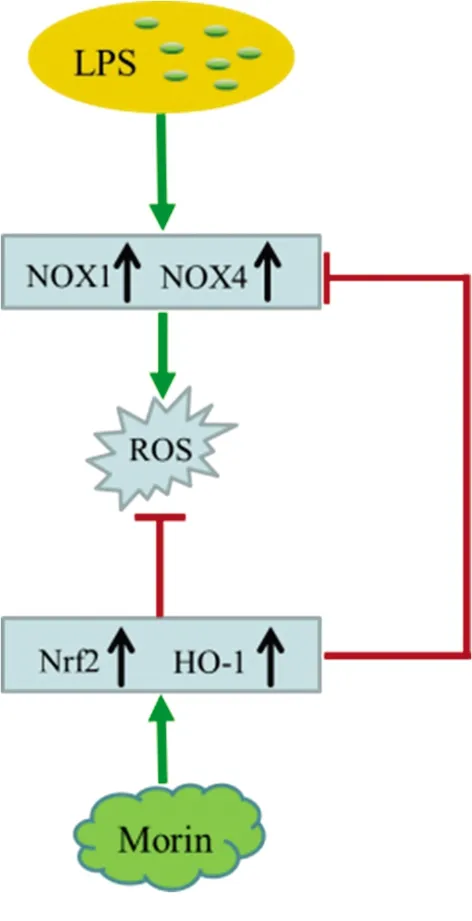
图5 Morin缓解LPS诱导的巨噬细胞氧化应激的示意图
3 讨论
ALI是一种以弥漫性肺泡损伤、炎症细胞浸润、肺泡上皮屏障破裂、肺泡水肿、肺气体交换受损为特征的严重、多因素的肺部病变,具有高发病率、高致死率等特点。目前,大多数ALI患者的治疗效率低,治疗方案主要集中在控制肺部炎症、小潮气量机械通气,液体管理及体外肺氧合等,尚缺乏有效的药物进行防治[8-9]。
中医学认为,ALI属暴喘、喘脱范畴,主要由内伤或外感后肺不主气或肾不纳气进而导致肺气上逆或气不归元所致。中医治疗ALI主要包括清热解毒、宣肺通腑、活血化瘀、扶正祛邪、通里攻下、肺肠同治、益气利血等。已有多项研究表明,中药在治疗呼吸系统疾病中收到良好功效。如中药制剂莲花清瘟胶囊联合常规抗病毒西药治疗新型冠状病毒肺炎(COVID-19)感染患者安全有效,并且可预防与感染者密切接触后COVID-19进展[10-11]。此外,研究显示痰热清注射液、参麦注射液等多种中药制剂均能通过抑制过氧化作用,减轻氧化应激所致肺损伤[12]。Morin是一种在水果、蔬菜中发现的生物类黄酮,最初是从桑科植物中分离出来,作为黄酮类化合物的一种,具有抗炎、抗氧化、抗肿瘤及治疗糖尿病等多种生物学活性。有研究表明,在LPS诱导的大鼠ALI模型中,Morin能有效缓解ALI 导致的肺泡水肿与肺组织纤维化形成,同时降低ALI模型大鼠外周血清中炎症因子表达水平[13]。此外,Morin还可降低支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中炎症细胞数量,显著抑制LPS诱导的肺组织中性粒细胞浸润[14]。
氧化应激是影响ALI发展和进程的重要机制之一。在ALI条件下,氧化应激显著诱导炎症因子的产生、巨噬细胞和内皮细胞中诱导型一氧化氮合酶(iNOS)的激活及一氧化氮(NO)的分泌,进一步促进了更强氧化剂的产生和氧化损伤的发展[15]。并且氧化应激损伤可通过炎症对肺泡上皮细胞间接诱导,进一步加速肺泡上皮细胞的坏死和凋亡[16]。红系衍生的Nrf2是各种细胞氧化应激反应中的关键核转录因子[17]。有研究表明,Nrf2能参与巨噬细胞代谢和炎症介质的表达,并且Nrf2的激活对包括急性肺损伤(ALI)、急性呼吸窘迫综合征(ARDS)在内的各种肺部疾病均具有保护作用[18-19]。HO-1是Nrf2依赖性抗氧化防御基因之一,同样Nrf2/HO-1信号通路的激活调节细胞抗氧化应激并对ALI发挥抗炎和细胞保护作用[20]。Morin可作为Nrf2的外源性激动剂,促进Nrf2的核转位,进而发挥其抗氧化应激的生物学作用[21]。
本研究采用LPS刺激巨噬细胞,以Morin为干预手段。首先观察到,当巨噬细胞给予LPS刺激后,作为ROS主要来源的NOX1、NOX4的表达水平较正常DMSO组明显升高,说明LPS能够激活巨噬细胞的氧化应激作用。其次观察了不同组别中Nrf2及其下游产物HO-1的表达情况。结果显示,LPS+Morin组中Nrf2、HO-1的表达较DMSO组、LPS组及Morin组均升高。这可能是由于Nrf2激活作为对LPS诱导的细胞适应性反应,一旦细胞受到LPS诱导的氧化应激的挑战,Nrf2的激活就开始了。然而,它无法完全克服LPS的刺激作用,而适应性刺激的Nrf2可能会减轻或延迟LPS的刺激作用。在Morin组中Nrf2及其下游产物HO-1的表达明显增加,表明Morin给药可增强这种作用。因此,这支持了Morin通过Nrf2途径在预防和治疗LPS诱导的ALI中可能发挥作用。
综上所述,Morin可通过激活Nrf2/HO-1信号通路,下调NOX1和NOX4的表达,抑制LPS诱导的巨噬细胞氧化应激反应。本实验通过研究Morin对LPS诱导巨噬细胞损伤的保护作用及机制,为寻找ALI的有效治疗靶点提供了新思路,并为Morin药理学研究和临床应用提供了理论基础。

