膈肌超声预测心脏术后急性呼吸窘迫综合征患者撤机的临床研究*
黄园琴,杨 佳,左文霞,周文俊,刘 彬
(武汉科技大学附属武汉亚洲心脏病医院重症监护室,武汉 430021)
适时撤除机械通气对心脏外科术后合并急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)患者至关重要,合理撤机可以减少机械通气并发症,缩短住院时间,减少住院费用。但撤机时机选择不当会导致再次气管插管,增加一系列并发症(如感染、消化道出血、深静脉血栓形成)的发生。机械通气患者中有20%会产生呼吸肌依赖,膈肌作为维持自主呼吸的有效呼吸肌,在机械通气过程中也常常合并功能障碍。超声是一种无创、有效的评估膈肌功能的工具。本研究旨在探讨床旁超声评估膈肌移动度(DM)和膈肌厚度变化率(TF),以及浅快呼吸指数(RSBI),预测心脏术后ARDS患者撤机的有效价值。
1 资料与方法
1.1 一般资料
选择2018年3月至2020年5月在本院住院的心脏病患者246例,其中男198例,女48例,平均年龄(63.16±10.54)岁。行大血管手术103例,瓣膜置换术83例,搭桥手术54例,其他先天性心脏病手术6例。根据拔管结果,分为撤机成功组209例,撤机失败组37例。入选标准[1]:(1)年龄≥18岁;(2)符合ARDS柏林定义;(3)原发病因已好转,神志清楚,可配合完成指令性动作;(4)血流动力学稳定,心率稳定在60~120次/分钟,收缩压90~150 mm Hg;(5)呼吸机条件已下调,吸入氧浓度(FiO2)≤50%,呼气末正压时,氧合指数(PaO2/FiO2)≥150。排除标准:(1)年龄<18岁;(2)合并中枢神经系统并发症;(3)胸腹联合手术;(4)合并严重肝肾功能损害、重症感染、脓毒性休克;(5)ICU衰弱综合征。本研究经本院伦理委员会批准(2021-申报037),患者及授权委托人签署知情同意书。
1.2 方法
对符合入选标准的患者记录年龄、性别、体重指数(BMI)、急性生理学和慢性健康状况评分Ⅱ(APACHEⅡ)、全身性感染相关性器官功能衰竭评分(SOFA)、机械通气时间、心率、平均动脉压、潮气量、分钟通气量(MV)等。进行自主呼吸试验(SBT)30 min。SBT采用低水平压力支持模式,压力支持8 cm H2O,呼气末正压3 cm H2O。抽取桡动脉进行血气分析,计算PaO2/FiO2和RSBI。SBT结束后行膈肌超声检查。
患者取头高30°仰卧位。采用飞利浦 CX50超声仪,3.5 MHz凸阵探头,3.5 MHz 线阵探头。于右侧腋前线第7~9肋间,探头沿肋间隙放置。2D模式下找到需要测量的膈肌,选择M模式,将采样线垂直于膈肌,测量最大吸气末膈肌厚度(TdiFVC)和最大呼气末膈肌厚度(TdiFRC),每次测3个位点,取平均值。计算膈肌厚度变化率(TF)=(TdiFVC-TdiFRC)/TdiFRC。更换凸阵探头,放置于腋前线或锁骨中线与肋缘的交接处,探头方向朝向外下方,2D模式下找到需要测量的膈肌,选择M模式,将采样线垂直于膈肌,测量DM。超声测量由4位具有重症超声资质的ICU医生完成。
由主管医师和呼吸治疗师共同评估是否拔除气管插管。撤机成功标准:撤机后48 h内无须机械通气。撤机失败标准:(1)大汗、烦躁、嗜睡;(2)外周氧饱和度下降≥5%,呼吸频率>35次/分钟;(3)心率增快>20%,出现心律失常(快速房颤、多源频发室早、短阵室速);(4)收缩压升高>20%。记录患者的撤机结果,呼吸机为ARZN-0113型、ASBC-0402型(德国德尔格公司)。
1.3 统计学处理
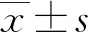
2 结 果
2.1 两组患者撤机前生理指标比较
两组患者撤机前年龄、BMI、APACHEⅡ、SOFA、机械辅助时间、心率、平均动脉压、潮气量、MV等比较差异均无统计学意义(P>0.05),见表1。

表1 两组患者撤机前生理指标比较
2.2 两组患者撤机前膈肌超声情况、PaO2/FiO2和RSBI比较
两组TdiFRC及TdiFVC比较差异无统计学意义(P>0.05),PaO2/FiO2、TF、RSBI、DM比较差异有统计学意义(P<0.05),见表2。

表2 两组患者撤机前膈肌超声情况、PaO2/FiO2和RSBI比较
2.3 膈肌超声和RSBI对预测成功撤机的ROC曲线分析
TF及RSBI预测撤机成功的ROC曲线最大约登指数为最佳界值,以最佳界值判断撤机是否成功。选择TF>27.9%为阈值,TF预测成功撤机的灵敏度85.00%,特异度89.03%,AUC为0.809(95%CI:0.749~0.869),见表3、图1。以RSBI<105次·min-1·L-1作为阈值的灵敏度91.34%,特异度32.98%,AUC 0.745(95%CI:0.659~0.848),见表3、图2。
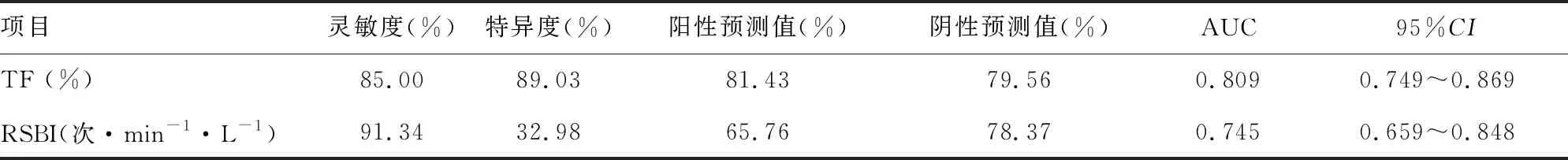
表3 TF和RSBI对成功撤机的预测价值

图1 TF预测成功撤机的ROC曲线
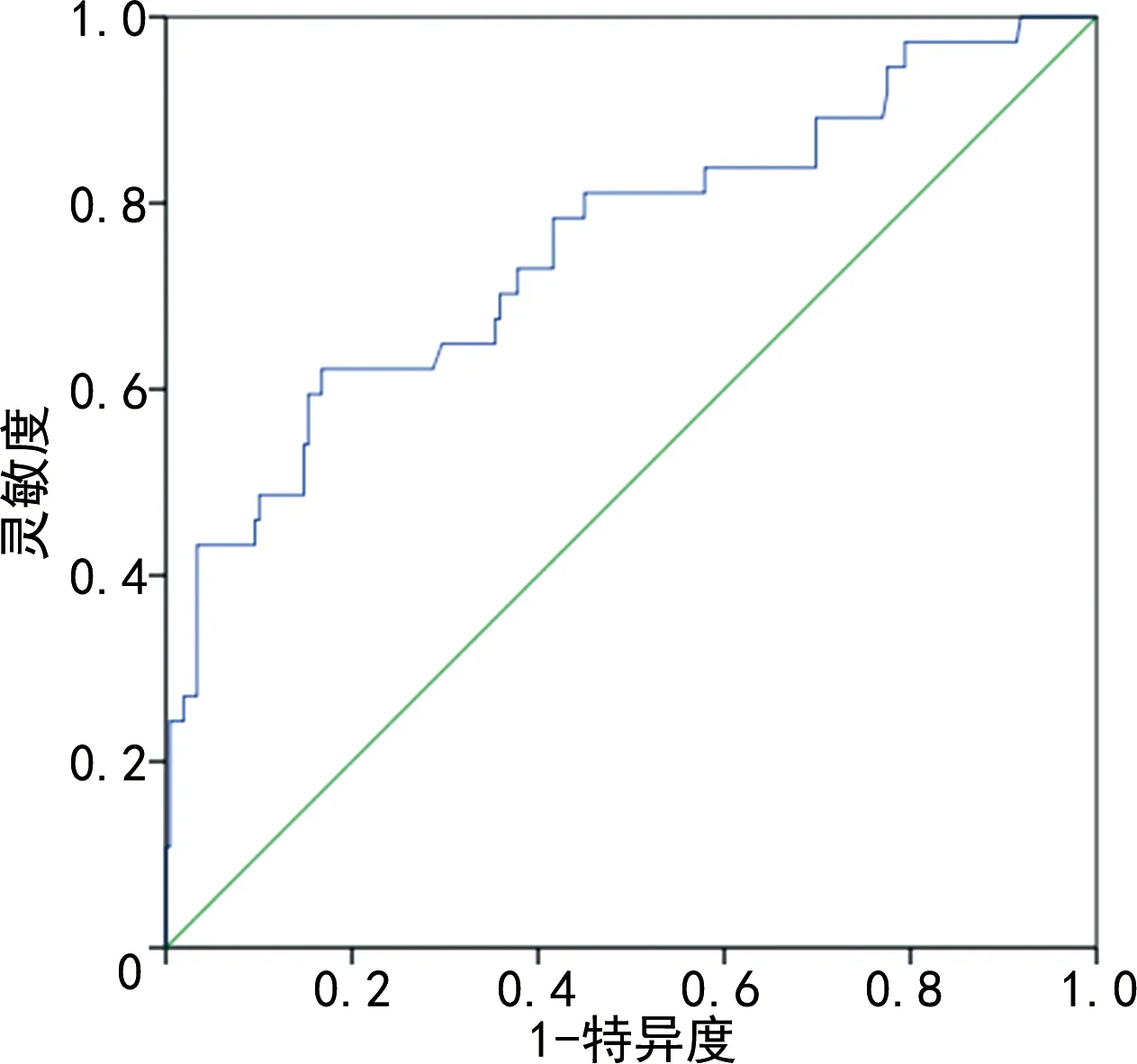
图2 RSBI预测成功撤机的ROC曲线
3 讨 论
膈肌是人体主要的呼吸肌,是驱动呼吸运动的主要呼吸肌。ICU患者接受机械通气治疗后其膈肌功能的障碍较为常见,现阶段各项研究均已明确[2],机械通气患者中20%~30%会出现呼吸机依赖,过早或延迟撤机均会导致撤机失败,造成严重不良后果。既往有文献统计可能其会增加患者40%~50%的死亡风险,故撤机时机的选择至关重要。临床上如何选择正确有效的机械通气撤机指导指标,对提高机械通气撤机成功率、保障患者的疗效和愈合均具有积极的意义[3]。
临床上有一些机械通气的模式及策略被用于辅助撤机过程,也有些指标用于帮助决定撤机时机和预测撤机结果[4]。目前已知的针对机械通气的撤机指标有呼吸频率、气道闭合压、SBT等,但现阶段临床对其参考阈值尚未统一,传统的脱机筛查指标并不能准确全面地预测脱机成功的可能性[5]。RSBI是最佳预测指标之一,也是目前临床上最常被采用的指标。RBSI作为撤机预测指标其灵敏度高但特异度低,本研究显示,RBSI预测成功撤机的灵敏度91.34%,而特异度仅为32.98%,导致撤机时机难以及时把握。因此探索更好的撤机指标[6],对ARDS患者的治疗具有重要的意义。
为弥补RSBI的不足,需要与其搭配特异度高的指标。近年来,随着床旁超声技术在ICU的推广,超声的简单、无创、可重复性高等优点在评估机械通气患者的膈肌功能中越来越受到重视[7]。机械通气时间较长的患者,尤其是伴有ARDS的患者,由于手术打击、全身炎性反应、营养不良、氧化应激、急性缺血缺氧、多脏器衰竭等原因,使膈肌变薄,活动幅度下降,收缩力减低,导致膈肌功能障碍[8]。机械通气本身也能影响膈肌功能,从而出现呼吸机相关性膈肌功能障碍[9]。传统评估膈肌功能的方法因具有创伤性或电离辐射等未在临床普遍采用,如透视检查、膈肌电磁刺激等临床可操作性差,不便于重复检查已逐渐被弃用。2015年5月,来自全国各地的20多名重症医学专家组成了重症超声共识小组,并于2016年颁布了《中国重症超声专家共识》[10],该共识明确指出:重症超声在ARDS的临床诊断中占有重要地位,是床旁评估膈肌功能的重要手段,有助于脱机的精准实施。采用重症超声评估膈肌功能的方法包括膈肌厚度变化、DM等[11],DM受呼吸深度、功能残气量、腹腔内压力等因素影响大,其指标与吸气努力的相关性不如膈肌厚度的变化指标。平静呼气末膈肌厚度、TdiFVC不能真实反映膈肌功能,而且正常膈肌厚度的绝对值差异较大,只有动态的膈肌厚度指标才能反映膈肌功能。GOLIGHER等[12]已证实,通过床旁超声观察患者的膈肌形态及变化,测定膈肌厚度具有可操作性、可重复性和有效性,膈肌厚度变化指标与膈肌电磁刺激、跨膈压等其他膈肌功能指标具有良好的相关性,能够评价膈肌功能,反映患者的自主呼吸能力[13]。
以膈肌厚度变化指标作为膈肌功能指标,对撤机结果具有良好的预测价值。本研究显示,TF作为撤机成功的预测指标,灵敏度85.00%,特异度89.03%。结合RSBI,在撤机成功的特异度方面明显提高。分析其原因,主要是因为膈肌厚度的动态指标反映的是真实的膈肌功能状态,而RSBI是反映所有吸气肌能力的指标。心脏术后ARDS患者常以辅助呼吸肌活动来补偿通气功能不全,掩盖了其膈肌功能障碍。但是辅助呼吸肌相对于膈肌更容易疲劳,缺乏持久耐力[14]。撤机前部分患者即使RSBI正常,撤机后也会因为再次呼吸衰竭而需要再次机械通气。因此,这类患者需进一步评估膈肌功能,为成功撤机做好准备。重症超声评估膈肌的收缩幅度和运动幅度,有助于呼吸功能不全的病因诊断,协助评估肺功能并指导临床撤机治疗[15]。对于对称性膈肌功能改变者可行单侧(右侧)膈肌功能评估来反映整体膈肌功能,对非对称性膈肌功能改变者,双侧膈肌功能评估是必要的,鉴于正压通气对膈肌运动的影响,对机械通气的患者采用收缩幅度来评估膈肌功能可能更为合理[16]。有研究证实,重症超声评估膈肌和骨骼肌的数量和质量与肌力和功能相关,是早期发现并评估治疗效果的有效手段[17]。
在本研究中,由于操作可行性研究,笔者只观察了右侧膈肌,左侧膈肌因为大多术中置入胸管,敷料覆盖,显像困难,未纳入研究。故对少数单侧膈肌功能障碍的患者,研究结果的参考性降低。笔者发现大血管术后出现ARDS的患者比例明显偏多,不排除各种原因引起的肺损伤、合并感染、脓毒性休克、创伤应激等因素导致的撤机失败。本研究未进行ARDS不同病因的分层,导致TF在各种疾病中或者不同表层患者的评估意义有一定局限性,还需要进一步的研究。

