菲律宾蛤仔糖胺聚糖的分离纯化及结构表征
詹雯琦,刘淑集,李水根,蔡水淋,路海霞,王茵,刘智禹*
(1.福建师范大学,福建 福州 350007;2.福建省水产研究所国家海水鱼类加工技术研发分中心(厦门),福建省海洋生物增养殖与高值化利用重点实验室,福建省海洋生物资源开发利用协同创新中心,福建 厦门 361013;3.福建省海洋职业技术学校,福建 福州 350000)
菲律宾蛤仔(Ruditapes philippinarum)又称花蛤、杂色蛤等,北方俗称蛤蜊,隶属于双壳纲、蛤蜊科,广泛分布于辽宁、山东、福建等南北海区,是我国近海四大养殖贝类之一[1],其产量大、价格不高,且肉味鲜美,营养丰富,已成沿海地区百姓餐桌常见的一种水产品。目前,菲律宾蛤仔主要以生鲜形式销售,少部分加工成罐头等形式,产品附加值低。传统中医认为菲律宾蛤仔可入药,《中华本草》中也记载其药效。现今已有大量研究报道,菲律宾蛤仔富含多肽、多糖、糖胺聚糖、糖蛋白等生物活性物质[2-4],具有抗氧化[5-6]、降血糖[7]、降血脂[8]、抗肿瘤[9-10]、抑菌[11]、抗凝血[12]、促进铁吸收[13]等活性。
糖胺聚糖(glycosaminoglycans,GAGs),属于一种杂多糖,是一类由重复的二糖结构单一组成的带有负电荷的长链大分子,具有羧基和硫酸基团[14]。学者认为,多糖的生物活性与它的分支度、溶解性、空间结构、取代基种类等因素密切相关[15-16]。GAGs结构特殊,其二糖单位为己糖醛酸和己糖胺,具有较强的生物活性[17],成为生物高分子中的研究热点。近年来,国内外已从海参[18]、牡蛎[19]、扇贝[20]、合浦珠母贝[21]等海洋生物中分离到了GAGs。因此,本文以养殖菲律宾蛤仔为原料,采用水酶法提取GAGs,并通过离子色谱、紫外光谱、傅里叶红外光谱及核磁共振技术对提取到的GAGs进行分离纯化与结构表征,为该GAGs的结构研究奠定基础,也为菲律宾蛤仔等海洋贝类的高值化应用提供参考依据。
1 材料与方法
1.1 材料与试剂
1.2 仪器与设备
旋涡混合仪(XW-80A):海门市其林贝尔仪器制造有限公司;台式高速冷冻离心机(5810R):德国Eppendorf公司;紫外-可见分光光度计(UV-3200):上海美谱达仪器公司;程控全自动部分收集器(CBS-B):上海沪西分析仪器厂有限公司;电子分析天平(BSA8201):赛多利斯科学仪器有限公司;蠕动泵驱动器(BT100J-1A):慧宇伟业流体设备有限公司;旋转蒸发器(R系列):上海申生科技有限公司;冷冻干燥机(SCIENTZ-10N):宁波新芝生物科技公司;傅里叶红外光谱仪(380FT-IR):美国 Nicolet公司;核磁共振仪(Bruker-AVANCE600):德国 Bruker公司。
1.3 试验方法
1.3.1 菲律宾蛤仔GAGs的制备
称取50 g菲律宾蛤仔匀浆后,添加9 800 U/g中性蛋白酶,按料液比1∶1(g/mL)加入去离子水,50℃下酶解5 h,所得酶解液煮沸10 min灭酶。冷却至室温(24℃~26℃)后,10 000 r/min离心 10 min,收集上清液。调节上清液的pH值为7.0,加入95%乙醇(3倍体积),混匀,置于4℃下24h。后 4000r/min,离心15min,取沉淀。冷冻干燥得到菲律宾蛤仔GAGs粗品,得率为1.04%。用阿利新蓝法[22]测定糖胺聚糖含量为7.13%(以干基计)。
1.3.2 DEAE-650M离子交换色谱分离纯化菲律宾蛤仔GAGs
用去离子水清洗去除DEAE-650M中的细小颗粒,配制成凝胶,脱气,装柱,以去离子水为溶剂,以流速1 mL/min平衡24 h。
将GAGs粗品用去离子水配制浓度为90 mg/mL的溶液,过0.45 μm滤膜除杂、上柱。依次用去离子水和 0.25、0.50、0.75、1.00 mol/L NaCl溶液进行洗脱,以1 mL/min的流速收集,每管收集5 mL,用阿利新蓝比色法[22]检测各管GAGs含量,每一浓度梯度洗脱至无洗脱峰出现。合并相同组分的洗脱峰、透析、浓缩、真空冷冻干燥得GAGs纯化品。
1.3.3 紫外光谱分析
超高速动能武器对地打击毁伤效应主要包括直接侵彻、撞击成坑以及地冲击毁伤[1,13-14] 3种。根据固体侵彻、半流体侵彻和流体动力学侵彻,分别计算侵彻深度、成坑范围和地冲击效应。
将所得的GAGs纯化品用蒸馏水配制成1 mg/mL溶液,在波长190 nm~600 nm进行紫外光谱扫描,以蒸馏水作空白对照。
1.3.4 傅里叶红外光谱分析
称取GAGs纯化品2 mg,加入干燥的KBr晶体200 mg,于玛瑙研钵中研磨均匀,取适量压片成透明状,在4 000 cm-1~400 cm-1进行傅里叶红外光谱仪扫描分析。
1.3.5 核磁共振(nuclear magnetic resonance,NMR)分析
称取100 mg的菲律宾蛤仔GAGs纯化品,溶解于600 μL的重水(D2O),在试验温度为 25℃条件下,应用Bruker-AVANCE 600核磁共振仪进行13C-NMR和1H-NMR图谱分析。
2 结果与分析
2.1 菲律宾蛤仔GAGs的分离纯化结果
菲律宾蛤仔GAGs粗品洗脱曲线见图1。

图1 菲律宾蛤仔GAGs粗品洗脱曲线Fig.1 The elution curve of crude GAGs from Ruditapes philippinarum
如图1所示,菲律宾蛤仔GAGs粗品经DEAE-650M离子交换柱层析分离得到2个峰,GAG-1和GAG-2,分别为 0.50、0.75 mol/L NaCl溶液洗脱部分。经检测,GAG-1的糖胺聚糖含量较高,为89.56%,是粗品的1.82倍,而GAG-2含量很低。收集峰GAG-1,经透析、冻干后得浅黄色的菲律宾蛤仔GAGs纯化品,颜色较粗品的浅褐色淡,说明DEAE-650M离子交换柱层析可以起到脱除色素的作用。
2.2 菲律宾蛤仔GAGs紫外光谱分析
利用紫外光谱对菲律宾蛤仔GAGs粗品、GAG-1和GAG-2分别进行全波长扫描,结果如图2所示。

图2 菲律宾蛤仔GAGs粗品、纯化品紫外光谱分析Fig.2 The UV spectrum of crude GAGs,GAG-1 and GAG-2 from Ruditapes philippinarum
由图2可知,菲律宾蛤仔GAGs粗品、GAG-1和GAG-2 3个样品的紫外光谱曲线基本重叠,在200 nm左右波长处有强吸收峰出现,说明其含有羧基;在250 nm~280 nm波长处有小吸收峰,说明可能含有少量的核酸或蛋白质杂质[23]。而GAG-1和GAG-2在260 nm和280 nm处的吸收与GAGs粗品相比有所降低,说明经过DEAE-650M柱层析后除去了少量的杂质,起到了纯化的效果。
2.3 菲律宾蛤仔GAG-1红外光谱分析
红外光谱图上的每个特征吸收峰,都是由相对应的分子或原子或官能团振动引起的。对菲律宾蛤仔GAG-1在4 000 cm-1~400 cm-1进行红外光谱扫描,其结构分析结果如图3所示。
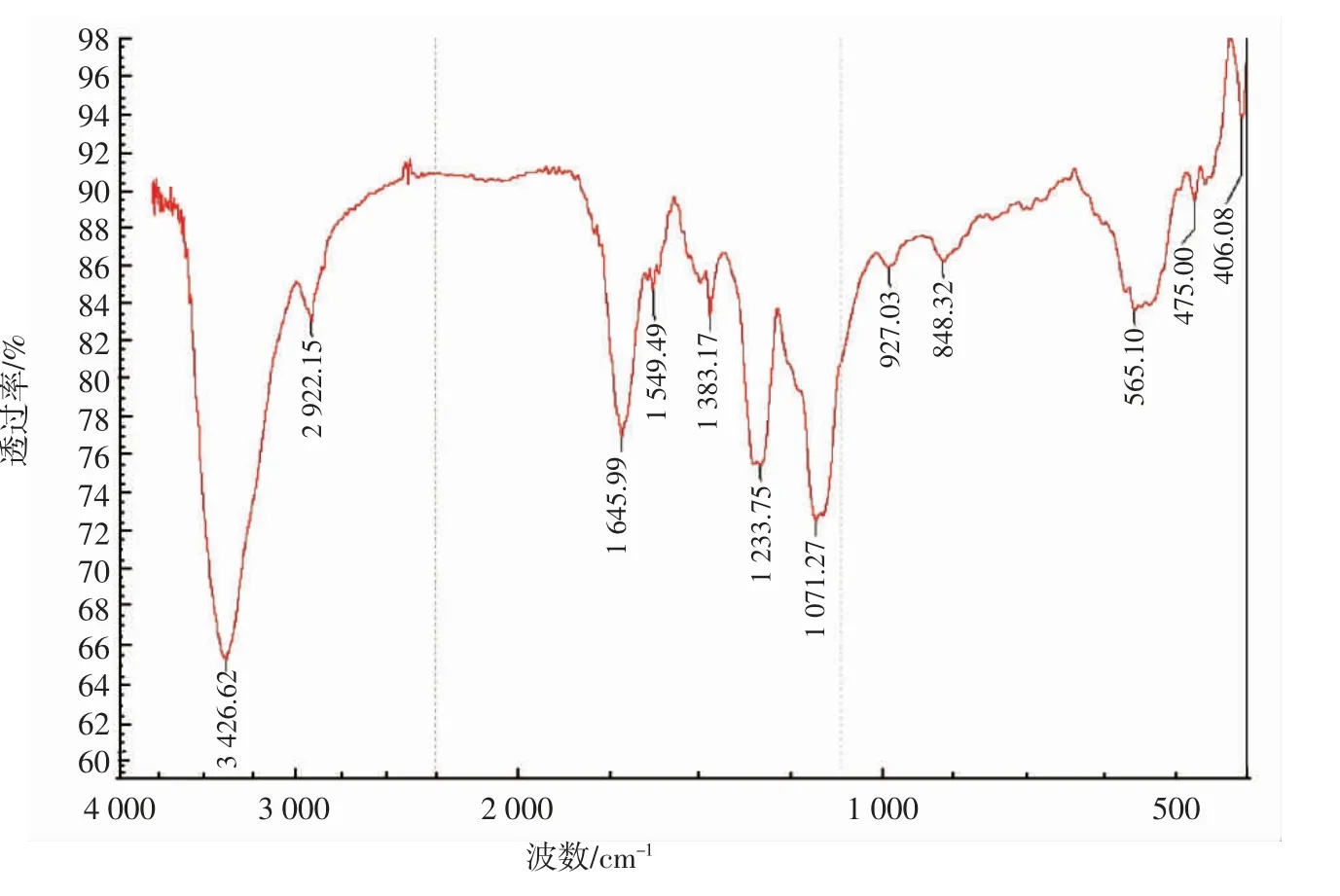
图3 GAG-1的红外光谱图Fig.3 The infrared spectrum of GAG-1
由图3可知,GAG-1在3426.62cm-1和1071.27cm-1处有强吸收,是因为糖分子内或分子间氢键的O-H伸缩振动和O-H变角振动(一级),说明有糖环醇羟基的存在[23];在波数2 922.15 cm-1附近的吸收,说明是糖类的特征峰,存在糖环上亚甲基C-H伸缩振动[23];在波数1 645.99 cm-1附近有C=O键伸缩振动的特征吸收峰,说明结构中存在乙酰氨基[24];而在波数1 549.49、1 383.17、1 233.75 cm-1处均为羧基的吸收峰,分别是由C=O非对称伸缩振动、C=O对称伸缩振动以及OH变角振动引起;在波数927.03 cm-1处有吡喃环吸收峰,说明存在非对称环伸缩振动;在波数848.32 cm-1附近的吸收峰,说明结构中存在硫酸基[25]。以上现象均说明GAG-1具备糖胺聚糖的基本特征[26]。由图3分析可知,菲律宾蛤仔GAG-1含有羧基、乙酰氨基、硫酸基等。
2.4 菲律宾蛤仔GAG-1核磁共振分析
一维核磁共振氢谱(1H-NMR)一般可用于分析糖苷键构型,大多数质子共振峰集中在化学位移δ 3.0~4.5,图谱峰重叠较严重[27]。一维核磁共振碳谱(13C-NMR)可用于测定糖残基数目、异头碳构型、糖链的连接位置等,但因其测定的化学位移值范围较大,致使其具有信号重叠少、分辨率高等特点,广泛应用于多糖结构的测定[28]。对菲律宾蛤仔GAG-1分别进行1H-NMR和13C-NMR图谱扫描检测,结果如图4和图5所示。

图4 菲律宾蛤仔GAG-1的1H-NMR图谱Fig.4 The1H-NMR spectrum of GAG-1 from Ruditapes philippinarum

图5 菲律宾蛤仔GAG-1的13C-NMR图谱Fig.5 The13C-NMR spectrum of GAG-1 from Ruditapes philippinarum
在1H-NMR谱(图4)中,化学位移1.99处的峰为GlcNAc的甲基信号[15]。化学位移3.5~4.5之间是糖环上各氢信号;化学位移3.93和3.73处分别为GlcNAc和Gal的H2吸收峰;化学位移4.27和4.14处分别为Gal的H3和GlcNAc的H4吸收峰;化学位移4.50处为Gal H1吸收峰。由于化学位移4.95是α吡喃糖H1质子和β构型吡喃糖H1质子化学位移的分界点[29],图4中没有大于4.95的峰,说明菲律宾蛤仔GAG-1的糖环构型为β-构型[30]。
在13C-NMR谱图(图5)中,化学位移22.50处为GlcNAc-C2位上的乙酰基中甲基吸收峰。化学位移61.02和68.66处分别是6-硫酸化-GlcNAc-C6和6-硫酸化-Gal-C6的吸收峰。而非端基碳(C2、C3、C4和 C5)未发生取代的信号在化学位移70.92~74.58,且共振峰重叠严重;化学位移77.34处的峰取代质子信号,表示样品为1,4-糖苷键连接;化学位移104.30、103.71和103.56这3处峰比较强,分别是异头碳的化学位移,且均大于103,表明这可能存在3个单糖[31],且都是β构型,这与1H-NMR分析结果一致。化学位移177.37、174.99、174.05处为己糖醛酸羧基或乙酰氨基的信号[32]。
因此,综合1H-NMR和13C-NMR图谱分析结果,说明菲律宾蛤仔GAG-1是以β-D-Glc(1→4)-为主要的连接方式。但是由于GAG-1的糖胺聚糖含量只有89.56%,纯度不高,1H-NMR和13C-NMR两种图谱杂峰较多,无法精确判断糖残基的类型和相对含量。
3 讨论与结论
本文采用水酶法从菲律宾蛤仔中提取了GAGs粗品,经DEAE-650M柱层析纯化后得到GAG-1和GAG-2等2个组分,其中GAG-1的糖胺聚糖含量为89.56%,比粗品提高了82.43%,而GAG-2含量很低。通过光谱检测可以判断分离纯化后的菲律宾蛤仔GAG-1的分子结构中存在羧基、乙酰氨基、硫酸基等基团,与王瑞芳等[33]的研究结果类似,她们分离的菲律宾蛤仔糖胺聚糖F-1-1主要含有氨基半乳糖、半乳糖、葡萄糖等。同时,通过NMR检测分析结果显示菲律宾蛤仔GAG-1的单体为吡喃型,并以β-D-Glc(1→4)-为主要连接方式,与范秀萍等[34]等分离出的菲律宾蛤仔糖胺聚糖RG-1相吻合,RG-1主要由葡萄糖、氨基半乳糖和半乳糖通过1→6、1→4或1→4、6键连接构成主链,在主链中还含有大量半乳糖醛酸。但是,本研究对于菲律宾蛤仔GAG-1的分离纯化及结构分析还不够,紫外光谱显示还存在着微量的核酸或蛋白质杂质,有待于今后结合凝胶色谱等其他手段进一步纯化,再采用二维核磁共振、高碘酸氧化、质谱、Smith降解等方法对其结构进行表征,以便为糖胺聚糖构效关系的研究提供参考依据。

