11份蜜环菌种质rDNA-IGS序列分析及液体培养基优化
莫盛龙 夏宗元 李 继 侯正科 刘红昌* 黄明进
(1贵州大学农学院/石斛研究院,贵州贵阳 550025;2福泉市华源生态农业发展有限公司,贵州福泉 551608;3贵州省药用植物繁育与种植重点实验室,贵州贵阳 550025)
蜜环菌Armillaria mellea,隶属于担子菌亚门Basiaiomycotina 伞菌目Agaricales泡头菌科Physalacriaceae 蜜环菌属Armillaria(Fr.)Staude,是传统的药食两用大型真菌,具有重要的经济价值。蜜环菌是天麻生长所必需的共生真菌,为无法进行光合作用的天麻提供生长繁殖所需营养物质,对天麻品质及产量的影响较大[1-5]。在药理上蜜环菌有与天麻相似的功效,人工液体发酵生产的蜜环菌菌丝体或菌球及其发酵液制成的蜜环菌制剂主要用于治疗神经衰弱、失眠、耳鸣、眩晕、四肢麻木及癫痫等疾病[6-8]。
核糖体基因被认为是最能反映物种间遗传关系的指标之一,核糖体基因间隔区可分为内转录间隔区(Internal Transcribed Spacer,ITS)和基因内间隔区(Intergenic Spacer,IGS)2 种。IGS 区域相对于ITS区域而言是比较低的保守基因区间,可进一步对相近的物种进行区分[9]。液体发酵技术生产蜜环菌,发酵周期短,生产效率高,为可连续的工业化生产。笔者对11份蜜环菌种质的rDNA-IGS区段进行序列测定,利用DNAMAN 软件对其进行分类及特征序列比对;并在相对一致的液体培养条件下对其进行培养,选择优势蜜环菌菌株,采用三因素三水平正交试验,对其培养基进行优化,以期为蜜环菌种质资源的分类、鉴别及液体培养提供参考。
1 材料与方法
1.1 材料
供试菌株于 2020 年 6 月收集,M-01—M-07 均来自贵州大学农学院,M-08购自贵州省都匀市匀洞镇马场村峻康生态农业发展有限公司,M-09购自黔东南兴昌菌业科技有限公司,M-10购自湖北省宜昌市裕禾菌业有限公司,M-11为贵州省福泉市仙桥乡月塘村野生蜜环菌子实体分离纯化菌株,共11份蜜环菌种质。经贵州省药用植物繁育与种植重点实验室鉴定,均为蜜环菌属Armillaria(Fr.)Staude种质,其中 M-01、M-02、M-04、M-05、M-08、M-09、M-10 为高卢族高卢蜜环菌Armillaria gallica,M-06、M-07为蜜环菌族蜜环菌Armillaria mellea,M-03、M-11为高卢族芥黄蜜环菌Armillaria sinapina。
1.2 培养基配制
分离纯化培养基:PDA 培养基,按照说明书方法使用,倒入500 mL的锥形瓶中,每瓶200 mL。
活化培养基:马铃薯200 g,葡萄糖10 g,蔗糖10 g,蛋白胨2 g,磷酸二氢钾1 g,七水硫酸镁0.5 g,琼脂粉12 g,pH6.0;马铃薯去皮切丁,加入适量的清水煮沸,持续沸腾期间用铁勺捣碎,单层纱布过滤3次,滤液加水至1 L 后,加入其他原料,搅拌煮沸,倒入50 mL的试管中,每支30 mL。
优势蜜环菌的筛选培养基:玉米淀粉8 g,黄豆粉8 g,葡萄糖20 g,蛋白胨6 g,酵母浸膏2 g,磷酸二氢钾2 g,七水硫酸镁1 g,VB11 g;先将玉米淀粉(1.2 g)和黄豆粉(1.2 g)按比例称量,倒入200 mL 的培养瓶中,再将葡萄糖、蛋白胨、酵母浸膏、磷酸二氢钾、七水硫酸镁、维生素B1溶于1 L 的水中,加热煮沸充分溶解,按每瓶150 mL倒入培养瓶中。
1.3 蜜环菌分离纯化与活化
蜜环菌的分离:将野外采集到的蜜环菌子实体在超净工作台上用75%的酒精棉球擦拭菌盖表面,迅速用无菌水冲洗菌盖,再用无菌棉球擦干菌盖上的水,用镊子撕去菌盖表皮,在菌柄与菌盖交接处切取0.3~0.5 cm2的组织块,接种于PDA 培养基上,置25 ℃的恒温培养箱避光培养30 d,并与搜集的蜜环菌原种,存放于4~8 ℃环境中保存备用。蜜环菌的活化:将分离纯化和收集的原种菌丝或菌块接种于活化培养基中,置25 ℃的培养室内避光培养15 d,置4~8 ℃环境中保存备用。
1.4 蜜环菌rDNA-IGS序列分析
蜜环菌原种活化后,各取一支试管取出菌丝,清除培养基后,用液氮速冻,磨成粉状,DNA 提取按照真菌基因组DNA 提取试剂盒操作。引物的选择与合成采用间隔区基因的引物5SA/CNL12[10]。5SA碱基序列为5'-CAGAGTCCTATGGCCGTGGAT-3',CNL12碱基序列为5'-CTGAACGCCTCTAAGTCAG-3',由北京擎科生物科技有限公司重庆分公司合成。rDNA-IGS 序列扩增:PCR 反应体积为 30 µL,其中金牌Mix(green)26 µL,上下游引物各1 µL,DNA 模板2µL。反应条件:94 ℃预变性2 min后,94 ℃变性40 s,58.9 ℃退火40 s,72 ℃延伸100 s,共35个循环;72 ℃延伸 10 min,4 ℃保存。取 2.5 µLPCR 产物用1.0%琼脂糖凝胶进行电泳分析以便了解扩增情况,其余扩增产物送北京擎科生物科技有限公司重庆分公司进行双向测序和拼接。采用DNAMAN 6.0软件构建聚类图及序列比对分析。
1.5 优势蜜环菌菌株筛选
在超净工作台中取出试管中已活化的新生菌丝,刮除残留在菌丝上的培养基,切成1 cm 的小段,接种于优势蜜环菌筛选培养基中。每150 mL 摇瓶接种1 小段,每份蜜环菌接种3 瓶,在25 ℃、黑暗及150 r/min的条件下摇瓶培养15 d。将菌球取出清水清洗,统计菌球个数,在黑暗环境下观察菌球荧光,每瓶选4颗较大的菌球,测量其直径,所有菌球放在单层纱布上滤水过夜,称鲜重,60 ℃烘干,称干重,计算折干率。
1.6 优势蜜环菌液体培养基筛选
采用L(934)正交试验,试验因素为磷酸二氢钾(A)、七水硫酸镁(B)、VB(1C)。磷酸二氢钾水平分别为 1.5 g/L、2.0 g/L、2.5 g/L;七水硫酸镁水平分别为 0.5 g/L、1.0 g/L、1.5 g/L;VB1水平分别为 0.1 g/L、0.5 g/L、1.0 g/L。接种及培养方式同1.5。
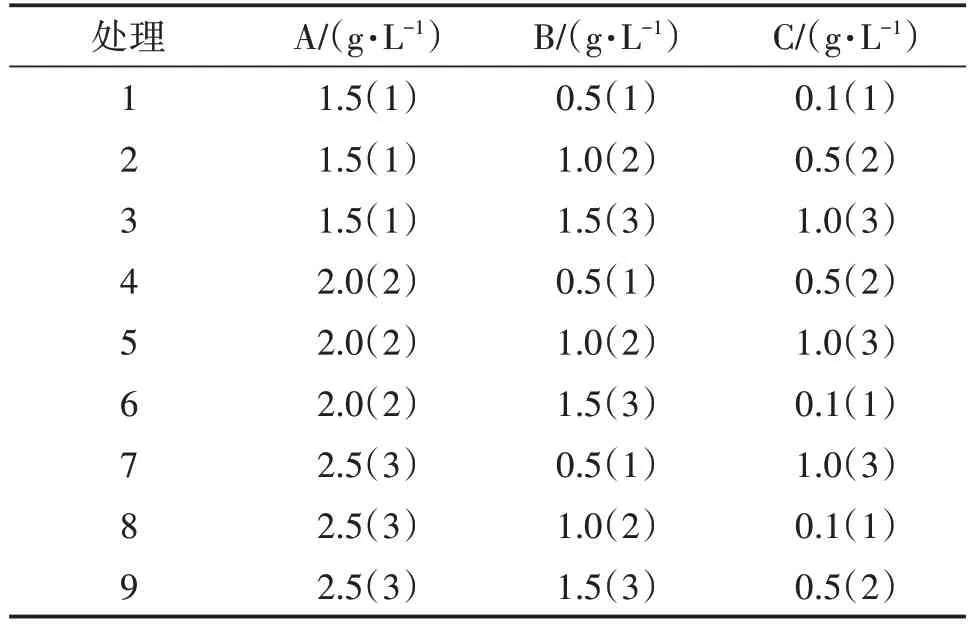
表1 优势蜜环菌液体培养基优化正交试验设计
2 结果与分析
2.1 11份蜜环菌种质rDNA-IGS序列分析
2.1.1 聚类分析
11 份蜜环菌种质样品测序峰图较好,序列拼接后,利用DNAMAN 6.0 软件对所有序列进行多重对位排列,将对位排列结果中5’和3’端的非对位排列区去除,通过构建同源树对11份蜜环菌种质进行聚类。由图1可知,11份蜜环菌种质划分为两个大类,相似度为82%,Ⅰ类包括M-01—M-05 和M-08—M-10,相似度为100%,Ⅱ类包括M-06、M-07 和M-11,相似度为100%。
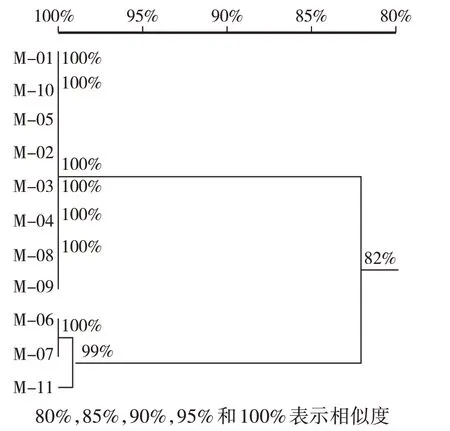
图1 基于rDNA-IGS序列的11份蜜环菌种质聚类分析
2.1.2 特征序列分析
利用DNAMAN 6.0软件分别对两类蜜环菌序列进行多重对位排列,将对位排列结果中5’和3’端的非对位排列区去除,进行序列对比。在Ⅰ类蜜环菌种质中,M-01发生2个碱基的变异,在225 bp处由T→A,在247 bp处由A→G;M-02发生1个碱基变异,在 6 bp 处由 A→G;M-05 发生 1 个碱基变异,在465 bp 处由 A→G;M-09 发生 1 个碱基变异,在 6 bp处由A→G;M-10 发生2 个碱基变异,在 225 bp 处由T→A,在 465 bp 处由 A→G。共有序列长度为861 bp,其中碱基A、C、G、T 所占比例分别为31.2%、25.6%、18.9%、24.3%。在Ⅱ类蜜环菌种质中,M-11发生 17 个碱基变异,在 5 bp 和 284 bp 处由 C→T,在28 bp 处由 T→C,在 706 bp 处由 A→G,在 730 bp 处由 G→A,在 439~444 bp 和 430~535 bp 处均发生碱基缺失,其中在439 和444 bp 处为碱基C 的缺失,在440~443 bp、530 bp、532 bp、534 bp 和 535 bp 处为碱基A 的缺失,在431 bp 处为碱基G 的缺失,在533 bp处为碱基T 的缺失。共有序列长度为804 bp,其中碱基 A、C、G、T 所占比例分别为 33.5%、25.2%、17.1%和24.3%。将两类的共有序列进行对比,去除非对位排列区后(表2),两类蜜环菌核糖体基因序列差异较大,A、C、G、T 均有不同程度的变异,相似度为72.61%,共有序列长度为632 bp。其中碱基A、C、G、T 所占比例分别为 33.9%、24.8%、16.6%、24.7%。
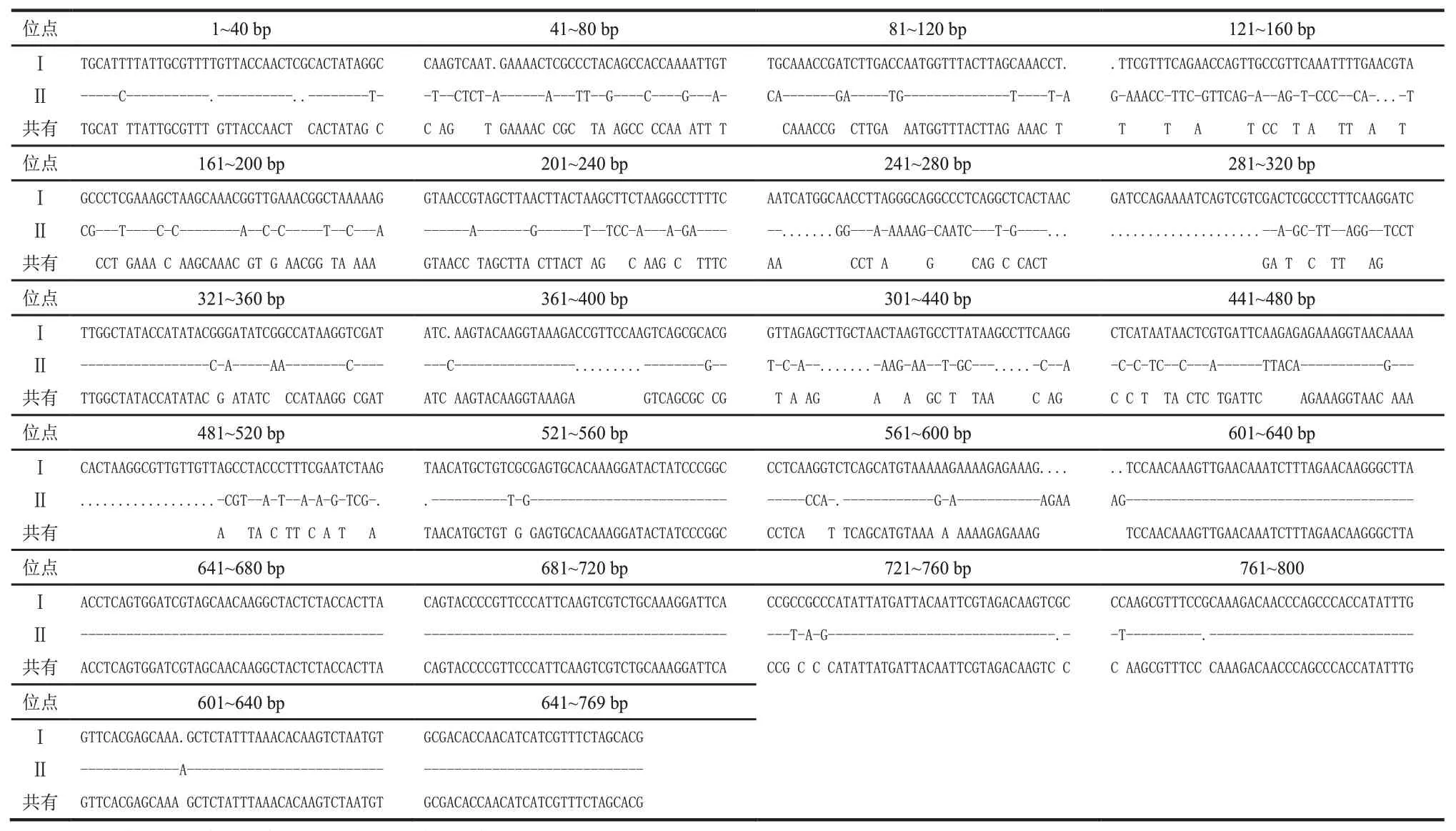
表2 两类蜜环菌rDNA-IGS共有序列对比结果
2.2 液体培养优势菌株筛选
2.2.1 显著性分析
将数据导入DPS 数据处理系统,采用Duncan 新复极差法进行方差分析比较数据的差异显著性。由表3 可知,M-03 菌球的直径最大(16.43 mm),M-04 次之(14.21 mm),M-06 最小(2.84 mm);M-09 菌球的个数最多(160 个/150 mL),M-10 次之(130个/150 mL),与M-04、M-08 差异不显著,M-03 最少(34 个/150 mL),与M-01、M-05、M-06 差异不显著;M-09 菌球的干重值最高(1.683 g/150 mL),M-08 次之(1.509 g/150 mL),M-06 最小(0.029 g/150 mL);在黑暗条件下观察菌球荧光情况,发现M-02 的荧光最强,M-09、M-10、M-08 和 M-04 荧光较弱,M-03、M-05 和 M-07 荧光弱,而 M-01、M-06、M-11 几乎没有荧光。因此,M-09 菌球生长情况较好,主要表现为菌球的直径较大,个数较多,菌丝干重值较高,折干率较小以及荧光强度较强,M-03 虽菌球直径最大,但菌球个数和干重较少,而M-06、M-01 和M-11表现最差。
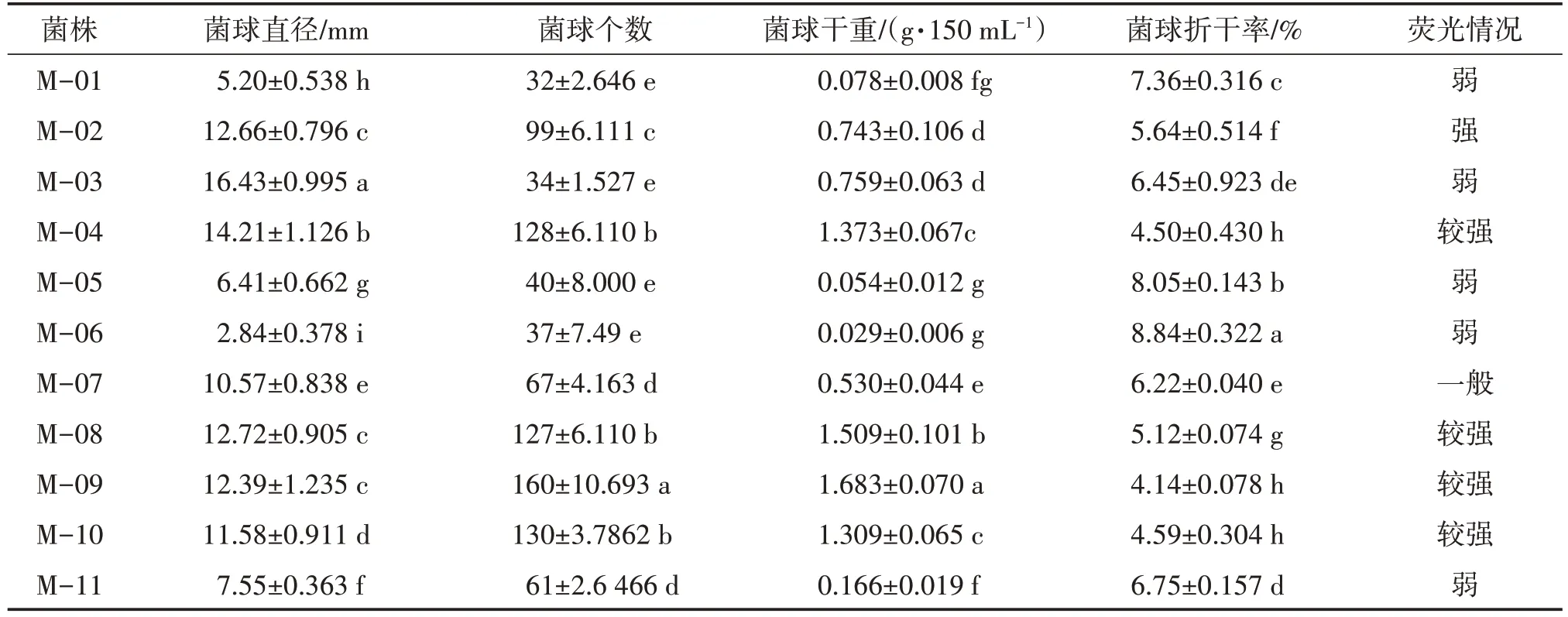
表3 蜜环菌种质菌球生长情况
2.2.2 聚类分析
以菌球的直径、个数、干重以及折干率为指标,利用SPSS 软件采用WORD 聚类法,对11 份蜜环菌种质进行分类。由图2 可知,11 份蜜环菌种质在欧氏距离为25 时,分为两个大类,Ⅰ类包括M-02、M-04 和 M-08—M-10,Ⅱ类包括 M-01、M-03、M-05、M-06、M-07 和M-11。Ⅰ类蜜环菌种质整体表现较优。

图2 基于菌球表型的11份蜜环菌种聚类分析
2.3 优势蜜环菌培养基优化
2.3.1 显著性分析
以M-09 为优势蜜环菌,对其培养基进行优化,由表4可知,处理2菌球的直径最大(11.82 mm),与处理1 差异不显著,处理9 最小(6.06 mm),与其他处理均差异显著;处理3 的菌球个数最多(129 个/150 mL),与处理7 差异不显著,处理1 最少(51 个/150 mL);处 理 7 菌 球 干 重 值 最 高(1.766 g/150 mL),与其他处理均差异显著,处理8次之(1.379 g/150 mL),处理9最小(0.105 g/150 mL),但与处理1 差异不显著。因此直观分析认为处理7 为较优培养基,菌球干重值最高,个数较多。
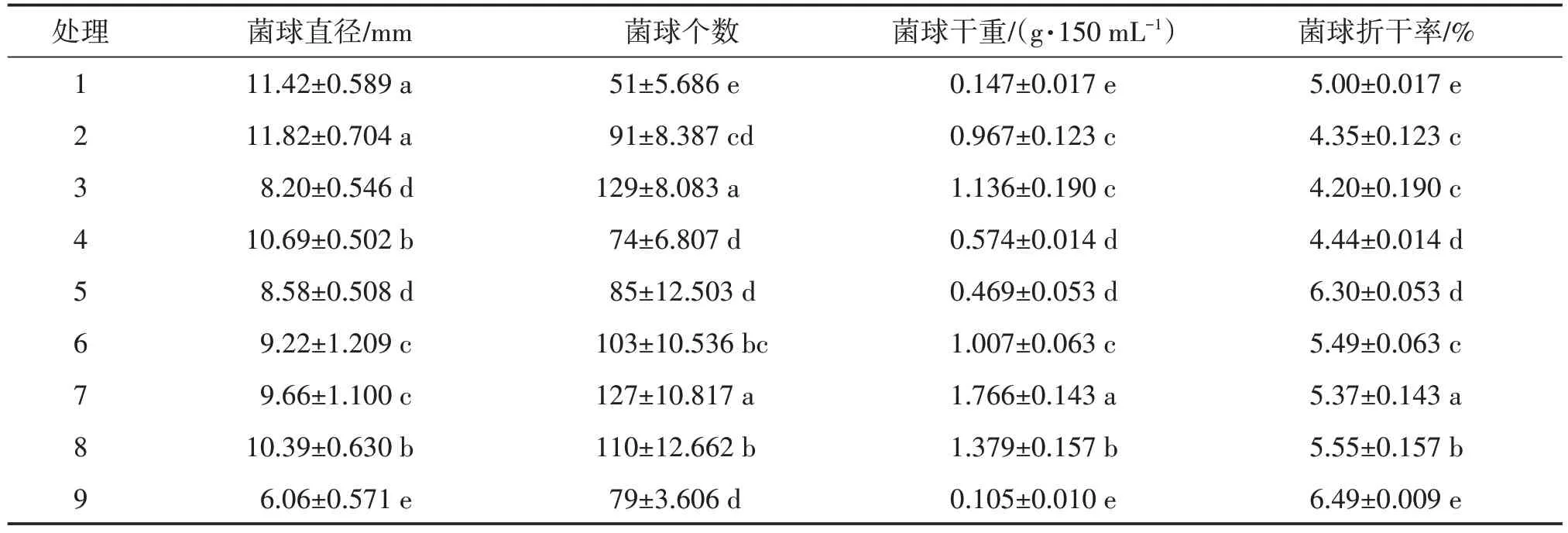
表4 优势蜜环菌液体培养结果
2.3.2 正交分析
以菌球干重为指标,采用LSD 法进行正交分析,由表5可知,比较各因素极值排出影响因素大小(R越大的因素越重要):VB1>磷酸二氢钾>七水硫酸镁。经方差分析,由表6 可知,A、B、C 三因素的F值均小于F0.05(2,2),因此三个水平菌球干重差异均不显著,所以选择平均数大的作为最优组合,即A3、B1、C3。
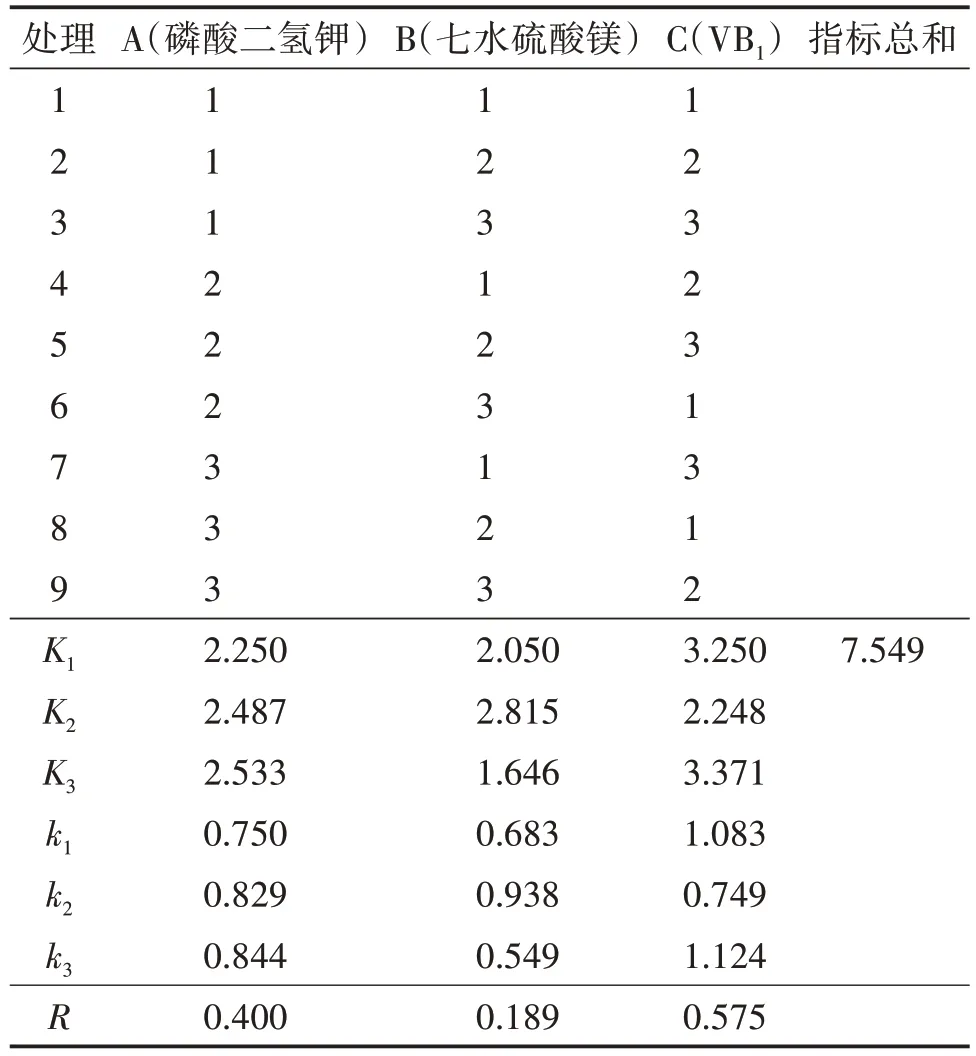
表5 优势蜜环菌正交试验结果(菌球干重)
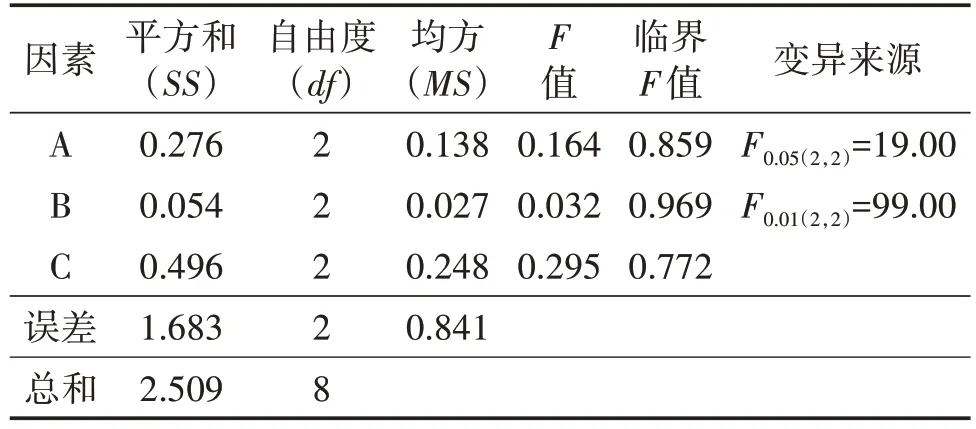
表6 正交设计方差分析表(完全随机模型)
3 小结与讨论
当前野生天麻资源匮乏,栽培天麻的产量、质量参差不齐,给市场供应带来了一定的压力。蜜环菌液体培养制品在药理上与天麻有相似功能,通过利用蜜环菌来缓解天麻市场的需求,具有重要意义。基因是控制生物性状的关键因素之一,试验通过分析不同蜜环菌种质之间的rDNA-IGS 序列上的碱基差异,并通过液体培养,探究它们之间是否存在某种联系。试验结果表明,rDNA-IGS 序列的聚类与菌球表型的聚类存在一定的差异,即在rDNAIGS 序列的聚类中,第Ⅰ类包括M-01~M-05 和M-08~M-10,第Ⅱ类包括M-06、M-07 和M-11,而在菌球表型的聚类中,第Ⅰ类包括M-02、M-04 和M-08~M-10,第Ⅱ类包括M-01、M-03、M-05~M-07 和M-11,聚类结果存在差异,这可能是因为蜜环菌rDNA-IGS 比较保守的缘故。另外,M-03 在贵州省药用植物繁育与种植重点实验室被鉴定为芥黄蜜环菌。鉴定方法是采用引物ITS1/ITS4 扩增其rDNAITS 序列,其聚类结果与研究中rDNA-IGS 序列的聚类结果一致,并在NCBI 数据库中对比发现M-03 与数据库中的一株芥黄蜜环菌聚为一类,故认为M-03 可能为芥黄蜜环菌,可能是由于芥黄蜜环菌在核糖体基因上变异范围较广,或高卢蜜环菌与芥黄蜜环菌之间亲缘关系较近造成了分类结果的差异。M-09 蜜环菌菌球液体培养表现较优,主要体现在菌球的个数和干重上,同时M-09 在Ⅰ类蜜环菌中6 bp处由A→G,该位点可能与菌球的个数或干重有关。Ⅱ类蜜环菌中M-11 变异位点有17 个,主要表现为碱基的缺失,在菌球的表型上表现为菌球较小,个数较少,干重较低。
蜜环菌作为天麻共生真菌,同时具有较高的药用价值,其培养条件的研究引起了众多学者的关注。前人对蜜环菌液体培养的研究多在于培养基的优化上,尤其是碳源、氮源的研究。程显好等[11]对分离自山东烟台和威海地区的蜜环菌菌株液体培养条件进行优化,结果表明最适碳源和氮源分别是糊精和豆饼粉提取液。杨海旭[12]发现秦巴山区蜜环菌优良菌株的最佳碳氮源分别为葡萄糖和蛋白胨。唐兴国等[13]采用正交试验同样对栎树枝、毛竹根、葡萄糖、蔗糖、果糖、马铃薯等碳源、氮源进行优化,获得一种蜜环菌液体种改良培养基配方(栎树枝100 g/L,毛竹根50 g/L,蔗糖20 g/L,马铃薯200 g/L,磷酸二氢钾3 g/L,七水硫酸镁1.5 g/L,VB110 mg/L,pH 自然)。以上研究均对培养基中的碳源、氮源进行优化,且筛选出较优的碳源和氮源以及适当的比例,但对于培养基中用量较少、价格较贵的成分研究较少。研究不仅对液体培养优良菌株进行筛选,还在固定碳源氮源的条件下,对磷酸二氢钾、七水硫酸镁及VB1的比例进行优化,得到其较优比例为5∶1∶2,以期在筛选适宜于液体培养的优势蜜环菌的同时,减少此类成分用量并筛选出合适的比例。

