心血管疾病的重要靶点PCSK9及其抑制剂的研究进展
朱 路,李华荣,杨远荣
0 引言
高水平的低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol,LDL-C)与心血管疾病风险相关。在正常机体内,肝细胞上的LDL受体(LDLR)结合外周血中的LDL颗粒后,由网格蛋白包被囊泡胞吞内化,将LDL-C整合入细胞内,在细胞基质中释放LDLR回到细胞表面循环利用,同时LDL-C被降解。枯草溶菌素前蛋白转换酶9 (Proprotein convertase subtilisin/kexin type 9,PCSK9)作为LDL-C的重要调节因子,在肝细胞中升高并释放到血浆中,与肝细胞表面LDLR表皮生长因子样重复结构域 A (EGF-A)相结合,经过内吞,转运到溶酶体,导致LDLR被降解,而LDL-C在体内蓄积。通过减少PCSK9表达来调节循环中LDL-C水平是一种心血管疾病的治疗策略。
1 PCSK9简介
PCSK9最早在研究家族性高胆固醇血症时发现,是1号染色体上PCSK9基因编码的,由692个氨基酸组成,大小为72kD的前蛋白转化酶。它的结构包括31~152个残基的前域、1~30个残基的N端信号肽、153~451个残基的C端结构域和153~451个残基的催化结构域。经历信号肽的裂解,自身催化成熟,分泌为成熟的PCSK9蛋白,在全身多个组织和器官表达,包括肝、心脏、脑(端脑、嗅球、小脑)等[1-2]。PCSK9基因突变会导致蛋白质功能过表达,如功能获得性突变D374Y-PCSK9与LDLR的亲和力高出5~30倍,并会提前10年出现冠心病(CHD)。另有研究显示,功能缺失性突变Y142X-PCSK9、C679X-PCSK9 和R46L-PCSK9可使LDL-C下降,CHD风险降低[3]。通过提取鼠PCSK9蛋白,发现PCSK9参与LDL-C调控的机制。随后通过大量DNA样本分析和测序,确定了PCSK9大致的功能及其在基因组中的位置,筛选出有意义的突变位点,表明PCSK9是一个有生物学意义的药物靶点。最近研究显示,PCSK9生理作用不仅是调控LDL-C,对动脉粥样硬化、心衰和心肌梗死、炎症的发生发展都有影响,抑制细胞外和细胞内PCSK9有重大临床意义。目前,PCSK9抑制剂研发主要包括阻断PCSK9与LDLR结合,抑制PCSK9表达,以及抑制PCSK9分泌等。
2 PCSK9功能
2.1 肝脏代谢胆固醇 血浆中大部分LDL-C被LDLR介导的内吞作用在肝脏内消除。在细胞内吞过程中,LDLR使LDL分子内化形成LDL/LDLR复合物,解离后LDLR返回细胞质膜进行再循环。每一个LDLR分子能循环利用150次,这表明通过PCSK9破坏LDLR可能会导致LDL-C水平显著改变。PCSK9前体分子在内质网内经历N端结构域的自催化裂解成成熟的PCSK9,前结构域与催化结构域保持连接,使成熟的PCSK9分子从内质网进入分泌过程[4]。作为一种磷蛋白进入血液循环,PCSK9没有其他底物存在,以依附LDLR表面或与LDLR相结合等方式存在于血液循环中。PCSK9的催化结构域与细胞质膜上LDLR的EGF-A结构域相连接,形成PCSK9/LDLR复合物进入细胞内溶酶体降解,导致细胞表面LDLR减少,如同一个潜在的刹车机制,参与调控胆固醇的稳态,有重要的临床意义[5]。
PCSK9不仅在与LDLR结合、增加其进入内涵体和溶酶体降解从而抑制其在细胞表面循环方面发挥着关键作用,而且可能在其他细胞类型(包括内皮细胞、血管平滑肌细胞、免疫细胞和心肌细胞)上表现出多种与LDLR无关的活性。
除了LDL-C,脂蛋白A[Lipoprotein(a),LP(a)]是心肌梗死、脑卒中和外周动脉疾病的独立危险因素。具有遗传性的LP(a),其单核苷酸多态性会增加心血管风险。研究发现,PCSK9与LP(a)水平存在正相关性,会增强LP(a)在肝脏中的分泌,其机制尚不明确。越来越多的证据表明,抑制PCSK9会降低LP(a)水平,可能与降低ApoB-100和Apo A的分泌导致LP(a)合成减少[6],以及增强 LDLR或其他肝受体对 LP(a)的摄取和清除有关[7]。
2.2 对动脉粥样硬化的作用 有研究显示,PCSK9在动脉壁组织中表达,包括巨噬细胞、内皮细胞(EC)和平滑肌细胞(SMC)等。这些细胞伴随着局部活动,可能影响关节炎患者的血管稳态和硬化症的形成[8]。SMC分泌的PCSK9能够通过巨噬细胞降解LDLR,因此,PCSK9对血管壁内LDLR水平的影响可能在血管损伤生理学中起一定作用[9]。在高脂血症状态下,外周血单核细胞进入病变部位,形成巨噬细胞,导致动脉粥样硬化的发生。动脉粥样硬化的主要症状之一泡沫细胞,是由巨噬细胞吸收脂蛋白在病变部位沉淀下来而形成。虽然LDLR可促进局部和未修饰LDL的摄入,但与清道夫受体大量脂质通道相比,LDLR摄取LDL方式对病变改善直接影响很小,而巨噬细胞LDLR可能直接参与了动脉粥样硬化形成[8]。以往研究发现,血流低切应力引起血管EC和SMC中PCSK9表达增加,并伴有活性氧(ROS)的产生。SMC衍生的PCSK9在动脉巨噬细胞表面分离LDLR,这一过程通常触发LDL在动脉壁积聚,并导致氧化型LDL(OxLDL)的形成,然后启动一个前馈循环,在细胞内产生额外的ROS,进一步影响OxLDL及与血凝素样氧化低密度脂蛋白受体(LOX-1)的结合,促进动脉粥样硬化的形成。因此,PCSK9可能以不依赖血脂水平的方式,通过释放到血浆和动脉瘤中的巨噬细胞分泌,聚集在病变中,影响斑块的组成[10-11]。这可能是另一个抑制PCSK9治疗心血管疾病的方向。
2.3 对心脏的作用 除LDL-C外,三酰甘油(TG)和脂肪酸(FA)也与心血管风险相关。FA和TG积累过多而引起心功能不全,称为心脏脂毒性[12]。心肌梗死和随后的心力衰竭发展过程中也会出现心脏脂毒性。FA是心脏主要供能物质,对心脏总ATP的产生有很大贡献。FA的主要来源是白蛋白结合游离脂肪酸和血管脂蛋白脂肪酶(LPL)释放的三酰甘油-脂蛋白水解产物。FA可通过被动扩散或相关蛋白-包括脂肪酸转运蛋白(FATP)、脂肪酸结合蛋白(FABP)和脂肪酸转座酶(FAT/CD 36)跨越肌膜,有明确的证据表明,CD 36对于游离FA转运至心肌细胞至关重要[13],也与心肌梗死(MI)后的心脏功能恢复相关。PCSK9可通过结合CD36下调心肌CD36含量和表达,进而降低FA代谢水平[14]。抑制PCSK9来上调心肌CD 36含量和表达,有利于缺血再灌注后心脏能量恢复。同时通过调节游离脂肪酸转运蛋白的表达而降低TG水平[15]。
PCSK9与梗死面积和心功能有关[16]。PCSK9在心脏缺血再灌注期间持续释放会引起严重损伤,包括细胞死亡和心功能障碍。抑制PCSK9表达对缺血再灌注后梗死面积、梗死后炎症以及心功能障碍有积极影响[16]。临床数据支持这种观点,即抑制PCSK9与降低心肌梗死、脑卒中和冠状动脉血管重建术的不良反应发生率相关,并与心血管风险增加患者的内皮功能有关[17-20]。PCSK9抑制剂对心肌梗死类型和大小有不同的影响。例如,Eventocumab可降低自发性和程序性心肌梗死的风险,但对2型(心肌供氧与需求不匹配)心肌梗死没有影响。对于更严重的心肌梗死,包括ST段抬高心肌梗死(STEMI)和心脏生物标志物升高较大的心肌梗死,Eventocumab的效果明显[21]。另一方面,他汀类联用阿利洛昔单抗可以降低2型心肌梗死事件的风险[22]。
2.4 与炎症的作用 血液PCSK9水平在败血症、脓毒血症等感染扩增全身性炎症反应中显著增加[23],提示PCSK9表达与炎症相关联。脓毒症患者血清PCSK9水平明显升高,并与随后发生的多器官功能衰竭密切相关[23]。PCSK9被认为是脓毒症发病的关键,PCSK9可能直接作用于TLR-4/NF-κB信号通道,促进炎性细胞因子释放,以及通过结合LDLR间接影响病原体脂质的清除[24]。抑制PCSK9活性则能有效地改善脓毒症的预后[25],可作为预后的生物标志物。在另一项临床试验中,至少携带有一个PCSK9功能丧失(LOF)等位基因的脓毒性休克患者在28 d内比没有携带LOF或功能增益(GOF)等位基因患者的生存率高(71.7%vs. 61.0%)[26]。同样,PCSK9 LOF变异与病原体脂质清除率提高、1年死亡率下降和脓毒症幸存者反复感染有关[25]。
PCSK9与多个炎症标志物相关联。C反应蛋白(CRP)是临床最有价值的炎症标志物,同时超敏C反应蛋白(hs-CRP)水平的异常升高预示着缺血性脑卒中和颈动脉斑块的不稳定性。Gencer等[27]进行一项针对2 030例急性冠状动脉综合征(ACS)患者冠状动脉造影的前瞻性队列研究显示,高水平的PCSK9和高水平的hs-CRP存在独立相关性。另2项研究也发现稳定性冠心病(CAD)患者血清PCSK9浓度与hs-CRP水平呈正相关[28],并且参与研究的患者至少3个月没有接受降脂药物治疗。血液中PCSK9水平还与多个慢性炎症生物标志物之间存在关联,如白细胞计数、纤维蛋白原等[29]关联无法完全通过血脂机制加以解释,详细机制仍不明确。
脂质代谢失调会诱发炎症和免疫反应,而炎症可影响脂质代谢[30]。PCSK9为炎症介质,介导炎症的发生发展。心肌缺血中PCSK9调节功能的研究表明,PCSK9激活NF-κB信号通路后,巨噬细胞分泌肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-1(IL-1β)等促炎细胞因子,加重缺氧复氧所致心肌细胞损伤[31]。PCSK9可能导致巨噬细胞和其他几种免疫细胞内胆固醇的积累,增加Toll样受体功能,并放大可能导致冠状动脉粥样硬化进展的炎症反应[32-36]。
3 PCSK9抑制剂的研究进展
鉴于其多种生理作用,研发抑制PCSK9药物具有临床意义。针对细胞内和细胞外PCSK9的多种抑制策略已经被提出[37],主要可分为阻止PCSK9与LDLR之间相互作用[单克隆抗体(mAbs)、模拟肽、Adnectins、小分子药物],和抑制PCSK9表达[反义寡核苷酸(Antisense oligonucleotides,ASOS)、小干扰RNA(siRNA)、CRISPR/Cas9基因编辑、小分子抑制剂、疫苗]和抑制PCSK9分泌(Sortilin、SEC24A、SRT 3025)。见表1。
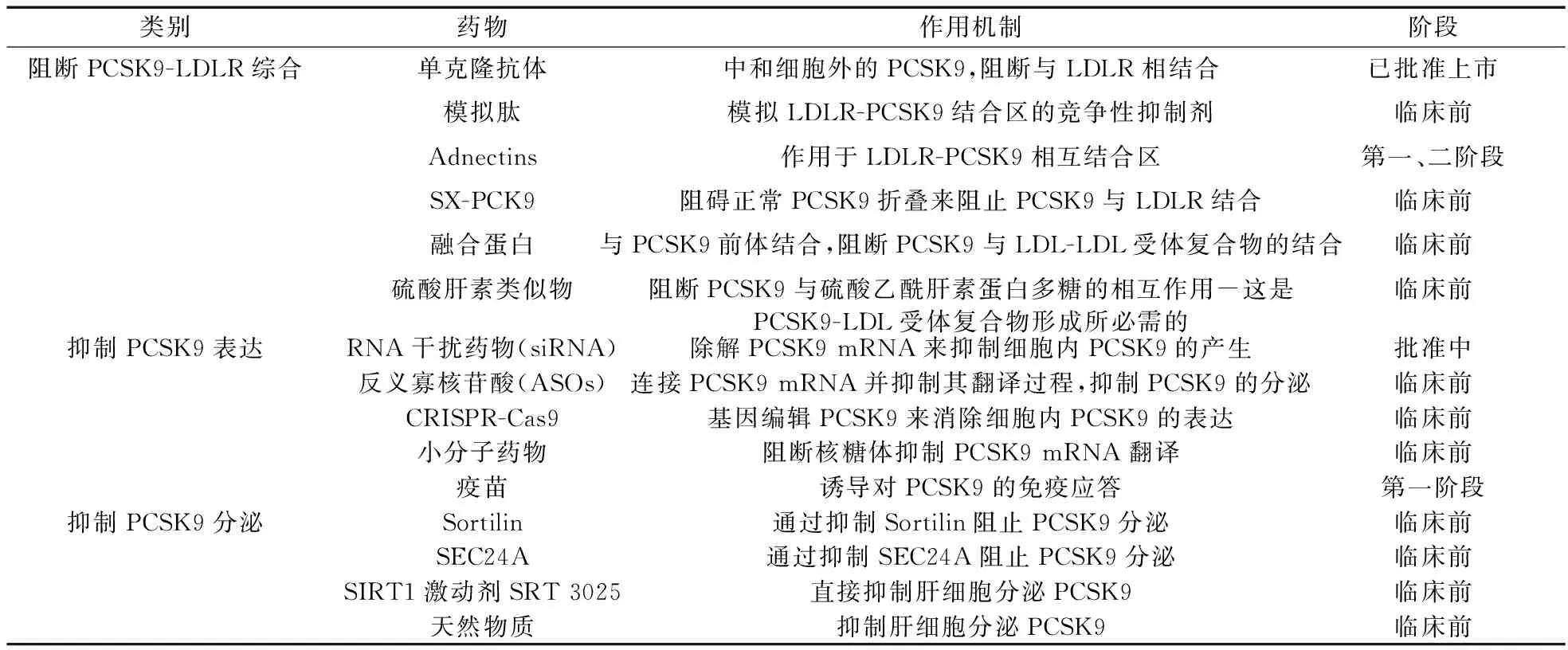
表1 国内外PCSK9抑制剂研究进展
3.1 阻止PCSK9与LDLR之间相互作用 单克隆抗体是目前最主要的PCSK9抑制剂[38-39],通过中和细胞外PCSK9,阻断其与LDLR的EGF-A结构域相结合而发挥作用。皮下注射PCSK9单克隆抗体可迅速、持续降低LDL-C水平。单独使用或者与其他降脂药物如他汀联用时,均可显著降低LDL高达60%[40]。此外,虽然PCSK9单抗与他汀类都可降低LDL-C、三酰甘油、载脂蛋白B和增加HDL-C,但PCSK9单抗可降低载脂蛋白A水平,而他汀不影响甚至略微提高载脂蛋白A水平,其机制还有待进一步研究[41-42]。PCSK9单抗可减轻不良反应,降低心血管事件和肝功能异常的发生率,改善动脉粥样硬化斑块[43]。PCSK9单克隆抗体可逆转家族性高胆固醇血症中单核细胞的促炎效应[44],改善血管炎症[45]。
另外,模拟肽通过模拟抗体与靶点部位相结合的部分,阻断PCSK9与LDLR的EGF-A结构域的结合,从而发挥抑制PCSK9的作用。Adnectin可作为单克隆抗体的替代物,阻止PCSK9诱导的LDLR降解[46]。此外,还有多种抑制PCSK9的小分子药物正在研究中[47],如影响PCSK9正常折叠来阻止其与LDLR相结合的SX-PCK9,通过与PCSK9前体直接结合减弱LDLR降解的融合蛋白,以及阻断PCSK9与硫酸乙酰肝素蛋白多糖(HSPG)相互作用的硫酸肝素类似物-HSPG是PCSK9-LDL受体复合物形成所必需的物质[48]。
3.2 抑制PCSK9表达 控制PCSK9 mRNA是抑制PCSK9表达的一种常见方法,可以通过反义寡核苷酸(ASOS)来实现,ASOS实质是一种特异性的连接mRNA并抑制翻译过程的快速核苷酸序列。第2代ASOS可使小鼠肝脏PCSK9 mRNA分泌和LDL-C水平分别降低92%和32%。此外,这种ASOS还能降低载脂蛋白B并提高载脂蛋白A1水平[49]。另外,在猴体内注射ASOS后,血清PCSK9水平降低了85%,LDL-C水平降低了50%。ASOS能够准确地匹配靶mRNA,并被特异性地传递到肝细胞,以减少目标基因的毒性或对其他组织的影响。
其他抑制mRNA的技术还有单链RNA或小干扰RNA(siRNA),这种技术是由小的类脂纳米粒包裹siRNA进行静脉注射[50],既可以降低循环中的 PCSK9 水平,还能有效降低细胞内的PCSK9水平。小鼠模型实验表明,浓缩于PCSK9的肝脏特异性siRNA,能最大限度地抑制50%~60%的mRNA表达,使血浆LDL水平降低30%。单剂量给药5 mg可使72 h后LDL-C降低56%~70%,并在几周内保持不变。临床实验显示,在第1天和第90天接受2次给药(300 mg/次)的患者,在第180天的PCSK9和LDL-C水平分别下降了69.1%、52.6%[51],安全性和耐受性良好,没有明显的严重不良反应。这些研究表明,每年仅使用1次或2次PCSK9,可能会使LDL-C水平持久而有力地降低,改善治疗依从性,减少个体差异反应。
CRISPR/Cas 9系统作为一种有用的基因组编辑工具,可以快速破坏或编辑目标基因,有效破坏小鼠肝脏中的PCSK9基因,导致血浆PCSK9蛋白水平显著降低,肝LDLR水平升高。PCSK9基因敲除小鼠血浆胆固醇水平降低35%~40%,与野生型小鼠相比,下降35%~52%。PCSK9基因组编辑技术可作为一种新策略,永久改变人类基因组,预防高胆固醇血症患者心血管不良事件,但仍然还有一些伦理、法律和安全问题等需要解决。
PCSK9疫苗是一种通过免疫系统消除内源性循环PCSK9的新策略[52]。动物实验表明,疫苗诱导了一种强大而持久的免疫反应,导致血浆PCSK9、总胆固醇、VLDL-C、LDL-C以及全身炎症水平下降[53]。但成人肝脏缺乏PCSK9表达而产生严重副作用的可能性必须排除,尤其是在肝功能受损的情况下,如病毒感染期间[54]。
3.3 抑制PCSK9分泌 Sortilin是与PCSK9具有高度亲和力的跨膜转运受体,在反式高尔基体网络(pH 6.5)中与PCSK9结合,并在分泌囊泡中(pH 5.5)释放PCSK9。Sortilin在肝脏中过度表达,增加了循环PCSK9水平,降低肝脏LDLR水平,从而提高LDL-C水平[55]。由于与PCSK9的协同关系,Sortilin可作为抑制PCSK9分泌的靶点[47],但因其多种生理功能,临床应用还有待更进一步研究。
SEC24A是一种将PCSK9从ER传送到高尔基体的蛋白。在缺乏SEC24A的小鼠中,血浆PCSK9水平降低,肝脏PCSK9水平升高,肝表面LDLR表达增加。此外,SEC24A过表达促进PCSK9分泌。抑制SEC24A功能可能是抑制PCSK9分泌的一种有效途径[47]。
SRT 3025是第3代Sirtuin-1(SIRT 1)激动剂,而SIRT1介导的信号通路在调节肝脏脂质代谢中起着重要作用[56]。SRT 3025可抑制肝细胞分泌PCSK9并降低血浆PCSK9水平,增加肝细胞中LDLR表达,降低血浆LDL-C水平和动脉粥样硬化风险[57]。使用SIRT1激动剂如SRT 3025,可作为一种新的抑制PCSK9分泌策略用于治疗动脉粥样硬化。
虽然可注射的抑制PCSK9靶向药物正在迅速发展,仍可见多种安全、具有口服活性的PCSK9小分子抑制剂的发展前景[58]。近年研究显示,天然产物(如槲皮素,具有多种生物活性的黄酮醇类化合物)具有抑制PCSK9表达、分泌的作用,尤其是在高胆固醇饮食的背景下[59]。在包括姜黄素、表没食子儿茶素没食子酸酯、大黄素和白藜芦醇等也有类似研究,机制有待进一步研究[60]。
4 小结
PCSK9 可通过多种途径调节循环血液中 LDL-C、LP(A)水平,参与动脉粥样硬化、心衰和心肌梗死等过程。此外,在糖代谢、体重并发症等方面起着中介作用[61]。在各种感染(细菌或病毒)和脓毒症中观察到PCSK9的存在,并与多种炎症标志物相关。PCSK9在大脑中的作用和特点尚不明确,但PCSK9抑制剂可能在心脏缺血/再灌注损伤后脑神经元恢复中起一定作用[62]。有研究显示,阿尔茨海默病患者的脑脊液中出现高水平的PCSK9,脑胆固醇平衡稳态对于阿尔茨海默病的治疗有积极意义[63]。尽管其对阿尔茨海默病或慢性病毒感染和脓毒症等作用还存在争议[64],PCSK9抑制剂的研发具有临床意义。临床上PCSK9抑制剂目前以单克隆抗体为主,但随着新型抑制剂的研究,期待未来会有更多高效、经济的药物供临床医生选择。

