不同来源豆类亲脂蛋白提取与理化性质研究
李 杨 方 琳 齐宝坤 谢凤英 钟明明 许顺楠
(东北农业大学食品学院,哈尔滨 150030)
0 引言
近年来,随着健康饮食等观念逐渐受到重视[1],采用植物蛋白代替动物蛋白也逐渐成为研究的热点内容[2]。迄今为止,食品科学中关于复杂系统配方的研究大多关注少数被广泛使用的蛋白质来源,如大豆等的研究。因此拓宽蛋白来源,形成多元化局面,成为当今蛋白应用和发展过程中亟待解决的问题之一[3]。
在加工大豆蛋白的过程中主要提取的组分是大豆分离蛋白(Soybean protein isolate,SPI),长期以来,研究者们普遍认为SPI主要由大豆球蛋白(11S)和β-伴大豆球蛋白(7S)两种组分构成[4]。然而近几年,通过精细化加工调节脱脂豆粕水溶液的pH值,逐步分离出3个组分:11S蛋白、大豆亲脂蛋白(Soybean lipophilic protein,SLP)和7S蛋白。因此,SPI的功能特性也应该基于这3种蛋白质组分的性质来重新考虑。
黑豆是大豆中的一个分支,在成分组成、性质和结构功能等方面都与大豆相类似[5]。尤其在脂肪和蛋白质含量及比例上较为相似。亲脂蛋白在豆类中的存在多与脂类相关,所以适当的脂类含量有利于亲脂蛋白组分的存在,因而将黑豆作为制备黑豆亲脂蛋白(Black bean lipophilic protein,BLP)的新来源,相比于其他豆类在提取工艺和应用等方面更具有优势[6-7]。绿豆中蛋白质含量高于小麦、玉米、水稻等常见的粮食作物[8-9]。另外,其氨基酸种类相对齐全,不同种类氨基酸的含量比例也更适于人体吸收和利用。但是目前对于绿豆的研究,主要集中在对淀粉的研究上,对于其中的蛋白组分并没有重视[10-11],类比于大豆、黑豆亲脂蛋白的提取,绿豆亲脂蛋白(Mung bean lipophilic protein,MLP)的提取增加了亲脂蛋白的来源,也为绿豆蛋白的工业加工提供了新的思路。豌豆在豆类生产总量中的占比最大,为36%。但是由于豌豆蛋白的性质相对较差,疏水性、溶解度、乳化性等性质方面的不利因素导致了豌豆蛋白在实际应用过程中受到了阻碍[12]。针对以上问题,豌豆亲脂蛋白(Pea lipophilic protein,PLP)组分的含量与蛋白质的亚基结合方式、疏水性基团的含量和分布等关系有待被进一步研究。
亲脂蛋白作为分离蛋白中的贮藏蛋白之一,其功能性质在分离蛋白功能性质表现上起到了一定作用,如作为表面活性剂,亲脂蛋白中的磷脂成分使蛋白与脂类物质相互结合变得更加容易,提高油水界面张力,起到稳定界面的能力,促进乳状液的形成和稳定。目前有关亲脂蛋白的相关研究仅停留在大豆亲脂蛋白的提取和应用,而在黑豆、绿豆和豌豆中的亲脂蛋白尚未有相关研究,多数研究仅包含3种豆类中的分离蛋白相关理化性质和改性处理对蛋白的影响,因此本文分别从大豆、黑豆、绿豆、豌豆4种豆类中提取亲脂蛋白,并利用电泳、热性质、表面性能和二级结构等对提取出来的不同来源的亲脂蛋白进行表征,从而拓宽亲脂蛋白来源,进一步分析蛋白组分,使每一组分得到充分利用,也为黑豆、绿豆和豌豆在蛋白领域的加工和利用提供新思路。
1 材料与方法
1.1 材料与试剂
大豆,东农42号,市售;黑豆,齐黑1号,市售;绿豆,绿丰5号,市售;豌豆,中豌2号,市售;正己烷,分析纯,500 mL,天津市富宇精细化工有限公司;亚硫酸钠,分析纯,淄博永业精细化工股份有限公司;氯化钠,分析纯,500 g,天津市科密欧化学试剂有限公司;氢氧化钠,分析纯,500 g,天津市科密欧化学试剂有限公司;硫酸,98%,山东东佳集团股份有限公司;氯仿,分析纯,500 mL,广东予能实验室设备科技有限公司;甲醇,分析纯,500 mL,天津市科密欧化学试剂有限公司;磷酸二氢钠、磷酸氢二钠,分析纯,天津市东丽区天大化学试剂厂;聚丙烯酰胺凝胶电泳试剂盒,GB/T 23528,河南兴鼎化工产品有限公司。
1.2 仪器与设备
HH8型恒温水浴锅,常州市凯航仪器有限公司;制备型冷冻干燥机,宁波新芝生物科技股份有限公司;离心管,济南来宝医疗机械有限公司;傅里叶变换红外光谱仪,赛默飞世尔科技(中国)有限公司;rapid MAX N exceed型杜马斯定氮仪,关河仪器设备(上海)有限公司;电泳仪,美国伯乐公司;F98型荧光分光光度计,上海棱光技术有限公司;JC-1086A型多功能酶标分析仪,浙江聚创智能科技有限公司;DTA型热重热差分析仪,北京赛思蒙仪器有限公司;湘仪式离心机,湘仪离心机仪器有限公司;SL200L型视频光学接触角测量仪,美国科诺工业有限公司;UV-5100型高性能紫外-可见分光光度计,上海奥析科学仪器有限公司。
1.3 方法
1.3.1大豆亲脂蛋白提取
参考文献[13]的方法并进行改进,提取大豆亲脂蛋白。大豆磨粉,过120目筛,向过筛后的大豆粉以液料比4 mL/g加入正己烷,螺旋桨搅拌1 h后静置,待大豆粉完全沉降,进行固液分离并干燥,沉淀组分即为脱脂大豆粉。将脱脂大豆粉与水以液料比8 mL/g混合,调节pH值至8,用螺旋搅拌桨搅拌1 h,以4 000 r/min的转速离心15 min,取上清液加入10 mmol/L的亚硫酸钠,并调节pH值至5.8,同等条件下离心15 min,取清液调节pH值至5.0,加入50 mmol氯化钠,在55℃下保温15 min,取出保温后的溶液调节pH值至5.5,再离心15 min,取沉淀组分进行冻干,即得到大豆亲脂蛋白。
1.3.2黑豆亲脂蛋白提取
参考文献[14]的方法并进行改进,提取出黑豆分离蛋白,并进一步处理得到黑豆亲脂蛋白,具体操作如下:黑豆磨粉过120目筛,粉碎后的黑豆以液料比6 mL/g加入正己烷,磁力搅拌1.5 h后静置,待黑豆粉完全沉降,沉淀组分加热干燥后即可得到脱脂黑豆粉。将脱脂黑豆粉与水以液料比11.93 mL/g混合,调节pH值至8.5,搅拌1 h混合均匀,以7 500 r/min的转速离心20 min,取上清液调节pH值至5.8,同等条件离心20 min取上清液调节pH值至4.9,在55℃下保温20 min后调节pH值至5.6,离心20 min,取沉淀物进行冻干,得到黑豆亲脂蛋白。
1.3.3绿豆亲脂蛋白提取
参考文献[15]的方法并进行改进,提取出绿豆分离蛋白,并进一步处理得到绿豆亲脂蛋白,具体操作如下:将绿豆磨粉,过120目筛,按照液料比5 mL/g加入正己烷,搅拌均匀并静置,进行脱脂,得到脱脂绿豆粉后干燥。将脱脂绿豆粉与水以料液比15 mL/g加入,调节pH值至10.0,搅拌均匀在40℃下恒温水浴30 min,后在7 500 r/min条件下离心20 min,保留上清液并调节pH值至5.8,离心取上清液调节pH值至5.0,在60 ℃下保温20 min,取出后调节pH值为5.5,离心15 min,得沉淀组分进行冻干,即得到绿豆亲脂蛋白组分。
1.3.4豌豆亲脂蛋白提取
参考文献[16]的方法并进行改进,提取出豌豆分离蛋白,并进一步处理得到豌豆亲脂蛋白,具体操作如下:将豌豆置于磨粉机中粉碎,过120目筛,按照液料比4 mL/g加入正己烷,用磁力搅拌器搅拌均匀,静置1 h,取沉淀脱脂豌豆粉干燥2 h。将豌豆粉溶于25倍的水中,用氢氧化钠调节pH值至9.0,在50℃下恒温水浴1 h,在4 000 r/min下离心30 min,取上清液调节pH值至5.8,离心取上清液在50℃下保温30 min,调节pH值至5.0,离心20 min,取沉淀组分进行冻干,得到豌豆亲脂蛋白组分。
1.3.5不同来源亲脂蛋白中组分测定
杜马斯定氮:实验参照NY/T 2007—2011《谷类、豆类粗蛋白质含量的测定杜马斯燃烧法》方法,使用杜马斯分析仪定量测定提取物中蛋白质含量。称取30~50 mg试样置于专用锡箔中,压紧成饼状并置于自动落样盘上。样品在氦气和氧气的条件下于左炉 950℃中充分燃烧,然后进入右炉 840℃,氧化还原管中自动净化,设置柱温50℃,载气300 mL/min,分析时间10 min,进样延迟时间12 s,净化后的产物进入热岛池,测定结果于FLASH 4000 系统软件中自动计算并打印结果。
脂质含量的测定:根据文献[13]的方法测定SLP、BLP、MLP和PLP粉末的脂质含量。将粉末加入10倍质量的氯仿-甲醇(体积比2∶1)溶剂中,并在50℃下搅拌2 h。将提取的溶液转移到离心管中,在1 470g下离心30 min。离心后,回收上层,剩余固体用氯仿-甲醇溶剂洗涤。所有提取的溶液被汇集、蒸发,并用氮气固化,然后测量质量。脂质含量以质量分数表示。
1.3.6十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
参考文献[17]的方法并进行改进。分析前将SLP、BLP、MLP和PLP沉淀冻干。将样品与含有0.5 mol/L Tris-HCl缓冲液、2%十二烷基硫酸钠、20%甘油和0.001%溴酚蓝(BPB)的电泳样品缓冲液混合,pH值为6.8。向样品缓冲液中添加5%的2-巯基乙醇(2-ME)。将样品和缓冲液的混合物在沸水中加热5 min,并在9 000g、4℃条件下离心5 min。将等分试样装入15%的凝胶梳孔中。电泳缓冲液配比为0.025 mol/L Tris HCl、0.192 mol甘氨酸和0.001 g/mL的SDS(十二烷基磺酸钠)。电泳后得到的凝胶用考马斯亮蓝R-250染色30 min,脱色液脱色洗涤,静置12 h。
1.3.7差示扫描量热法
采用文献[18]的方法并改进,测定4种蛋白的热变性温度。称取5~8 mg的SLP、BLP、MLP和PLP粉末。使用DSC-60型差示扫描量热仪,以1℃/min的扫描速率在20~120℃的范围内进行差示扫描量热(DSC)测量。水用作参考。使用TA-60WS型热分析系统软件测定变性峰温度。
1.3.8傅里叶变换红外光谱
参考文献[17]的方法并进行改进。将SLP、BLP、MLP和PLP置于含P2O5的干燥器中保存14 d以上去除水分。将无水分的分离物放在ATR晶体上并向下压以确保良好的接触。用干燥空气连续吹扫光谱仪。记录在波段600~4 000 cm-1范围内的光谱(分辨率4 cm-1下的平均值),并以空池为参照。使用peakfit软件对光谱进行傅里叶自解卷积(FSD)、二阶导数(SD)分析和曲线拟合程序,以定位酰胺Ⅰ(1 600~1 700 cm-1)区域中的重叠峰。以蛋白不同二级结构的相对含量为依据,通过计算给予酰胺Ⅰ区特定亚结构的光谱成分(高斯峰)的面积确定。
参考文献[19]的测定方法并进行改进,进一步验证二级结构的相似性。将SLP、BLP、MLP和PLP粉末分别放置在显微镜下,对准焦距后,采集样品的拉曼光谱。拉曼光谱仪参数为曝光时间10 s;激光功率35 mW;采集光谱范围200~1 800 cm-1。利用商业化的高斯(Gaussian)程序包和ADF程序包,计算4种蛋白的拉曼光谱。计算方法主要用密度泛函理论(Density functional theory,DFT)。
1.3.10表面性能测定
参考文献[20]的测定方法,对4种蛋白与水相关的表面学性能进行测定。
溶解度:将4种蛋白分散在水中,形成质量分数2%的溶液,搅拌1 h,9 000 r/min离心15 min,采用BCA法测定蛋白含量。
表面疏水性:取上述离心后的上清液,用PBS稀释至质量浓度为0.005、0.01、0.02、0.04、0.06、0.08、0.1 mg/mL,将所得梯度溶液与8 mmol/L ANS(以体积比100∶1)混合,静置3 min后测定荧光强度,激发光波长390 nm,发射光波长497 nm,狭缝5 nm,以荧光强度对蛋白质量浓度作图,初始斜率为蛋白分子的表面疏水性指数。
表面张力:将上述蛋白溶于水,以500 r/min的转速磁力搅拌得到4种蛋白质量分数为1%的溶液,在视频光学角仪器下测定表面张力。
乳化性:参考文献[21]的方法,取15 mL 0.01 g/mL待测蛋白溶液(样品蛋白溶于pH值为7.0的0.2 mol/L的磷酸盐缓冲溶液中),加入金龙鱼大豆油5 mL,在室温(20℃)下,用均质机以10 000 r/min的速度搅拌1 min,迅速从底部取样,用0.001 g/mL的十二烷基磺酸钠(SDS)溶液将其稀释100倍,然后在波长550 nm处测定其吸光度A550,记为A0。搅拌30 min后取样用SDS稀释,重复上述操作,测定30 min时的吸光度A30,同时采用SDS溶液作为空白对照。
乳化活性指数(EAI)计算公式为
通过Langmuir方程计算出不同压力下储层饱和吸附气体时的气体含量,如图1所示,饱和气体吸附体积随压力增加而增加,当压力超过15 MPa后,气体含量增加幅度逐渐减小。然后使用式(2)计算不同气体含量(包括相对应的压力)时的平均密度和平均体积模量,计算结果如图2所示,可以看出,平均密度和平均体积模量都随着气体含量增加而减小,其中平均密度减小幅度较小,而平均体积模量的减小量在初始吸附气体时下降较快,之后下降量逐渐减缓。
(1)
式中EAI——乳化活性指数,m2/g
N——稀释倍数
θ——油相体积分数
C——蛋白质质量浓度,g/mL
L——比色皿中光路长度,取1 cm
乳化稳定性指数(ESI)计算公式为
(2)
式中ESI——乳化稳定性指数,min
At——时间t时的吸光度
t——时间,取30 min
1.3.11数据处理与分析
实验数据采用SPSS 22.0分析软件和Origin 8.0软件进行处理,采用方差与邓肯分析对数据进行差异显著性分析(P<0.05)。所有实验均重复3次,结果取平均值或平均值±标准差。
2 结果
2.1 组分测定
对4种来源亲脂蛋白组分含量进行测定,结果如表1所示。从测定结果来看,提取出来的亲脂蛋白中脂类含量与原料中的脂类含量无关,按照1.3.1~1.3.4节中的方法进行提取后,每种亲脂蛋白中残留的脂类质量分数保持在13%~14%之间,且由品种带来的差距较小。一般情况下,为除去豆类中的脂类多采用正己烷进行处理,但是正己烷只能除去其中大部分的极性脂,而对于某些中性脂却无法脱除,导致蛋白产品纯度较低,且这部分残留脂类也会对亲脂蛋白的性质产生影响,如溶解性降低、疏水性升高等。因此,为提高亲脂蛋白中蛋白组分的含量,本文进一步采用氯仿-甲醇溶剂对亲脂蛋白组分进行脱脂处理,然后再进行冻干操作以期提高产物中蛋白质组分的含量。

表1 不同来源亲脂蛋白组分中各组分质量分数Tab.1 Determination of contents of lipophilic proteins from different sources %
2.2 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳
根据文献[13]的实验结果可知亲脂蛋白组分的相对分子质量主要分布在75~100 kDa之间,图1中从左到右分别为按照上述方法提取出来的SLP、BLP、MLP和PLP。从图1中可以看出,SLP组分中主要成分分布在75~100 kDa附近,与文献[10]实验结果的描述保持一致。从图1中可见,BLP在75~100 kDa之间有一明显条带,与亲脂蛋白中主要组分保持一致。与SLP的电泳条带相比,BLP的电泳条带在63 kDa附近的一条较大豆更为明显,说明在黑豆中这一分子量的蛋白含量比大豆中高。在MLP的电泳条带中,75~100 kDa之间有一条条带,但分子量略大于常见亲脂蛋白组分,可能是由于MLP在亚基结构中亲水性基团含量相对较高,使得整体蛋白组分分子量偏高,这与疏水性的结果保持一致。PLP的电泳条带在典型亲脂蛋白75~100 kDa之间有两条条带,造成这一结果可能的原因是组成亲脂蛋白的亚基在提取出来后进行凝胶电泳的过程中,两个亚基的分离不平衡,本应是两个分子量相近的亚基由于其中某些基团连接得相对紧密,无法通过电泳实验的操作进行完全分离。因此,本应平均分为两个相同分子量的蛋白组分被分成了两个处于75~100 kDa之间的蛋白条带。此外,由于亲脂蛋白中磷脂的存在导致在染色过程中其对考马斯亮蓝不敏感,因此凝胶电泳图当中条带颜色的深浅与蛋白中磷脂含量的多少存在一定关联。从图1中可看出,大豆和绿豆亲脂蛋白条带显色程度相近,而黑豆和豌豆的条带颜色深浅接近,这与蛋白组分测定中脂类含量测定的结果相一致,磷脂含量越高,被脱除后,蛋白所占比例越高,电泳条带越明显。
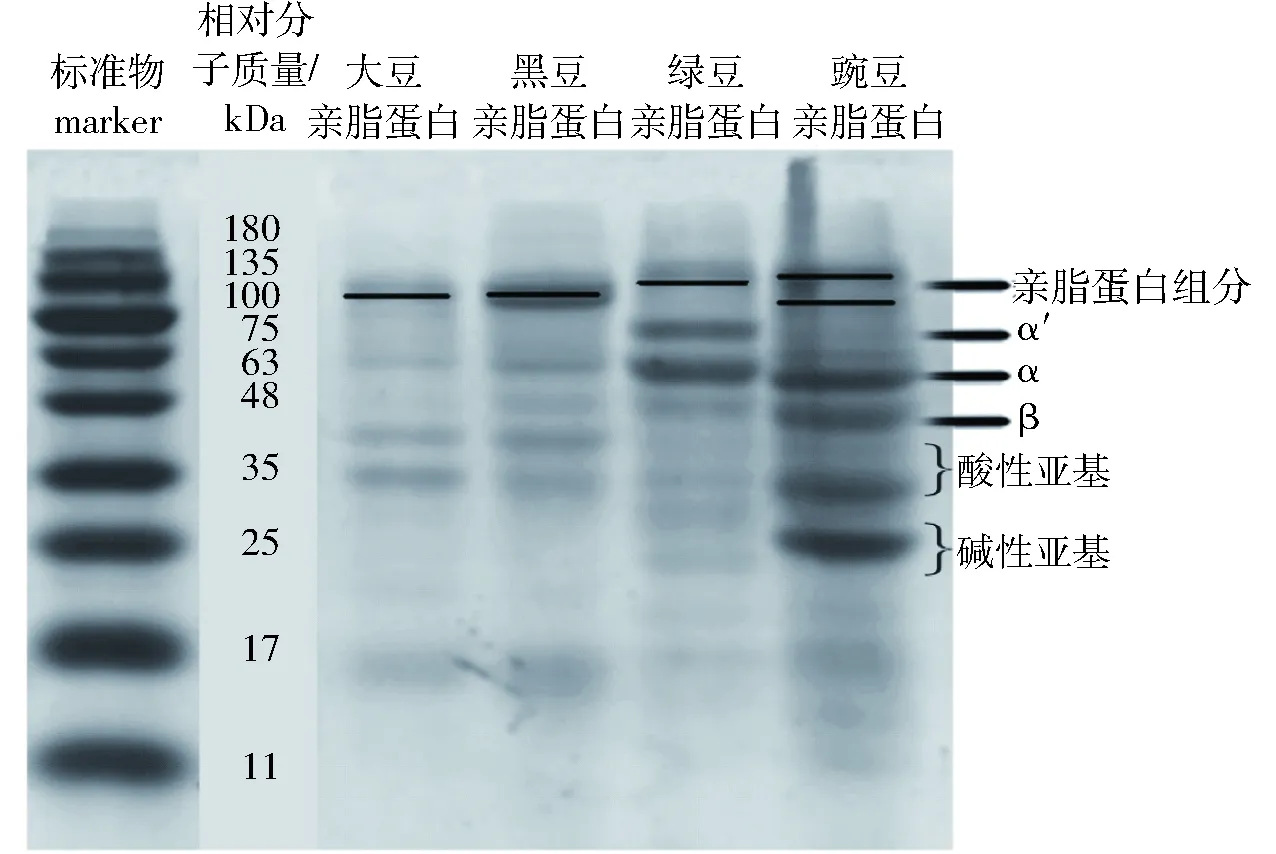
图1 不同来源亲脂蛋白SDS-PAGEFig.1 SDS-PAGE of lipophilic proteins from different sources
2.3 差示扫描量热
根据差示扫描量热图可知,样品温度从20℃到120℃变化的过程中SLP与MLP的质量分数变化规律相似,这一结果与两种亲脂蛋白疏水性相似的结果保持一致,证明SLP与MLP的疏水性基团在含量和暴露程度上基本保持一致[22]。BLP在同等温度变化条件下质量分数变化率较小,主要原因可能是黑豆中β-折叠含量较高,功能性基团暴露程度低,所以随温度提高的质量分数变化较小。而PLP的测定结果与BLP恰恰相反。根据图2可知,4种亲脂蛋白的热流量吸收峰值对应的温度为变性温度,因此4种蛋白的变性温度分别为60.23、61.21、65.00、73.86℃。从变性温度来看,SLP和BLP相似性最高,其原因在于黑豆从生物学角度分析与大豆最为相近,因此,在进行亲脂蛋白提取时得到的产物从多数性质和功能上看应为最相似,但仍然存在差异[23]。MLP和PLP的变性温度略高于SLP和BLP,主要与蛋白结构中β-转角含量有关。β-转角含量越高,蛋白的变性温度越高,且β-转角含量的微量变化也会引起变性温度的极大改变[24]。
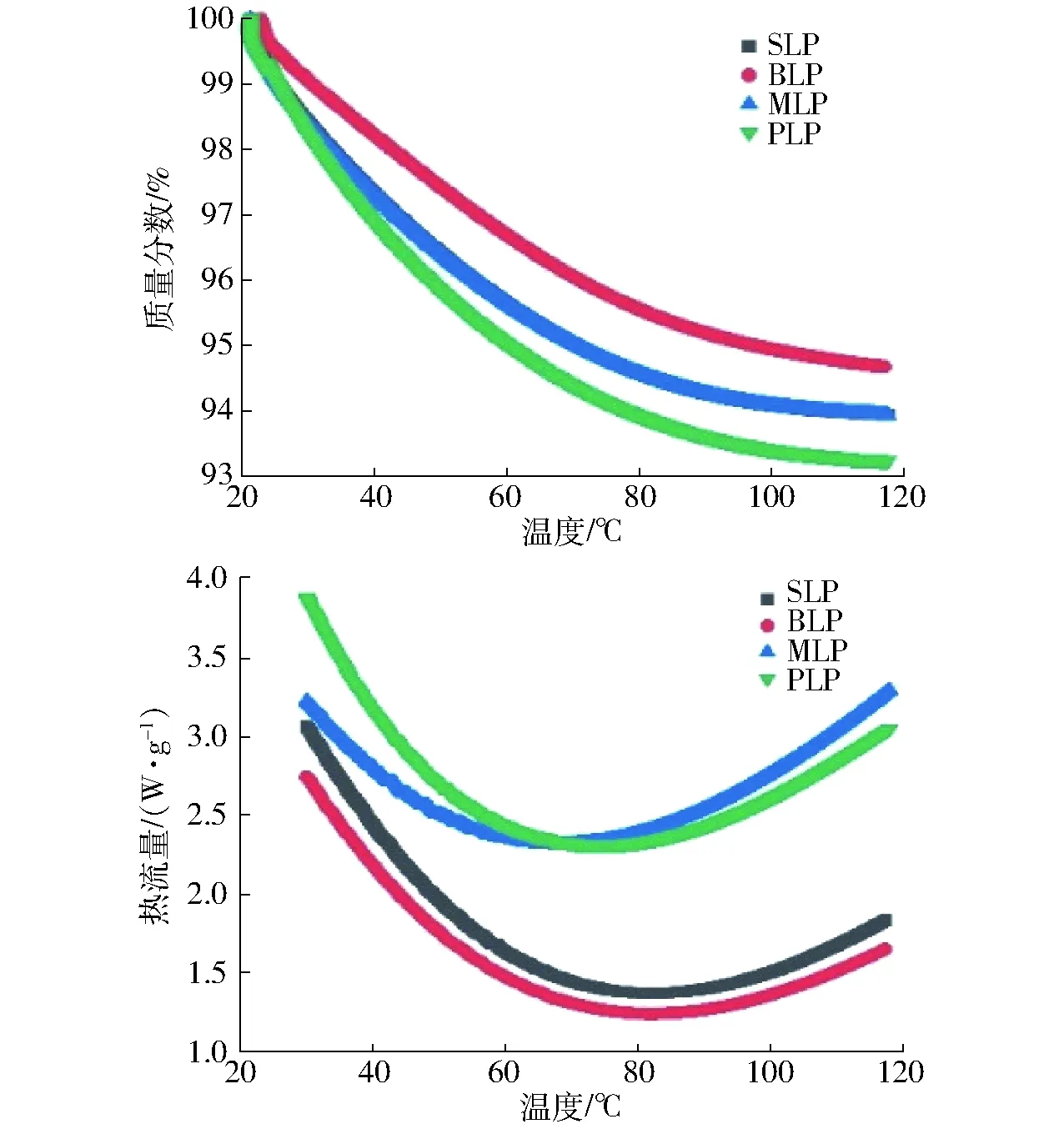
图2 不同来源亲脂蛋白热重热差分析图Fig.2 TDA of lipophilic proteins from different sources
2.4 傅里叶变换红外光谱
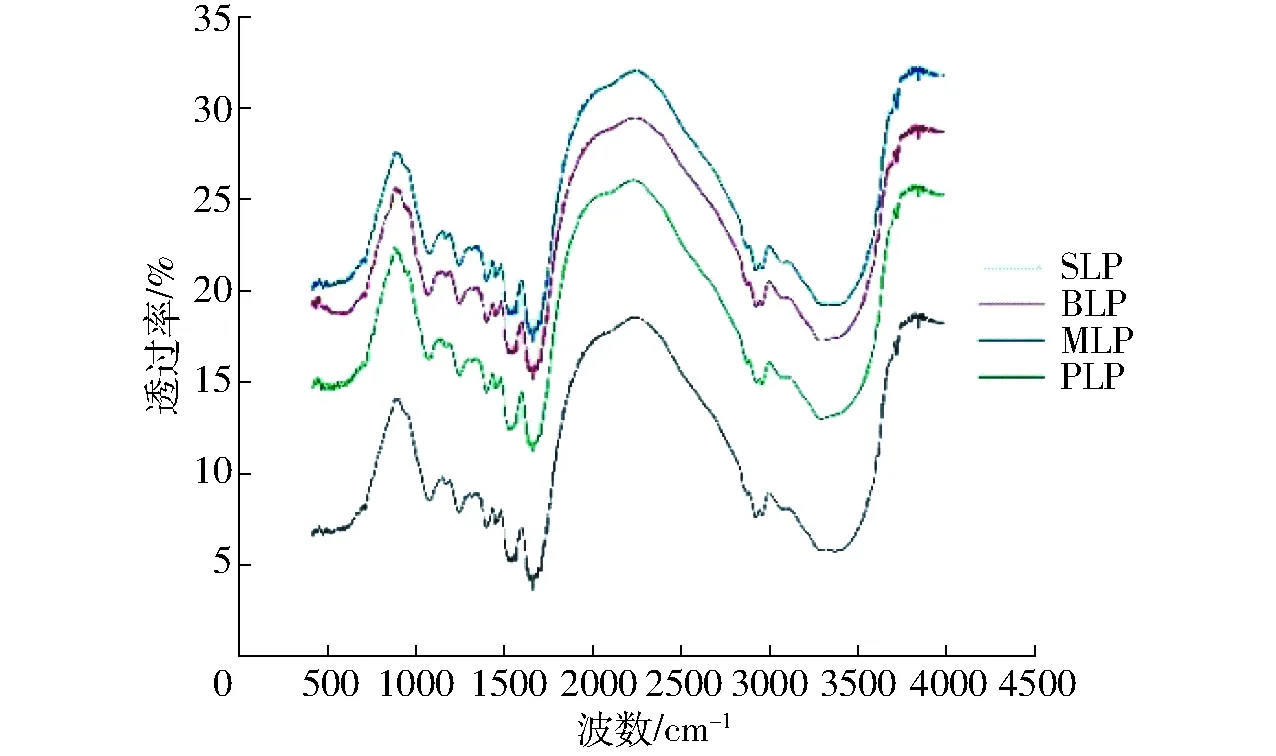
图3 不同来源亲脂蛋白红外光谱图Fig.3 Infrared spectrogram of lipophilic proteins from different sources
亲脂蛋白中二级结构主要包括α-螺旋、β-折叠和β-转角3种,这3种结构主要通过碳链骨架上的羰基和酰胺基团之间形成的氢键维持,因此可通过这3种结构的含量了解蛋白质中氢键作用力和维持蛋白质结构稳定性的能力[25]。蛋白质在形成立体结构时,肽链首先形成α-螺旋和β型结构,而后随着蛋白质在修饰过程中受到的外界作用逐渐转变为4种主要二级结构构象,即α-螺旋、β-折叠、β-转角和无规则卷曲[26]。从图3和表2来看,SLP和BLP中无规则卷曲含量相对较少,而β-折叠含量较高,证明SLP和BLP中氢键含量较高,因此在稳定性上优于MLP和PLP。根据表2也可认为在蛋白质修饰加工过程中,MLP和PLP中部分β-折叠结构转变成为无规则卷曲,因而在含量上有所降低,稳定性也存在差异[27]。SLP、BLP与MLP、PLP相比α-螺旋含量高而β-转角含量低,但两种结构之间保持总量的稳定,而存在个体差异。
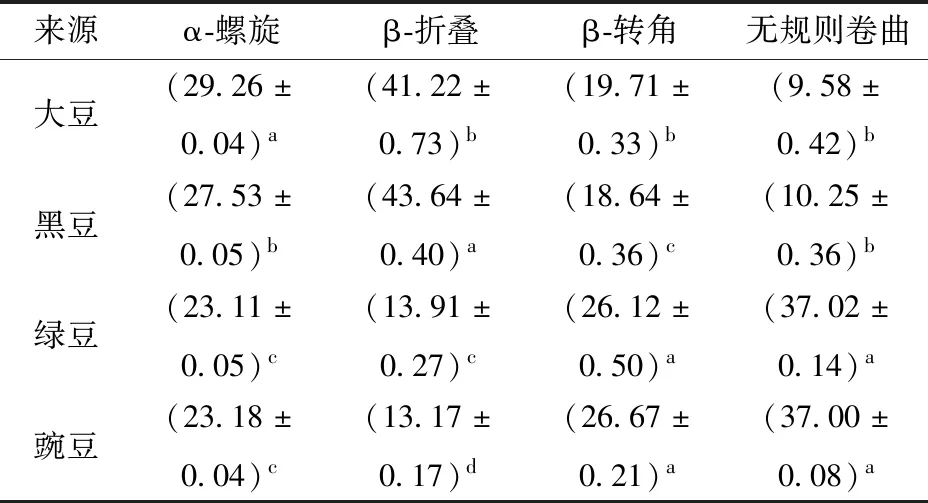
表2 不同来源亲脂蛋白中各二级结构相对含量Tab.2 Content of secondary structure in lipophilic proteins from different sources %
2.5 拉曼光谱
由拉曼光谱结果可知,从整体上看SLP和MLP在三级结构组成上相似,BLP和PLP的三级结构含量相似,而4种亲脂蛋白所含有的基团在种类上保持一致,而在含量上存在差异。图4中位移750~1 000 cm-1处出现第1个峰,在此范围内主要代表C—S键,证明在4种蛋白中均存在一定量的二硫键,且在BLP和PLP中二硫键的含量高于SLP和MLP。位移1 250~1 500 cm-1处出现第2和第3个较为明显的峰,主要体现蛋白中存在的R基、甲基和含氮基团,与BLP和PLP相比,SLP和MLP中第3个峰值较小,证明在SLP和MLP中含氮基团含量较少,与电泳中条带的分离、蛋白展现出更多氮端结构等结果保持一致[28]。位移1 600 cm-1处存在第4个较为明显的峰,此为N—N双键的峰值范围。从图中可知BLP中N—N双键的峰面积大于SLP、MLP和PLP,证明在BLP中含氮基团含量高于其他3种亲脂蛋白,且N—N双键键能较高,因此黑豆亲脂蛋白在结构稳定性上优于其他3种蛋白。位移2 000~2 250 cm-1和位移2 500~2 600 cm-1区域主要表示C—N三键和巯基。在这部分区域中BLP和PLP的峰面积明显大于SLP和MLP,因此BLP和PLP的稳定性较另外两种亲脂蛋白高[29]。从巯基对应的拉曼区域峰面积来看,MLP和PLP的巯基含量较高,因此部分结构以游离巯基形式存在,而未形成二硫键,与电泳测定中蛋白组分条带发生分离的结果保持一致。
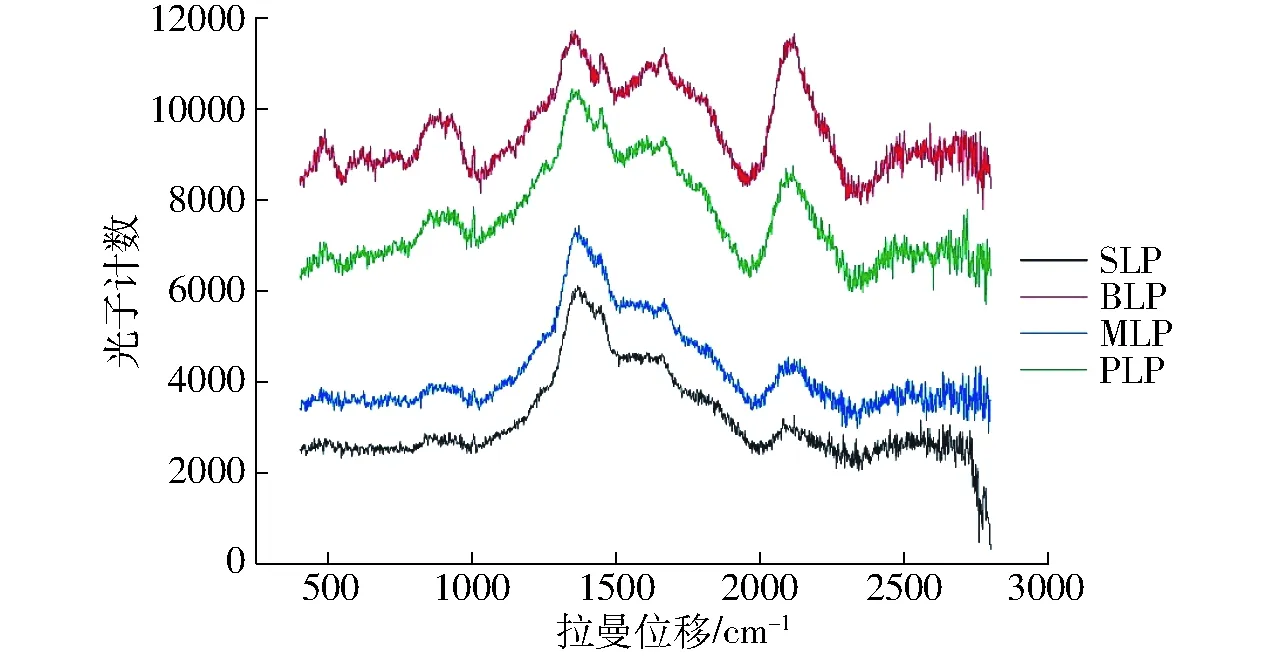
图4 不同来源亲脂蛋白拉曼光谱Fig.4 Raman spectra lipophilic proteins from different sources
2.6 表面性能测定
2.6.1溶解度
通过测定4种豆类来源的亲脂蛋白吸光度,并在同一浓度条件下进行比较发现,不同来源亲脂蛋白吸光度相似。根据计算得到SLP、BLP、MLP和PLP的溶解度分别为2.313、2.092、1.492、1.545 mg/mL,由此可知SLP和BLP结果相近,而MLP和PLP在同一浓度条件下结果也相似[30]。因此可以说明BLP和SLP在基团组成及结构分布上存在相似性,而MLP和PLP在这两方面上也相似,这与红外光谱测定的结果保持一致。
2.6.2表面疏水性
以每种豆类在不同浓度条件下测定的荧光强度为纵坐标,以质量浓度为横坐标作图,得到曲线的初始斜率为相应亲脂蛋白分子的表面疏水性指数。其中BLP和MLP疏水性相似,SLP疏水性最小,PLP疏水性最大。计算得到SLP、BLP、MLP和PLP的R2分别为0.999 2、0.997 4、0.999 3和0.992 4,证明每种蛋白组内数据测定结果可靠。稀释中水合作用对蛋白溶解度影响较小。而同一浓度、不同来源亲脂蛋白在表面疏水性这一性质上却存在显著性差异,这与不同来源豆类中含硫氨基酸以及疏水性结构的暴露程度之间存在关系[31-32]。由表3可知,BLP和 MLP疏水性相似,虽然与SLP疏水性存在一定差异,但是总体上差异不显著。PLP疏水性指数最大,原因在于豌豆中疏水性基团暴露相对明显,亲脂蛋白由两个部分分子量有差异的疏水性亚基组成,使得豌豆亲脂蛋白的疏水基团暴露得更加充分,与电泳中两条条带的分离结果一致。
2.6.3表面张力与乳化性
通过测定质量分数为1%的4种蛋白的表面张力和乳化性,发现大豆和黑豆中的亲脂蛋白组分表面张力无显著差异,而绿豆和豌豆蛋白溶液的表面张力与其他两种豆类之间存在显著差异,这一结果与4种蛋白表面疏水性的测定结果保持一致,因此通过表面学性能测定的结果可以证明,亲脂蛋白组分在低浓度条件下即存在较强的界面稳定性[32],可以作为一种优良的食品级乳化剂应用。
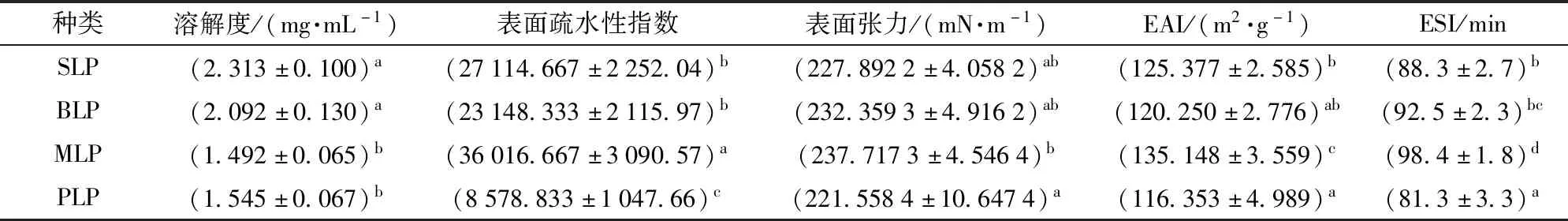
表3 不同来源亲脂蛋白表面学性能测定结果Tab.3 Determination of surface properties of lipophilic proteins from different sources
3 结束语
依据4种来源豆类,首先分离相应豆类的分离蛋白,再从相应的分离蛋白中提取该种豆类的亲脂蛋白组分。从实验结果来看,SLP与BLP在多数指标中性质都保持相近,而MLP和PLP的性质相似。但这两组之间存在较为显著的差异。提取出的SLP、BLP、MLP和PLP中的蛋白质量分数均在80%以上,同时与大豆亲脂蛋白中最为相似的是BLP,MLP和PLP也同样存在13%左右的脂类。4种蛋白组分在表面学性能、组分含量、二级结构等方面性质相似但含量不同。所提取的4种亲脂蛋白组分,为4种豆类的深加工提供了新的方向和思路。

