帕瑞昔布钠对胸腔镜下肺癌手术患者镇痛效果、血清炎症因子及氧化应激反应的影响
吴瑞阳 韩灵龙 栗付民
胸腔镜下肺叶切除术是治疗肺癌的有效术式[1],其具有切口小、手术时间短、疼痛轻等优势,但是术中由于受到单肺机械通气时间长、高气道压、低氧血症、手术应激性等多种因素的影响[2],会激活炎性细胞,出现全身炎症反应,也会增强机体氧化应激反应,而增加术后肺损伤等肺部并发症发生风险[3],对患者术后康复产生不利影响。因此在患者围术期积极调控炎症因子水平,降低氧化应激水平显得尤为重要。帕瑞昔布钠属于昔布类镇痛药,为环氧合酶⁃2(cyclooxygenase⁃2,COX⁃2)特异性抑制剂帕瑞昔布的前体,具有抗炎作用。本文分析了帕瑞昔布钠对胸腔镜下肺癌手术患者镇痛效果、血清炎症因子及氧化应激反应的影响,旨在为术后肺损伤等并发症的预防提供参考,现报告如下。
1 资料和方法
1.1 一般资料
本研究收集了本院2020年8月至2021年7月收治的84 例肺癌患者,纳入标准:①所有患者均经临床检查确诊为原发性肺癌,均择期进行胸腔镜下肺叶切除术,均符合手术适应证;②所有患者1 s用力呼吸容积(FEV1)/用力肺活量(FVC)超过70%;③所有患者的病历资料齐全。排除标准:①既往存在胸科手术史或肺部手术史的患者;②存在严重器质性疾病、血液系统疾病、感染性疾病、肝损伤、消化道溃疡的患者;③存在其他部位恶性肿瘤的患者;④存在难以控制高血压的患者;⑤术前接受过放化疗、免疫抑制药物治疗的患者;⑥对非甾体类抗炎药物过敏的患者。采用随机数字表法分为研究组和对照组各42 例。研究组中男性28 例,女性14 例;年龄平均(62.25±3.34)岁;BMI 平均为(24.42±1.80)kg/m2;美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级[4]:Ⅱ级患者29 例,Ⅲ级患者13 例;病变位置:左侧24 例,右侧18 例;肺癌分期[5]:Ⅰ期16例,Ⅱ期26 例。对照组中男性26 例,女性16 例;年龄平均(63.18±2.27)岁;BMI 平均为(24.36±1.72)kg/m2;ASA 分级[4]:Ⅱ级28 例,Ⅲ级14 例;病变位置:左侧22 例,右侧20 例;肺癌分期:Ⅰ期15 例,Ⅱ期27 例。两组患者性别、年龄、病变位置、肺癌分期等一般资料比较差异无统计学意义(P>0.05)。所有研究对象均签订知情同意书自愿参与本次研究,并且研究内容经单位所在医学伦理委员会审核批准。
1.2 方法
两组患者在术前禁食12 h,禁饮4 h。在进入至手术室后,开启心电监护仪和建立静脉通路,密切监测患者的生命体征。研究组分别在麻醉诱导前20 min 及术后12 h 静脉推注帕瑞昔布钠,严格按药品说明的推荐剂量给药,常规剂量为40 mg,对于体重低于50 kg 的老年患者剂量为20 mg。对照组分别在麻醉诱导前20 min 及术后12 h 静脉推注同容量生理盐水。胸腔镜下肺叶切除术中静脉滴注依托咪酯0.3 mg/kg、咪达唑仑0.05 mg/kg、顺式阿曲库铵0.15 mg/kg、舒芬太尼0.3 μg/kg 进行麻醉诱导,将双腔支气管导管插入,双肺隔离术后将气管导管固定,与麻醉机相连接进行机械通气,根据患者的实际情况设置氧流量、氧浓度等参数。麻醉维持:每小时持续静脉泵入丙泊酚3~6 mg/kg,切皮前追加舒芬太尼0.3~0.5 μg/kg,顺式阿曲库铵4~6 mg 间断静注,将脑电双频指数(BIS)控制在40~60。术后两组患者均采用舒芬太尼静脉自控镇痛泵镇痛,负荷量、按压单次给药量分别为1 mL、1 mL,持续输注速度、锁定时间依次为2 mL/h、15 min。
1.3 评价指标及判定标准
记录手术时间、术中出血量、单肺通气时间、镇痛泵按压次数及肺部并发症发生情况。分别于术后2、6、12、24 h 采用视觉模拟评分法(visual an⁃alogue scale,VAS)[6]评估疼痛程度,10 分制,0 分表示无痛,轻度疼痛为1~3 分,中度疼痛为4~6 分,重度疼痛为7~10 分,分值与疼痛程度呈正相关。分别于麻醉诱导开始即刻(T0)、术毕(T1)及术后12 h(T2)、24 h(T3)采集患者颈内静脉血5 mL,使用放射免疫法对肿瘤坏死因子⁃α(tumor necrosis factor⁃α,TNF⁃α),白细胞介素⁃6(interleukin⁃6,IL⁃6)水平进行检查;另外,分别于T0、单肺通气后1 h及2 h、恢复双肺通气后1 h 采集患者颈内静脉血5 mL,用黄嘌呤氧化酶法检测超氧化物歧化酶(superoxide Dismutase,SOD)水平,用硫酸巴比妥比色法检测丙二醛(malondialdehyde,MDA)水平。
1.4 统计学方法
采用SPSS 21.0 软件对数据进行分析。计量资料均符合正态分布,用()描述,两组不同时间点比较采用两因素重复测量数据方差分析,组内比较行配对t检验,两组间比较行独立样本t检验,计数资料比较行χ2检验或连续校正χ2检验或Fisher's 精确检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组镇痛泵按压次数及VAS 评分比较
研究组镇痛泵按压次数[(3.21±1.26)次]明显少于对照组[(4.62±1.71)次],两组患者术后VAS评分均呈现先升高后降低趋势,组间和时间对VAS 评分的影响均存在交互作用,研究组患者术后不同时间点的VAS 评分均明显低于对照组,差异均有统计学意义(P<0.05)。见表1。
表1 两组肺癌患者的VAS 评分比较(±s)Table 1 Comparison of VAS score between the two groups of lung cancer patients(±s)

表1 两组肺癌患者的VAS 评分比较(±s)Table 1 Comparison of VAS score between the two groups of lung cancer patients(±s)
注:与同组术后2 h 比较,aP<0.05;与同组术后6 h 比较,bP<0.05;与同组术后12 h 比较,cP<0.05。
指标VAS评分(分)组别对照组研究组t 值P 值n 42 42术后2 h 3.36±1.61 2.43±1.14 3.055 0.003术后6 h 3.57±1.37a 2.62±1.11a 3.492<0.001术后12 h 3.53±1.25ab 2.55±1.06ab 3.875<0.001术后24 h 3.14±1.07abc 2.00±0.83abc 5.456<0.001
2.2 两组血清炎症因子水平比较
两组患者血清TNF⁃α、IL⁃6 均呈先升高后降低趋势,组间和时间对TNF⁃α、IL⁃6 的影响均存在交互作用,研究组T1、T2、T3 时血清各指标水平均明显低于对照组,差异均有统计学意义(P<0.05)。见表2。
表2 两组肺癌患者的血清炎症因子水平比较(±s)Table 2 Comparison of serum inflammatory factors between the two groups of lung cancer patients(±s)

表2 两组肺癌患者的血清炎症因子水平比较(±s)Table 2 Comparison of serum inflammatory factors between the two groups of lung cancer patients(±s)
注:与同组T0 时比较,aP<0.05;与同组T1 时比较,bP<0.05;与同组T2 时比较,cP<0.05。
指标TNF⁃α(pg/mL)IL⁃6(pg/mL)组别对照组研究组t 值P 值对照组研究组t 值P 值n 42 42 42 42 T0 55.36±7.02 56.28±6.37 0.629 0.531 2.91±0.42 2.97±0.53 0.575 0.567 T1 221.05±24.37a 122.52±16.83a 21.560<0.001 13.46±2.16a 6.42±0.95a 19.335<0.001 T2 278.53±34.46ab 143.85±24.64ab 20.604<0.001 15.15±3.07ab 8.12±0.82ab 14.338<0.001 T3 203.79±31.38abc 102.73±21.52abc 17.213<0.001 10.21±1.96abc 5.05±0.72abc 16.015<0.001
2.3 两组血清氧化应激指标
两组患者血清SOD 均呈先降低后增高趋势,MDA 呈先升高后降低趋势,组间和时间对SOD、MDA 的影响均存在交互作用,研究组单肺通气后2 h、恢复双肺通气后1 h 时SOD 明显高于对照组,而单肺通气后1 h 和2 h、恢复双肺通气后1 h 时MDA 明显低于对照组,差异均有统计学意义(P<0.05)。见表3。
表3 两组肺癌患者的血清氧化应激指标水平比较(±s)Table 3 Comparison of serum oxidative stress indexes between the two groups of lung cancer patients(±s)
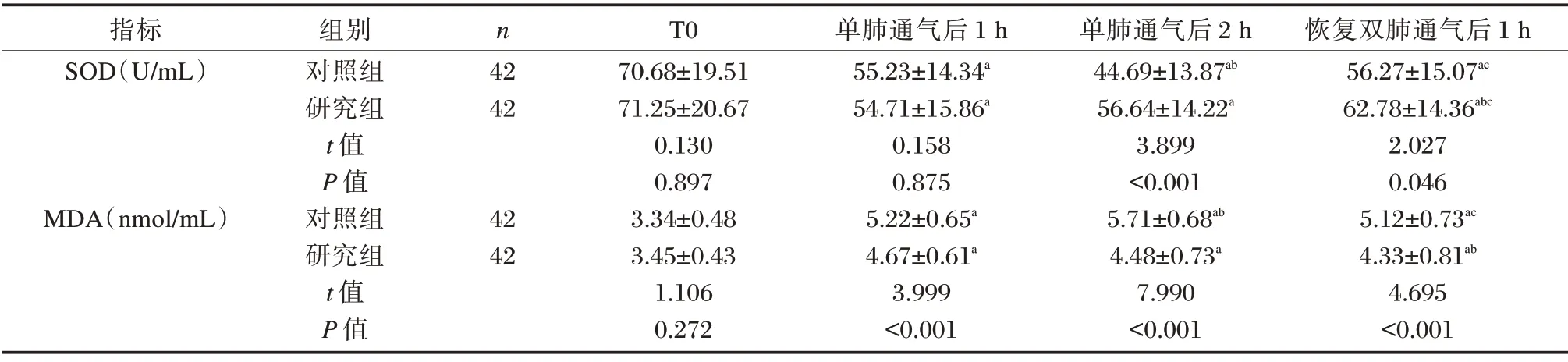
表3 两组肺癌患者的血清氧化应激指标水平比较(±s)Table 3 Comparison of serum oxidative stress indexes between the two groups of lung cancer patients(±s)
注:与同组T0 时比较,aP<0.05;与同组单肺通气后1 h 比较,bP<0.05;与同组单肺通气后2 h 比较,cP<0.05。
指标SOD(U/mL)MDA(nmol/mL)组别对照组研究组t 值P 值对照组研究组t 值P 值n 42 42 42 42 T0 70.68±19.51 71.25±20.67 0.130 0.897 3.34±0.48 3.45±0.43 1.106 0.272单肺通气后1 h 55.23±14.34a 54.71±15.86a 0.158 0.875 5.22±0.65a 4.67±0.61a 3.999<0.001单肺通气后2 h 44.69±13.87ab 56.64±14.22a 3.899<0.001 5.71±0.68ab 4.48±0.73a 7.990<0.001恢复双肺通气后1 h 56.27±15.07ac 62.78±14.36abc 2.027 0.046 5.12±0.73ac 4.33±0.81ab 4.695<0.001
2.4 两组并发症发生情况比较
两组患者术后肺部各并发症发生率及总发生率比较差异均无统计学意义(P>0.05)。见表4。

表4 两组肺癌患者的并发症发生情况[n(%)]Table 4 Incidence of complications in patients with lung cancer[n(%)]
3 讨论
帕瑞昔布钠临床上一般用于中度和重度手术后的急性疼痛的治疗,有研究证实其具有阻断痛觉过敏、改善免疫反应、降低认知功能障碍发生率、减少术后阿片类药物的总消耗量等作用,有助于患者术后快速康复[7]。帕瑞昔布是伐地昔布的前体药物,进入体内之后帕瑞昔布会代谢为伐地昔布,对COX⁃2进行抑制,对花生四烯酸合成前列腺素进行阻止,进而可减轻炎症反应,充分发挥抗炎、镇痛效果[8]。本研究发现与给予生理盐水的对照组相比,研究组患者的舒芬太尼用量更少,VAS 评分明显下降,提示帕瑞昔布钠可对痛觉敏感化进行抑制[9],提高镇痛效果,并可适当减少舒芬太尼用量,从而降低其导致呼吸抑制的潜在风险。TNF⁃α 在炎症早期便可检出,其会促进IL⁃6 等炎性因子的释放[10]。本研究结果显示,两组患者血清TNF⁃α、IL⁃6 在麻醉诱导开始即刻、术毕及术后12 h、24 h 均以术后12 h 为峰值呈先升高后降低趋势,且研究组术毕及术后12 h、24 h各指标水平明显低于对照组。提示患者由于手术创伤、疼痛等因素影响存在机体炎症反应的增强,可能在术后12 h 开始逐渐减弱,且帕瑞昔布钠能有效减轻机体炎症反应,与吕帅国等[11]的研究结论基本一致。
单肺通气所致机体组织缺氧还可导致氧化应激反应增强,而帕瑞昔布钠作为选择性COX⁃2 抑制剂,可能通过调节非通气肺乏氧性肺血管收缩机制减少肺内分流、减轻机体氧化应激反应而降低肺损伤风险。本研究结果发现,两组患者血清SOD 在麻醉诱导开始即刻、单肺通气后1 h 和2 h、恢复双肺通气后1 h 呈先降低后增高趋势,MDA 呈先升高后降低趋势,均与T0 时存在显著差异,且研究组SOD、MDA 水平变化幅度相对较小,峰值较对照组提前,提示患者术中存在氧化应激反应增强,且帕瑞昔布钠能有效减轻机体氧化应激反应,分析原因可能与帕瑞昔布钠通过减少肺内分流而缓解机体缺氧状态,从而减轻氧化应激压力有关。另外,两组患者在恢复双肺通气后早期机体仍处于氧化应激反应增强状态,可能与单肺通气中非通气肺的缺血再灌注损伤有关[12]。
在并发症发生方面,研究组肺水肿、肺不张、肺损伤发生率及总发生率高于对照组,但差异并不显著,这主要与帕瑞昔布钠能通过对硫化氢介导的肺水肿、促炎细胞因子释放的抑制作用[13],减少急性肺损伤的发生有关,而两组差异并不显著的原因也可能与样本量较小有关。
综上所述,对于胸腔镜手术治疗的肺癌患者,麻醉诱导前及术后给予适量帕瑞昔布钠能明显提高镇痛效果,并能明显减轻患者炎症及氧化应激反应。

