不同盐浓度对接种发酵萝卜泡菜品质的影响
欧 雪,吴梦西,廖一漠,刘书亮,陈安均,高 鹏,徐 飞,敖晓琳*
(1.四川农业大学食品学院,四川 雅安 625014;2.四川省原子能研究院辐照保藏四川省重点实验室,成都610101;3.四川李记乐宝食品有限公司,四川 眉山 620036)
四川泡菜是以新鲜蔬菜为原料,添加香辛料和食盐等辅料发酵制成[1]。按不同食盐添加量可将四川泡菜分为中盐泡菜:食盐量≤10%,如调味泡菜;低盐泡菜:食盐量≤6%,比如家庭自制泡菜;超低盐泡菜:食盐量≤3%,比如一些预包装休闲泡菜[2]。食盐在发酵过程中能抑制致病微生物生长并确保食品安全性,但盐浓度过高又会影响泡菜的风味和营养品质,江玉琴等[3]在盐浓度(10%、14%、18%)下自然发酵芥菜90天,结果表明食盐添加量越高泡菜总酸和氨基酸含量越低。而超低盐浓度(1%~3%)发酵易导致泡菜过度酸软,缩短泡菜保质期[4-5]。因此研究泡菜适宜的食盐添加量对工业生产中提高泡菜品质具有重要意义。Xiong T.等[6]研究不同盐浓度(2%、5%、8%)对自然发酵酸菜理化特性、微生物结构及其代谢物(有机酸、糖、醇)的影响,结果表明盐浓度主要影响酸菜发酵早期阶段。申文熹等[7]的研究结果证明在自然发酵条件下,2%和5%盐浓度组泡菜较8%盐浓度组泡菜中乳酸菌种类更丰富。但目前采用接种发酵模式探讨不同食盐浓度下四川泡菜品质变化的系统研究鲜有报道。
目前,本实验室已从自然发酵的优质泡菜中筛选得到两株优势乳酸菌L.plantarum RS66CD和L.fermentum Lm-4,经试验证实这两种菌株具有改善产品风味和抑制杂菌生长等特性[8]。因此,本研究复配运用这两种优势菌株制备液体发酵剂,采用接种发酵模式[9],检测盐浓度为2%、5%和8%的萝卜泡菜发酵过程中理化指标与感官品质变化,期望为研发接种发酵低盐四川泡菜产品提供数据支撑和理论依据。
1 材料和方法
1.1 材料
白萝卜、泡菜盐、八角和花椒购自雅安市吉选超市;植物乳杆菌(L.plantarum)RS66CD:实验室保藏,从优质泡菜中分离得到,具备良好的发酵特性;发酵乳杆菌(L.fermentum)Lm-4:实验室保藏,具有改善泡菜风味和抑菌作用。
1.2 试剂与培养基
MRS液体培养基、MRS固体培养基和PCA培养基购自凯恒生物科技有限公司;氢氧化钠、对氨基苯磺酸、盐酸萘乙二胺、乙酸锌、盐酸、冰乙酸、酚酞、邻苯二甲酸氢钾、亚硝酸钠和硼酸钠均为国产分析纯,购自天津市科密欧化学试剂有限公司;磷酸、乙腈:色谱纯,购自武汉科瑞兴科技有限公司;有机酸标准品(纯度≥98%)购自阿拉丁试剂有限公司。
1.3 仪器与设备
DZF-6020质构分析仪,北京中兴伟业仪器有限公司;NR10QC手持式色差仪,深圳市三恩时科技有限公司;UV-1800PC紫外分光光度仪,上海美普达仪器有限公司;SW-CJ4F超净工作台,力辰科技;PHS4C+精密pH计,成都世纪方舟科技有限公司;安捷伦1260高效液相色谱仪、7890A-5975CGC-MS联用仪,美国安捷伦公司;50/30µm DVB/CAR/PDMSPME萃取头,美国Supelco公司。
1.4 制作方法
1.4.1 乳酸菌发酵剂制备
植物乳杆菌RS66CD与发酵乳杆菌Lm-4经过活化后分别于MRS液体培养基37℃培养至菌液浓度达到 108CFU/mL,再进行离心(4 500 r/min,5 min,4℃)。弃取上清液,用无菌生理盐水反复洗涤沉淀3次,最后调整菌悬液浓度(107~108CFU/mL)并将植物乳杆菌RS66CD与发酵乳杆菌Lm-4菌悬液以1∶1混匀制得复合菌种发酵剂,混合后立即接种。
1.4.2 泡菜制作方法
新鲜萝卜洗净,切成(3×2×1)cm3的块状备用;纯净水烧开冷却,量取1.5 L,加入适量的泡菜盐搅拌均匀(2%盐浓度组:40 g泡菜盐;5%盐浓度组:80 g泡菜盐;8%盐浓度组:160 g泡菜盐)。称取500 g切好的萝卜再加入花椒(2.3%)、八角(0.13%)和1.5 L盐水到泡菜坛中,最后加入预先制备好的发酵剂,制得2%、5%和8%盐浓度组的泡菜各两坛,置于室温(25℃)发酵。
1.5 分析方法
1.5.1 取样
本试验发酵起始时间为2020年7月24日,取样为0 h以及每隔24 h后取次样,分别为发酵第0、1、2、3、4、5和6天。取样时在无菌环境进行,先将泡菜摇匀后取样。
1.5.2 感官评价
邀请10名具有感官评定经验的食品相关人员组成评定小组,依据表1对泡萝卜产品进行感官评分。总体得分=色泽×10%+香气×20%+质地×30%+滋味×40%,总分100分[10]。
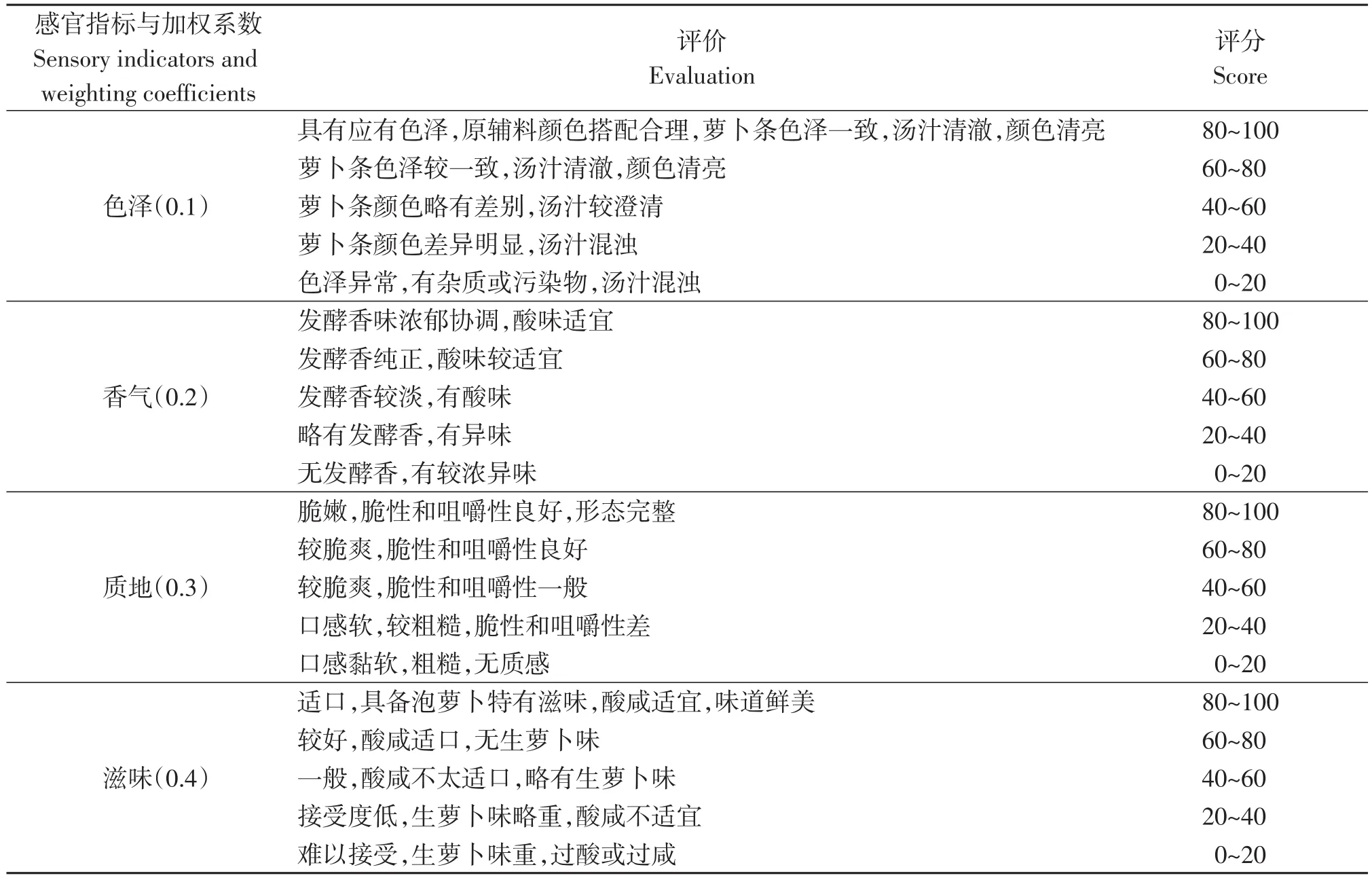
表1 萝卜泡菜感官评定标准Table 1 Sensory evaluation criteria for Radish pickles
1.5.3 质构仪分析
参考朴泓洁等学者的方法[11],并稍作修改。取尺寸一致的泡菜样品,采用TPA模式、P2探头,质构测定参数为:测前速率1 mm/s、测中速率1 mm/s、测后速率10 mm/s,测试距离固定为5 mm,触发力5 g。每个样品测试9次。
1.5.4 色差仪分析
取大小一致的样品,使用色差仪在室温条件下采用取出镜面反射模式进行色泽测定。测试参数分别为亮度值 L*、红绿值 a*和黄蓝值 b*。通过 L*、a*、b*值可以计算得出总色差值△E值,△E计算公式如下:

1.5.5 理化指标测定
1.5.5.1 pH值和总酸的测定
pH值的测定方法参考GB/T10468-1989《水果和蔬菜产品pH值的测定方法》[12];总酸含量的测定采用GB/T12456-2008《食品中总酸的测定》酸碱滴定法,总酸含量以乳酸计[13]。
1.5.5.2 亚硝酸盐含量的测定
亚硝酸盐的测定参考《GB 5009.33-2016食品安全国家标准食品中亚硝酸盐与亚硝酸的测定》中的分光光度法[14]。
1.5.6 微生物分析
乳酸菌活菌计数参考GB/T4789.35-2016《食品安全国家标准食品微生物学检验乳酸菌检验》[15]。
菌落总数的测定参考GB/T4789.2-2016《食品安全国家标准食品微生物学检验菌落总数测定》[16]。
1.5.7 有机酸含量测定
色 谱 柱 :C18柱 (Welch materials),250 nm×4.6 nm,5µm。流动相:100%乙腈、1%磷酸水溶液,pH 2.8,临用前超声脱气20 min。流速1 mL/min,进样量10µL,紫外检测波长210 nm,柱温35℃。标曲的制作参考王芮东等[10]学者的方法,并稍作修改。有机酸混标用超纯水稀释后用0.22µm的滤膜过滤,上机测定。以色谱图结果的峰面积为横坐标,标准品的浓度为纵坐标,绘制标准曲线,同时将一定量有机酸混标加入样品处理液中,计算绝对回收率。待测样品定量与定性:通过保留时间定性,通过绘制标准曲线,用外标法进行定量分析。
1.5.8 挥发性风味成分检测
采用SPME-GC-MS法进行测定。萃取条件:参考夏季等的方法[17],并稍作修改。称取5.0 g泡菜匀浆和1.0 g NaCl于20 mL萃取瓶中放入50℃恒温水浴锅中,将预先老化过的萃取头插入萃取瓶中吸附30 min,最后将萃取头插入进样口,解析5 min。气相色谱条件:不分流进样模式,以氦气作为载气,流速设为1.0 mL/min。升温程序:进样口温度设为250℃,进样温度为40℃,进样时间设为3 min,以5℃/min速率升至150℃,保持3 min,再以10℃/min速率升至230℃,保持3 min;质谱条件:电离方式:电子电离,能量:70 eV,离子源温度:230℃,接口温度:250℃;质量扫描范围:25.00~450.00 m/z。
定性和定量分析:由GC-MS得到的色谱图,经计算机在标准谱库NIST11中比对检索,选取相似度>80的物质进行定性分析,并准确鉴定出各样品的挥发性成分,采用面积归一化法计算各组分相对含量。
1.6 数据分析
采用Microsoft Excel、SPSS 18.0软件对试验数据进行处理,Origin 8.5制图,所以试验均平行进行3次,结果以均值±标准差表示。
2 结果与分析
2.1 不同盐浓度人工接菌发酵萝卜泡菜发酵成熟后感官评价结果
根据文献报道,一般泡菜的总酸含量达到0.4 g/100g时,即可认为泡菜成熟,风味最佳[7]。因此根据试验结果,分别在第3、5和6天将2%、5%和8%盐浓度组的萝卜泡菜取出进行感官分析,结果如表2所示:从总分来看,2%和5%盐浓度组泡菜综合得分显著高于8%盐浓度组,且2%盐浓度与5%盐浓度组差异并不显著(P>0.05)。对比发现2%盐浓度组泡菜色泽鲜亮,具备泡菜应有的特殊香气,且咸淡适宜,更被消费者喜爱。5%盐浓度组泡菜在色泽和滋味上不及2%盐浓度组,但其泡菜风味浓郁,质地脆嫩爽口。8%盐浓度组虽然在质地方面具明显优势,但其滋味过咸,不符合消费者的饮食要求。

表2 不同盐浓度萝卜泡菜感官品质变化Table 2 The sensory quality of Radish pickles with different salt concentration changes
2.2 不同盐浓度接种发酵萝卜泡菜发酵过程中质构特性的变化
由图1-a所示,随着发酵的进行,各组别萝卜泡菜的硬度均呈现显著下降趋势,(P<0.05),盐浓度越高,泡菜硬度降低速率越缓慢,可能是在高渗透压环境下,蔬菜细胞脱水更快,组织细胞变致密,使硬度降低速度减慢。除硬度外,脆度是影响泡菜感官品质的另一个重要指标。如图1-b所示,盐浓度越低,泡菜脆度降低速率越快。这是因为低盐浓度下乳酸菌利用底物产酸速率较快,使泡菜质地变软,脆性下降。这与张其圣等[5]的研究结果一致。图1-c显示的是泡菜咀嚼度的变化情况,随着发酵的进行,盐浓度高的试验组咀嚼度降低的速度更加缓慢。由此可见,盐浓度对泡菜质构特性有一定影响,8%盐浓度的质构特性最佳,这与感官评价结果一致。

图1 不同盐浓度萝卜泡菜发酵过程中硬度(a)、脆度(b)、咀嚼度(c)的变化Figure 1 Changes in hardness(a)、crispness(b)and chewiness(c)of Radish pickles with different salt concentrations during fermentation
2.3 不同盐浓度接种发酵萝卜泡菜发酵过程中色差指标变化
色差仪测得的a*表示红色度,a*越大表示越红,a*越小表示越绿;b*表示黄色度,b*越大表示越黄,b*越小表示越蓝;L*表示亮度,L*越大表示越亮,越小表示越暗;△E表示总色差大小。由表3可以看出,随着发酵时间的增加,各组别L*值均呈现降低趋势,且盐浓度越高降低的速率越慢,可能与微生物利用底物的效率有关。盐浓度产生的渗透压越高会抑制微生物的生命活动和代谢效率。各组别a*和b*的差异并不大,△E的变化趋势与L*的变化规律基本相同,由图2可知2%、5%、8%盐浓度组分别在第3、5、6天达到成熟要求,当各组达到成熟要求时各组的L*值分别为48.50±0.98、45.83±1.10和45.01±0.23。结果可以看出盐浓度越高,泡菜成熟时的颜色越暗,这与感官分析结果一致。
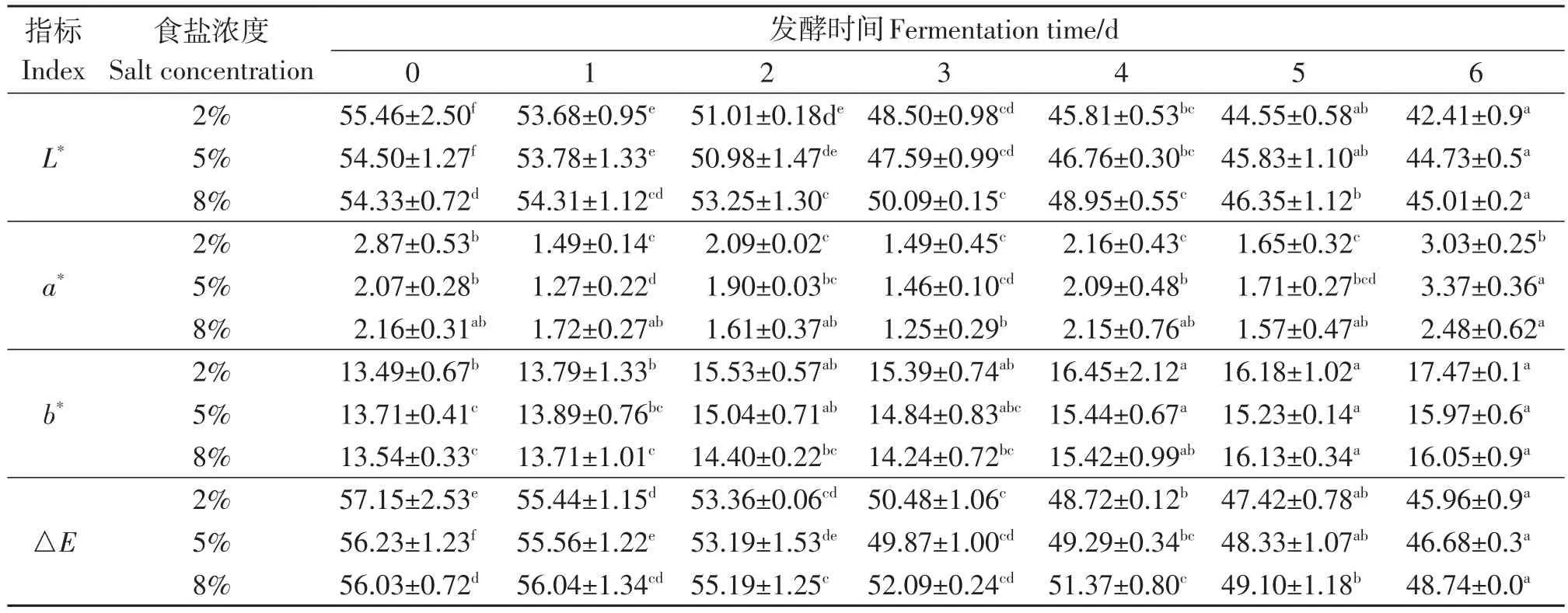
表3 不同盐浓度萝卜泡菜色差指标变化Table 3 The color difference index of Radish pickles with different salt concentration changes
2.4 不同盐浓度接种发酵萝卜泡菜发酵过程中理化指标的变化
2.4.1 pH值和总酸含量的变化
pH值和总酸是影响泡菜风味的重要指标,同时也是反映微生物在特定环境下代谢活动情况的综合参数。不同盐浓度萝卜泡菜发酵过程中的pH值和总酸含量变化如图2所示,在发酵开始后的3 d内pH值显著下降至3.5左右。2%盐浓度组在发酵前两天产酸速度最快,且在整个发酵过程始终保持pH值最低,总酸含量最高,而最高盐浓度组产酸速度最慢。这种现象是在较高食盐浓度下,发酵环境的高渗透压会抑制乳酸菌等微生物的代谢活动,而低盐发酵能加快泡菜成熟[6],这与申文熹等[7]的研究结果相一致。
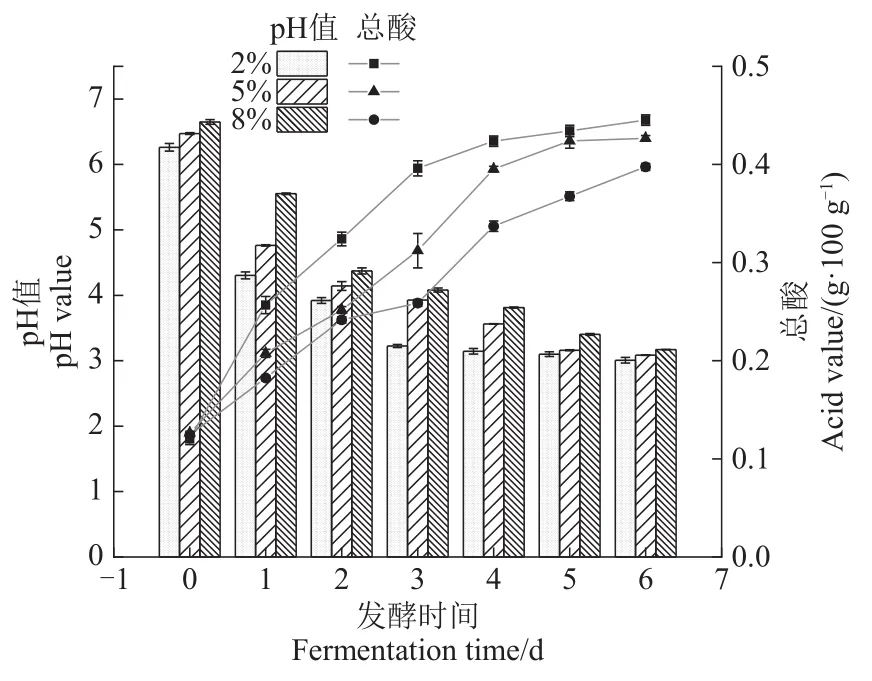
图2 不同盐浓度萝卜泡菜发酵过程中pH值和总酸的变化Figure 2 Changes of pH and total acid during the fermentation of Radish pickles with different salt concentrations
2.4.2 亚硝酸盐的变化
泡菜中存在的亚硝酸盐来源于蔬菜自带的硝酸盐在一些细菌产生的“硝酸盐还原酶”作用下,转化成亚硝酸盐[18]。过多摄入亚硝酸盐对人体有致癌作用,因此亚硝酸盐是评价泡菜产品食用安全的重要指标。如图3所示随着发酵的进行,前两天内亚硝酸盐含量显著增加。2%、5%和8%盐浓度组分别在发酵第2天、第4天以及第5天达到亚硝酸盐浓度 最 大 值 ,分 别 为 (9.66±0.74)、(10.09±0.25)和(11.62±0.72)mg/kg,均符合国标要求的亚硝酸盐含量安全标准(20 mg/kg)。盐浓度越高泡菜亚硝峰出现的时间越迟,可能是因为盐浓度越高对产硝酸盐还原酶微生物的代谢产生阻碍作用。到发酵中后期,各组别亚硝酸盐含量会逐渐下降可能是乳酸菌的大量繁殖从而抑制产硝酸盐还原酶微生物的活性,而酸性条件下这种抑制作用更加明显[19]。由此证明,在接种发酵条件下中低盐发酵有利于控制泡菜中亚硝酸盐的产生。
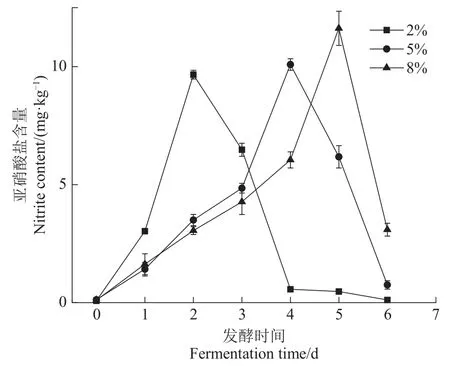
图3 不同盐浓度萝卜泡菜发酵过程中亚硝酸盐的变化Figure 3 Changes of nitrite during the fermentation of Radish pickles with different salt concentrations
2.5 不同盐浓度接种发酵萝卜泡菜发酵过程中优势微生物及菌落总数的变化规律
2.5.1 菌落总数的变化
盐浓度对微生物的生长的影响本身是一个多阶段且复杂的过程,对不同盐浓度组萝卜泡菜发酵过程中总菌落和乳酸菌进行计数,结果如图4所示:菌落总数总体呈现先上升后下降趋势,其中2%盐浓度组在第3天达到峰值(8.44±0.05)Lg(CFU/mL)而5%和8%盐浓度组在发酵第4天时达到峰值,数量相差不大(P>0.05),随后明显下降,可能是在低pH和高浓度有机酸的环境下,微生物的生命活动受到抑制,再加上在高渗透压作用下微生物数量总体下降。总体来看,盐浓度越高,菌落总数越低,但对于较高盐浓度组差异并不显著(P>0.05)。
2.5.2 乳酸菌的数量变化
由于直投式发酵菌株在发酵初期存在明显生长优势,且在低盐发酵环境中这种优势更加明显,因此在发酵初期,所有组别的乳酸菌数量(图4)均出现明显上升趋势,这符合黄道梅等[20]采用多菌协同发酵泡菜,不同高盐浓度组萝卜泡菜在发酵前期时乳酸菌含量均上升的结果。尽管不同盐浓度组乳酸菌数量达到峰值的时间点不同但发酵结束时数量比较接近,可能与植物乳杆菌RS66CD能够产生一定量的胞外聚合物使其具备优良的抗逆性有关[21]。
2.6 不同盐浓度接种发酵萝卜泡菜风味物质的测定
2.6.1 有机酸含量的变化
在泡菜的发酵过程中,各种有机酸的积累是形成泡菜特殊风味的重要原因,其中,草酸、乳酸、乙酸、柠檬酸、苹果酸以及琥珀酸等有机酸是泡菜发酵过程中的主要代谢物,因此对发酵过程中这7种有机酸含量进行检测,结果如图5所示。
从发酵过程中草酸含量变化(图5-a)来看,各组别草酸含量均呈现显著下降趋势(P<0.01),其中在发酵后熟阶段,2%盐浓度组下降速率最大,在发酵第6天,草酸含量降至(0.042 0±0.011 0)mg/g。可能是在发酵后期大量耐酸性微生物大量繁殖并产生较多的醇类物质与草酸反应生成酯类物质[22],或者被微生物自身利用生成其他物质。
如图4-b所示,原料中DL-酒石酸含量为(0.015 0±0.004 8)g/100 g。随着发酵的持续进行,2%盐浓度组的酒石酸含量在发酵1 d后显著下降(P<0.05)随后升高,发酵第4天又缓慢下降至(0.008 0±0.005 7)g/100 g。5%和8%盐浓度组整体呈现缓慢升高再显著下降的趋势(P<0.05)。
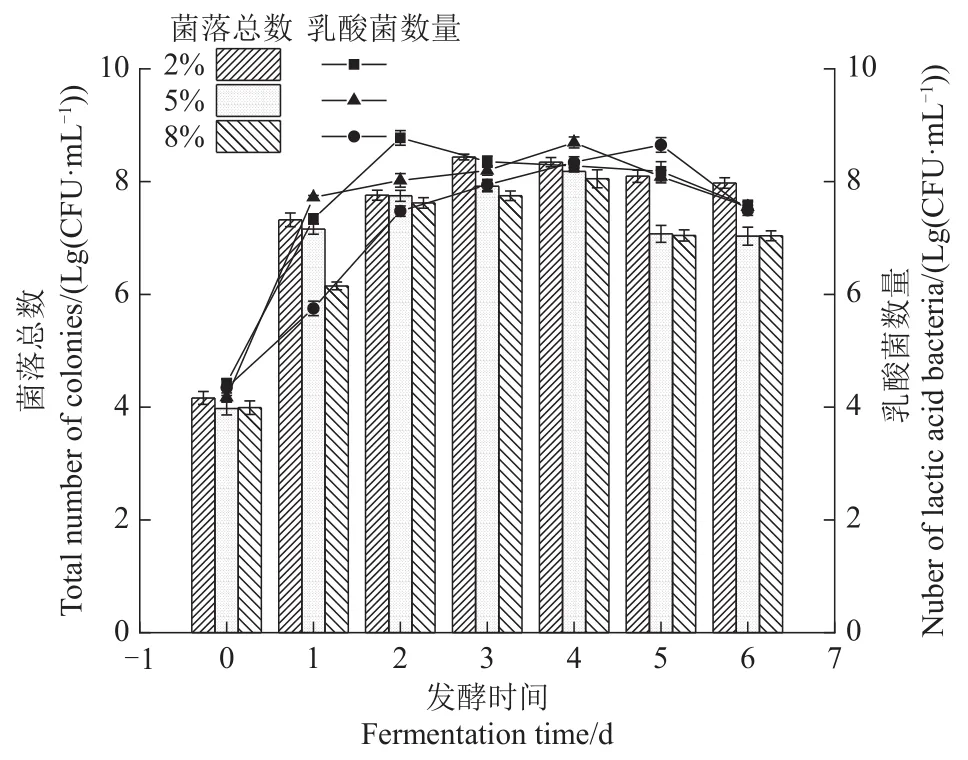
图4 不同盐浓度萝卜泡菜发酵过程中菌落总数和乳酸菌的数量变化Figure 4 Changes in the total number of colonies and the number of lactic acid bacteria during the fermentation of Radish pickles with different salt concentrations
乳酸是泡菜发酵过程中提供柔和风味的物质之一,从乳酸含量的变化(图5-c)可以看出,各组别原料中乳酸含量为0 g/100g或者其含量低于仪器检测限,随着发酵的进行,各组别泡菜中乳酸含量在发酵前两天均先上升后降低。相较于5%和8%盐浓度组,2%盐浓度组在发酵初期,乳酸含量增速较快,可能是在发酵前半阶段主要进行异型乳酸发酵,接种的乳酸菌在此阶段代谢活动较快,不会受到高盐浓度的抑制,因此代谢产生乳酸的速度较快[23]。在发酵前期乳酸的含量与盐浓度呈负相关,熊涛等学者[24]通过不同盐浓度对发酵圆白菜的菌系代谢变化的研究也证实了这一结论。乳酸含量的迅速增高能够很好地抑制泡菜中包括病原菌在内的杂菌的生长,这对泡菜的安全性有重要意义。而在发酵后期由于酯化反应生成酯类芳香物质抑制乳酸菌的生命活动,导致乳酸含量降低[25]。对于高盐浓度组,在发酵后熟阶段乳酸含量降低可能是在高盐浓度的环境中,某些耐盐微生物比如酵母菌、霉菌和致病微生物等虽然可以利用蔗糖,但是不能产生乳酸。当然在较低pH值和底物不足的环境下,乳酸菌代谢活动受到抑制,也是造成发酵后期乳酸含量降低的原因之一。
乙酸是泡菜在发酵过程中的重要代谢物之一,其主要来源是微生物代谢,而它又能与醇类物质结合生成酯类,是形成泡菜特殊风味的重要物质。在整个发酵过程中,各组别泡菜中的乙酸含量(图5-d)均呈现曲折上升后平稳的趋势,而2%盐浓度组速率高于其他两组,可能因为在发酵初始阶段,乳酸菌代谢活动受到较高盐浓度发酵环境的抑制,产酸速率减慢。
随着发酵的进行,各组别泡菜中柠檬酸的含量均显著上升(P<0.05),图5-e表明,在发酵过程中,盐浓度越高,泡菜中柠檬酸含量越高,这可能是因为在高盐浓度下微生物利用柠檬酸的能力减弱。在泡菜的发酵过程中,苹果酸能使泡菜呈现令人愉悦的风味。由图5-f可以看出,2%盐浓度组萝卜泡菜中L-苹果酸总量最高,而8%盐浓度组在发酵第4天才检测出苹果酸,这可能与苹果酸酶的含量有关,相关研究报道证明,苹果酸可以被微生物细胞内的苹果酸酶催化成乳酸[26]。
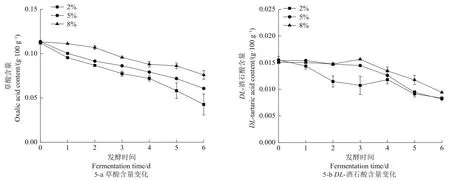
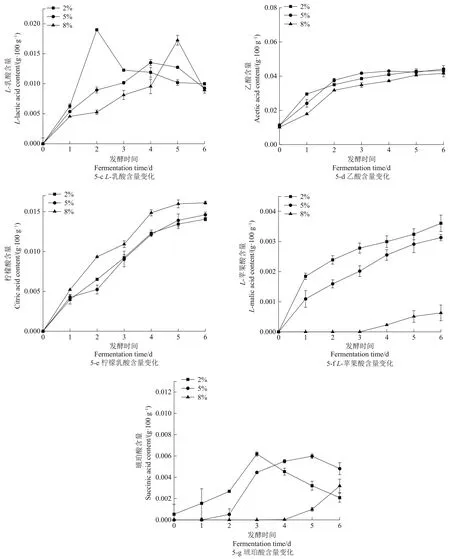
图5 不同盐浓度萝卜泡菜发酵过程中有机酸的含量变化Figure 5 Changes of organic acid content in Radish pickles with different salt concentrations during fermentation
如图5-g所示,原料中的琥珀酸含量较低,随着发酵的进行各组别均显著增加(P<0.01),2%、5%和8%盐浓度组在分别发酵第3、5和6天,琥珀酸含量增 加 至 (0.061 8±0.000 2)、(0.005 98±0.001 8)和(0.003 19±0.008 3)g/100g。随后出现下降趋势可能是琥珀酸作为三羧酸循环的中间产物,只是参与微生物的繁殖和代谢,最后生成可溶性盐导致其含量降低。
2.6.2 挥发性风味物质的测定
泡菜中的含有的各种风味物质是形成泡菜特殊香味和滋味的原因,其主要是由挥发性风味物质和非挥发性风味物质(氨基酸和有机酸类化合物)构成。为了检测不同盐浓度下接种乳酸菌发酵萝卜泡菜含有的挥发性风味物质差异,采用SPME-GC-MS检测3种成熟后的泡菜样品,结果如图6所示。3种盐浓度萝卜泡菜共检出挥发性风味物质50种,其中包括5种酯类、2种酮类、19种醇类、3种酸类、8种醛类、2种醚类、6种烃类、2种酚类和3种其他类化合物。2%、5%和8%盐浓度组萝卜泡菜检出的挥发性风味物质种类分别为29、34和24种。造成不同盐浓度泡菜中挥发性风味物质种类差异的原因可能是泡菜中绝大多数微生物在高盐浓度(8%)下受到抑制,发酵产生的风味物质种类相对较少。而2%盐浓度下的泡菜中接种的乳酸菌快速繁殖成为优势菌群,从而产生大量乳酸使泡菜酸度急剧下降,不耐酸微生物的繁殖代谢受到影响,造成一些泡菜特殊风味物质比如酮类和酯类化合物种类较少[27]。
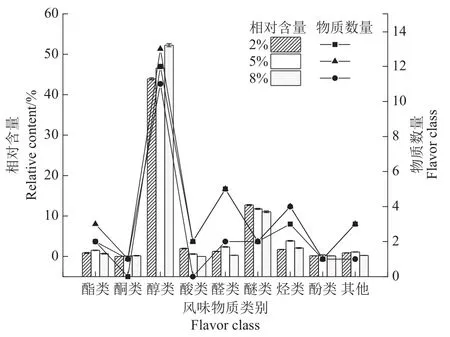
图6 不同盐浓度萝卜泡菜挥发性风味物质种类相对含量及物质数量Figure 6 Relative content and quantity of volatile flavor substances in Radish pickles with different salt concentrations
将不同盐浓度下泡菜中主要挥发性物质的相对含量变化汇总如表4所示,在这3种盐浓度发酵处理中,醇类物质种类最丰富,其中5%盐浓度组有12种醇类物质远多于云琳等学者[28]接种植物乳杆菌和肠膜明串珠菌(Leuconostoc mesenteroides)发酵制备的萝卜泡菜。醇类化合物相对含量最高分别为43.91%、46.61%和52.25%。其中又属芳樟醇和桉叶油醇的含量较高,这两种醇类物质不仅呈现令人愉快的风味,还能与酸类物质生成更多复杂的呈味物质[29]。3种盐浓度组萝卜泡菜中8%盐浓度组醇类物质含量最高,可能是因为在较高盐浓度下,耐盐性强的酵母菌代谢旺盛,大量醇类物质积累。但酯类物质最少(相对含量0.29%)可能是乳酸菌代谢受到高渗透压作用抑制,产生的酸类物质较少,从而与醇类物质发生酯化反应生成的酯类物质较少。酸类物质在2%盐浓度泡菜中相对含量最多,因为乳酸菌代谢旺盛,产生较多酸类化合物。醚类物质在2%盐浓度组泡菜中相对含量最高,其次是5%盐浓度组。其中4-烯丙基苯甲醚和茴香脑是八角和花椒中主要的挥发性香气成分,对萝卜泡菜风味形成有非常大的贡献[17]。各组别出现含量差异的原因可能与菌群结构有关,不同盐浓度发酵处理下存活的微生物种类不同,因此利用相应物质产生醚类化合物的能力则不同[30]。5%盐浓度组含有的挥发性风味物质种类丰富且相对含量较高。其中酯类物质相对含量较其他两组更高,它们能在泡菜中呈现怡人的甜味和果香、花香等香气[25]。二甲基三硫是构成泡菜的主体风味物质,其阈值较低[26],在低含量下就能产生浓郁的香味,不同盐浓度泡菜中都检测到的该物质,该物质在5%盐浓度下的泡菜中相对含量最高,使得泡菜风味更加突出。此外,酮类化合物二-庚酮等能赋予泡菜清香爽口的口感,烃类化合物也是使泡菜具有独特风味的重要挥发性风味物质,他们在5%盐浓度组检测出的种类和相对含量均优于其他两组。
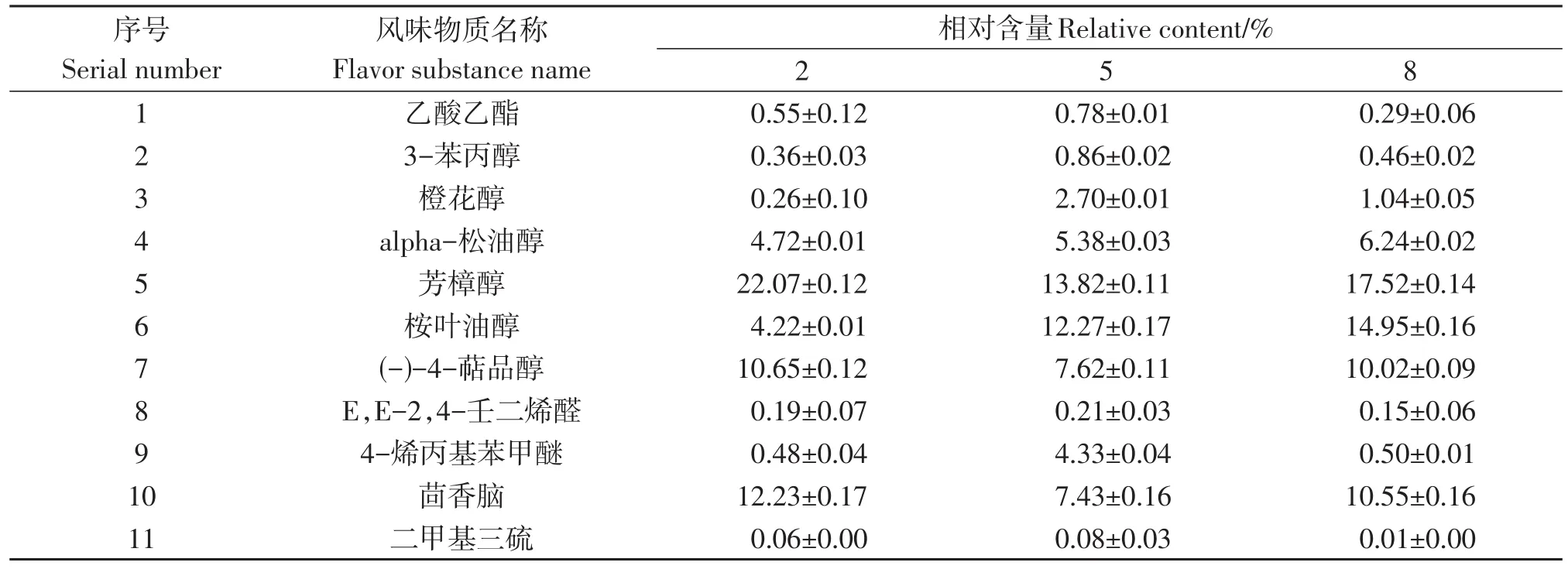
表4 不同盐浓度萝卜泡菜中主要挥发性风味物质相对含量Table4 Relative content of main volatile flavor compounds in Radish pickles with different salt concentrations
3 结论
盐浓度对萝卜泡菜的微生物代谢和感官品质具有显著影响。2%盐浓度组产酸速度快,且能在最快时间出现亚硝峰,显著缩短萝卜泡菜发酵成熟时间,而5%盐浓度组次之。从微生物数量变化上来看,盐浓度越高,菌落总数越低。就风味物质含量变化而言,2%盐浓度萝卜泡菜中有机酸的产生速率更快,2%盐浓度下微生物能充分利用底物,积累更多的L-苹果酸和琥珀酸,泡菜的滋味浓郁协调;5%盐浓度组形成的挥发性风味成分种类最多,其中醇类物质高达12种,烃类、酯类和酚类化合物的种类和相对含量均多于其余两组。在感官品质方面,8%盐浓度组泡菜尽管质地脆嫩但其滋味过咸不易被接受,5%盐浓度在风味上略胜一筹,2%盐浓度组泡菜在色泽和滋味上优于其余两组。综上所述,将本实验室自制的乳酸菌菌剂运用于传统萝卜泡菜发酵工艺,综合分析各项指标,盐浓度范围在2%~5%下泡菜更具备优质四川泡菜所特有的风味和口感。相反,8%盐浓度为会抑制乳酸菌的生长延迟泡菜的成熟且口感较差,这与熊涛学者采用自然发酵模式研究不同盐浓度对酸菜品质的影响所得结果有一定差异,证明接种发酵对降低泡菜中食盐的添加量有一定积极作用,但仍需要进一步的试验确定接种发酵下萝卜泡菜最适宜盐浓度以及研究菌群结构与品质变化的关系。

