水铁矿对水稻土Feammox过程的影响及微生物群落分析
车 健, 马 丁, 王 进
(1.合肥工业大学 资源与环境工程学院,安徽 合肥 230009; 2.同济大学 环境科学与工程学院,上海 200082)
0 引 言
微生物通过硝化-反硝化和厌氧氨氧化过程将氨氮转化为N2O或N2,是陆地生态系统氮损失的重要途径[1]。近年来,研究人员发现一种新型的氨氧化耦合铁还原的氮流失途径,该过程以NH4+作为电子供体,Fe3+作为电子受体,即铁氨氧化(Feammox)[2]。Feammox过程可以产生氮气(N2)、硝酸盐(NO3-)、亚硝酸盐(NO2-)。Feammox过程已在多种环境下被证实,包括热带森林土壤[3]、水稻土壤[2]、长江口潮间带湿地[4]、红树林湿地[5]等。文献[3]通过同位素示踪技术首次在热带旱地土壤中发现Feammox现象,其研究结果表明,在热带旱地土壤中Feammox速率(以N计,下同)为 0.32 mg/(kg·d),估算每年在0 ~ 10 cm热带旱地土壤中通过Feammox造成的氮损失(以NH4+-N 计)为1 ~ 4 kg/(hm2·a);文献[2]发现在不同年代水稻土中Feammox速率为(0.17±0.01)~(0.59±0.03) mg/(kg·d),并且通过与未被耕作的土壤相比较,发现已耕作土壤Feammox速率显著高于未被耕作的土壤;文献[4]研究表明,在潮间带湿地中Feammox潜在速率为(0.24~ 0.36) mg/(kg·d),在春潮期间沉积物中Feammox速率普遍高于小潮期间,潮汐波动影响铁还原细菌的生长和Fe(Ⅲ)的还原,由此影响Feammox速率以及潮间带湿地中氮元素向大气中转化的过程。
同时,微生物介导的异化铁还原过程也是重要的生物地球化学过程,具有异化铁还原功能的微生物广泛存在于厌氧土壤、沉积物环境中。文献[2-4]研究表明,在Feammox培养过程中异化铁还原菌相对丰度也显著提高,但当异化铁还原过程与Feammox同时发生时,Feammox过程贡献的Fe(Ⅲ)还原仅占总铁还原的0.9%~3.0%,异化铁还原过程仍然处于主导地位。由于异化铁还原过程与Feammox过程共存时会竞争电子受体铁,土壤中Fe(Ⅲ)的含量及形态对Feammox过程可能产生重要影响,目前在该方面的研究报道很少。
我国南方地区水稻土采用周期性的淹水-落干管理措施,其中的人工施肥过程为Feammox提供了良好的条件。水铁矿作为铁循环过程的重要中间产物,在水稻土中含量丰富,其具有较高的表面活性和生物可利用性。目前考察水铁矿和Feammox过程之间相互作用的相关研究很少,其潜在的机制尚未阐明。
本文以水稻土为研究对象,通过厌氧培养及乙炔抑制技术,研究表层水稻土中的Feammox过程,通过对比分析培养体系中N2产率,探讨外加水铁矿对Feammox转化途径及微生物群落结构的影响,为进一步了解Feammox拓展氮元素的生物地球化学循环过程提供一定理论依据。
1 材料与方法
1.1 实验材料
实验采用的水稻土取自长沙市长沙县(113°7′E,28°10′N),用长铲取0~ 10 cm深度的土壤,取样量约为2 kg,所取土壤均放于无菌采样袋中,并记录时间、地点,随后迅速放入冰盒中,用保湿剂和脱氧剂保存。样品采集后12 h内送到实验室。土壤样本返回实验室后,立即在厌氧手套箱中均匀分成以下3个部分:第1部分样品用于厌氧预培养过程,以耗尽土壤本身所存在的O2、NO2-和NO3-;第2部分样品储存在4 ℃冰箱中,用于测定土壤的理化特性,包括pH值、含水率w、氧化还原电位、无机氮质量比、总铁(total Fe,TFe)质量比wTFe和总有机碳(total organic carbon,TOC)质量比wTOC;第3部分样品储存在-80 ℃冰箱中,用于微生物群落分析。土壤基本理化性质指标取值见表1所列。

表1 土壤基本理化性质指标取值
1.2 实验设计
(1) 所有的土壤样品都在厌氧手套箱中进行培养,厌氧手套箱中充满高纯氩(Ar)。
(2) 对土壤样品通过人工去除杂质,然后过220目筛;培养前,以质量比3∶1的比例向新鲜土样中加入灭菌后的去离子水,使土壤成浆;用超高纯度He以100 mL/min冲洗土壤泥浆至少10 min,以去除土壤中溶解的O2。
(3) 实验中所有血清瓶均用丁基橡胶隔片密封,铝盖卷曲;然后将瓶子置于黑暗条件下35 ℃预培养28 d,以去除土壤中原有的氧(O2)、硝酸盐(NO3-)、亚硝酸盐(NO2-)和其他潜在的电子受体。
(4) 预培养完成后,将19 mL均匀的土壤泥浆转移到50 mL血清瓶中,加入5 mL培养基。培养基成分为:2.52 g/L NaHCO3、0.6 g/L KH2PO4、0.4 g/L MgCl2·6H2O、0.1 g/L CaCl2·2H2O、维生素溶液1 mL、微量元素溶液1 mL。每升微量元素成分为:乙二胺四乙酸(EDTA)15 g、ZnSO4·7H2O 430 mg、CoCl2·6H2O 240 mg、MnCl2·4H2O 990 mg、CuSO4·5H2O 250 mg、NaMoO4·2H2O 220 mg、NiCl2·6H2O 190 mg、NaSeO4·10H2O 210 mg、H3BO4·2H2O 14 mg。
(5) 根据实验设计需求加入NH4Cl(5 mmol/L)和水铁矿。水铁矿采用氯化铁溶液和氢氧化钠溶液制备[6]。
(6) 每瓶鼓Ar 5 min后密封,C2H2处理组密封后抽取顶口6 mL气体置换为C2H2,每组做3个平行样。
本文实验分为9个处理体系,实验分组见表2所列。

表2 实验分组
所有需要添加C2H2的处理组,在鼓Ar密封后使用注射器抽取6 mL顶口气体置换为C2H2,使顶空φ(C2H2)达到30%。研究表明,C2H2不仅可以抑制氧化亚氮还原酶活性,阻止N2O还原成N2,还可以抑制厌氧氨氧化(anaerobic ammonium oxidation, Anammox)的过程[4]。所有组均以100 r/min摇晃3 min摇匀,随后将所有小瓶置于35 ℃恒温条件下暗培养28 d。
1.3 指标测定及分析方法
1.3.1 基本指标测定方法
采用Mettler-Toledo pH计测定土壤样品pH值。对于土壤样品的TOC,先经过1 mol/L HCl浸出,除去碳酸盐后采用Jena C/N (3100,TOC,德国耶拿分析仪器股份公司)测定土样中wTOC。对样品土壤使用2 mol/L KCl溶液萃取2 h,然后用气相分子吸收光谱仪(GMA33xx,上海北裕分析仪器股份有限公司)测定土壤中的NH4+、NO3-和NO2-。对于N2的测定,采用气相色谱法(Trace 1300,Thermo气相色谱仪)测定培养后产生的N2。在气体取样完成后,对土壤泥浆进行取样,采用邻菲罗啉法测定盐酸可提取的Fe(Ⅱ)和可提取的总铁[7]。
1.3.2 微生物群落分析
在本实验中,取0.5 g的土壤样品通过FastDNA Spin Kit (美国MP Biomedicals公司)试剂盒提取DNA,采用分光光度计(ND-1000,美国Nanodrop公司)测定所提取DNA的浓度和纯度,然后在-20 ℃保存。为了构建焦磷酸测序基因文库,提取的DNA分别用515F (5-GTGCCAGCMGCCGCGG-3)和806R (5-GGACTACHVGGGTWTCTAAT-3)引物扩增16S rRNA的V4区。聚合酶链反应(polymerase chain reaction,PCR)扩增体系为15 μL 2×Taq master Mix、1 μL Bar-PCR primer F (10 μmol/L)、1μL Primer R (10 μmol/L)、10~20 ng Genomic DNA、无菌水30 μL。PCR程序为:94 ℃ 3 min (初始步骤);94 ℃保持30 s(熔化),在53 ℃保持40 s(退火),在72 ℃保持5 min (延长),进行28个循环。使用16S rRNA PCR产物在Illumina Miseq平台上进行测序,测序服务由商业公司(Majorbio)提供。
1.3.3 分析方法
采用SPSS软件进行标准统计检验。采用方差分析比较N2产率,用Pearson相关分析评价Fe(Ⅲ)还原率与N2产率的相关性。各组间的显著性水平设为p< 0.05。
2 结果与讨论
2.1 N2产生速率
本实验中,所有操作均在厌氧手套箱中进行,以避免发生好氧硝化作用。所有的土壤泥浆均经过28 d的厌氧预培养,以去除土壤中的O2和NOx-。在厌氧培养体系中氨氮直接通过Feammox产生N2,或者通过Feammox产生的NOx-,再耦合Anammox或反硝化过程转化为N2,因此氨氮均需要通过Feammox过程转化[3]。氨氮直接通过Feammox过程产生N2的反应式为:
3Fe(OH)3+5H++NH4+→
3Fe2++9H2O+0.5N2
(1)
氨氮通过Feammox过程氧化为硝酸盐和亚硝酸盐的反应式为:
6Fe(OH)3+10H++NH4+→
6Fe2++16H2O+NO2-
(2)
8Fe(OH)3+14H++NH4+→
8Fe2++21H2O+NO3-
(3)
同时,TOC作为有机质的电子供体,被认为是土壤环境中影响Feammox过程的重要环境因子[8]。本研究中,土壤样品wTOC为1.85%,已报道Feammox发生地中wTOC为0.56%~2.16%[8],本实验土壤wTOC符合Feammox的发生条件。
不同水铁矿浓度下N2产生速率如图1所示。
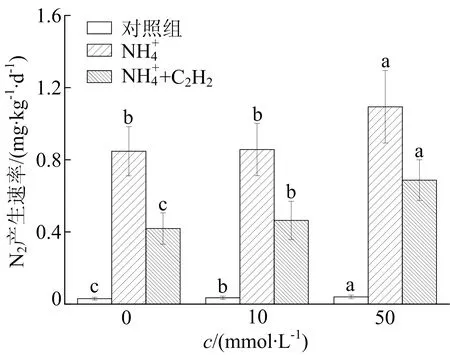
图1 不同水铁矿浓度下N2产生速率
由图1可知,在所有添加NH4+和NH4++C2H2处理组中均能检测到N2生成。由于C2H2抑制了反硝化和Anammox过程,因此可以用NH4+组和NH4++C2H2组N2产生速率的差值表示直接通过Feammox途径产生N2的速率。添加NH4+组N2的产生速率为(0.85±0.14)~(1.09±0.20) mg/(kg·d),添加NH4++C2H2组为(0.42±0.09)~(0.69±0.11)mg/(kg·d)。水铁矿的加入提高了N2的产率,NH4++10 mmol/L水铁矿处理组N2的产生速率为(0.86±0.15) mg/(kg·d),较NH4+处理组提高1.18%。NH4++50 mmol/L水铁矿处理组N2产生速率为(1.09±0.20) mg/(kg·d),较NH4+处理组有显著提高,提高率为28.24%。同时,NH4++C2H2组中的N2产生速率为(0.42±0.09)mg/(kg·d),较NH4+组具有显著差异(p<0.05)。NH4Cl+10 mmol/L水铁矿+C2H2组、NH4Cl+50 mmol/L水铁矿+C2H2组N2产生速率分别为(0.46±0.11) mg/(kg·d)、(0.69±0.11) mg/(kg·d),与NH4+组相比,N2产生速率分别增加9.52%、64.29%(p<0.05)。
文献[9]研究表明,在沉积物、土壤和纯培养3种条件下,当体系中C2H2的分压大于0.7 kPa时,其可以完全抑制反硝化过程中N2O的还原;文献[10]研究发现Anammox对C2H2更敏感,当C2H2分压大于70 Pa时,C2H2对Anammox过程的抑制率为95%。由于所有添加C2H2的实验组中C2H2抑制了反硝化和Anammox过程,添加C2H2组中的N2由氨氮直接通过Feammox过程产生,产生N2速率为0.42~0.69 mg/(kg·d)。当加入水铁矿后,Feammox速率显著提高,表明水铁矿的加入促进了Feammox过程。水铁矿作为非晶体铁氧化物,更易于微生物的生物利用,文献[11]研究表明,在纯培养条件下具有Feammox功能的微生物Acidimicrobiaceaebacterium A6在以水铁矿为电子受体时具有最高的氨氧化速率。水铁矿的加入可为Feammox过程提供更多的电子受体,提高Feammox反应速率。
文献[12]研究表明,Feammox过程可以生成NO3-或NO2-;文献[3]从热力学角度研究表明,可以通过Feammox过程产生NO3-。在本研究中,根据(1)式计算,未添加水铁矿组直接通过Feammox过程N2产生速率为0.42 mg/(kg·d),占Feammox过程所产总N2的49.41%。添加10、50 mmol/L水铁矿组中直接通过Feammox过程产生N2速率分别为(0.86±0.15) mg/(kg·d)、(1.09±0.20) mg/(kg·d),其占Feammox过程所产总N2的54.14%、62.82%,分别比无水铁矿处理组高4.73%、13.41%。因此,水铁矿的加入促进了氨氮直接通过Feammox转化为N2。
2.2 Fe(Ⅲ)还原速率及其相关性分析
不同水铁矿浓度下Fe(Ⅲ)还原速率(以Fe计,下同)如图2所示。

图2 不同水铁矿浓度下Fe(Ⅲ)还原速率
在所有未添加氨氮的对照组中均可检测到Fe(Ⅱ),铁还原速率为0.37~0.41 g/(kg·d),其主要是以有机物为电子供体的异化铁还原过程产生的Fe(Ⅱ)。
向水稻土中加入NH4+后促进了Fe(Ⅲ)的还原,铁还原速率为0.69 g/(kg·d),这是由于体系中发生了以Fe(Ⅲ)作为电子受体的Feammox过程。NH4++10 mmol/L水铁矿组中的Fe(Ⅲ)还原速率较只添加NH4+组显著提高(p<0.05),铁还原速率为0.78 g/(kg·d)。再加入50 mmol/L水铁矿时,随着水铁矿浓度的进一步提升,铁还原速率进一步提高,铁还原速率为0.88 g/(kg·d)。
已有研究表明[11],Feammox过程对于土壤中可利用的铁氧化物具有很强的依赖性,并且土壤中的铁氧化物会促进Feammox过程的进行。在本实验中,对比NH4+组、NH4++10 mmol/L水铁矿组和NH4++50 mmol/L水铁矿组发现,在加入10、50 mmol/L水铁矿后,反应体系中的铁还原速率有显著提高,分别提高13.04%、27.57%。因此,水铁矿的加入促进Fe(Ⅲ)还原过程,同时提高了Feammox反应速率。
由图2可知,相较于对照组,在加入NH4+和水铁矿后,Fe(Ⅲ)的还原速率明显提高。Fe(Ⅲ)作为Feammox过程中重要的影响因素,其还原速率与N2的产生速率具有很强的相关性,R2=0.901,p< 0.01,相关性拟合曲线如图3所示。
从图3可以看出,随着Fe3+还原速率的升高,N2产生速率也相应升高,这进一步说明Fe(Ⅲ)在Feammox过程中发挥了重要作用。文献[13]研究表明,弱酸性土壤提高了金属离子的生物利用度;文献[14]研究表明,充足的有机质有利于土壤黏土矿物中结构性铁的释放,也可能促进Feammox过程的发生。在本研究中,土壤呈弱酸性,富含有机质,更加有利于NH4+作为电子供体、Fe(Ⅲ)作为电子受体,通过Feammox过程将NH4+转化为NOx-或直接转化为N2。
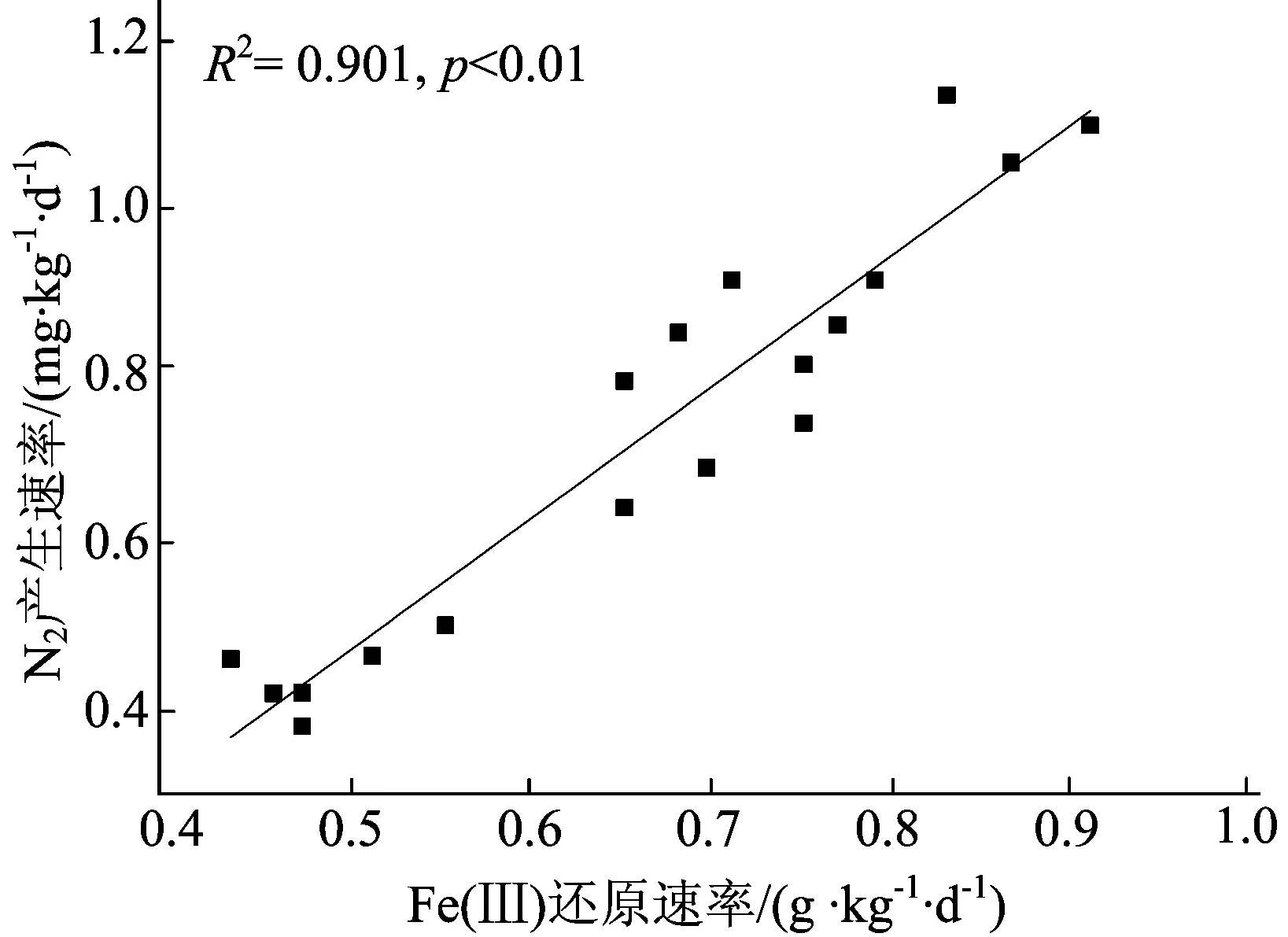
图3 Fe(Ⅲ)还原速率与N2产生速率相关性拟合曲线
2.3 微生物群落分析
不同实验组中主要门的相对丰度如图4所示。
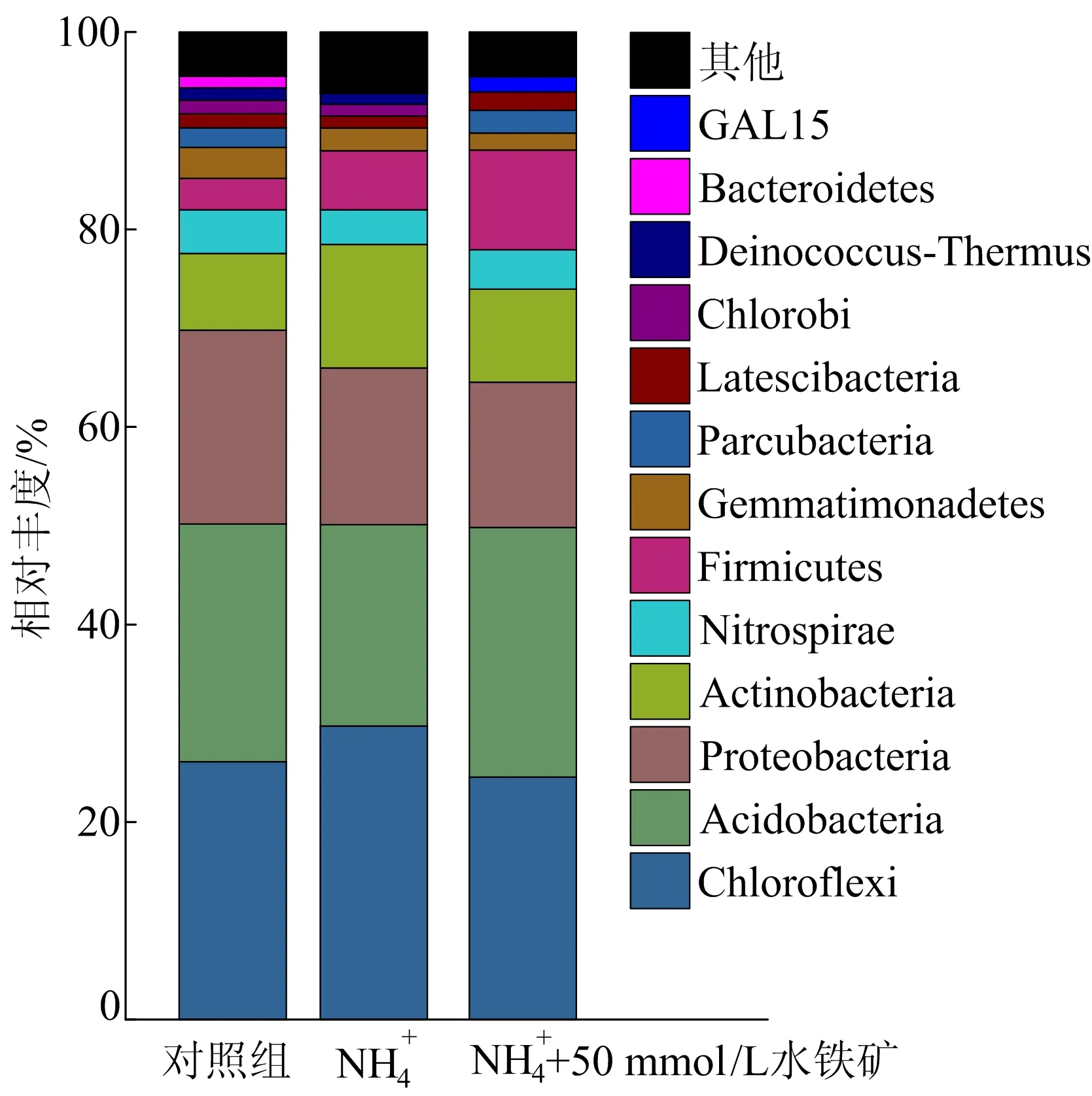
实验组别图4 不同实验组中主要门的相对丰度
在对照组中优势菌种为绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、变形杆菌门(Proteobactria)和放线菌门(Actinobacteria),其相对丰度分别为26.10%、24.07%、19.62%、7.78%。NH4+的添加增加了厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)的相对丰度,相对丰度分别为6.00%、12.51%,相对于对照组分别提高2.79%、4.74%。再添加50 mmol/L水铁矿后厚壁菌门(Firmicutes)的相对丰度进一步提高,相对丰度为10.09%,相对于对照组提高6.88%。据报道,在门水平上,酸杆菌门(Acidobacteria)、变形杆菌门(Proteobactria)、放线菌门(Actinobacteria)和厚壁菌门(Firmicutes)被归类为铁还原菌[15]。已有研究表明,铁还原过程对土壤氮元素迁移转化有显著影响[16]。在Feammox过程中,铁还原微生物可能与N2产生过程有关,铁还原菌的相对丰度随着Feammox速率的增加而提高,但目前对能够直接参与Feammox过程的微生物报道较少,Feammox功能菌尚不明晰[17]。
本研究中厚壁菌门(Firmicutes)的相对丰度约为3.21%~6.01%,其中以梭菌属(Clostridium)为优势微生物,Clostridium是土壤中常见的发酵型异化铁还原菌,能够利用乙酸等有机碳源作为电子供体还原Fe(Ⅲ)[18]。不同实验组中主要属水平微生物相对丰度如图5所示。在对照组中,Clostridium的相对丰度为0.54%,在添加NH4+后其相对丰度达到0.82%,之后随着50 mmol/L水铁矿的加入,其相对丰度进一步提高,达到1.46%。文献[19]研究发现ClostridiumbeijerinckiiZ能够利用有机物还原Fe(Ⅲ)。本研究的土壤呈弱酸性,适合Clostridium生长,同时长期的农业生产过程提供了充足的有机质作为电子供体,在添加50 mmol/L水铁矿处理组中,Clostridium相对丰度显著提高,因此Feammox过程可能与Clostridium具有协同促进作用。
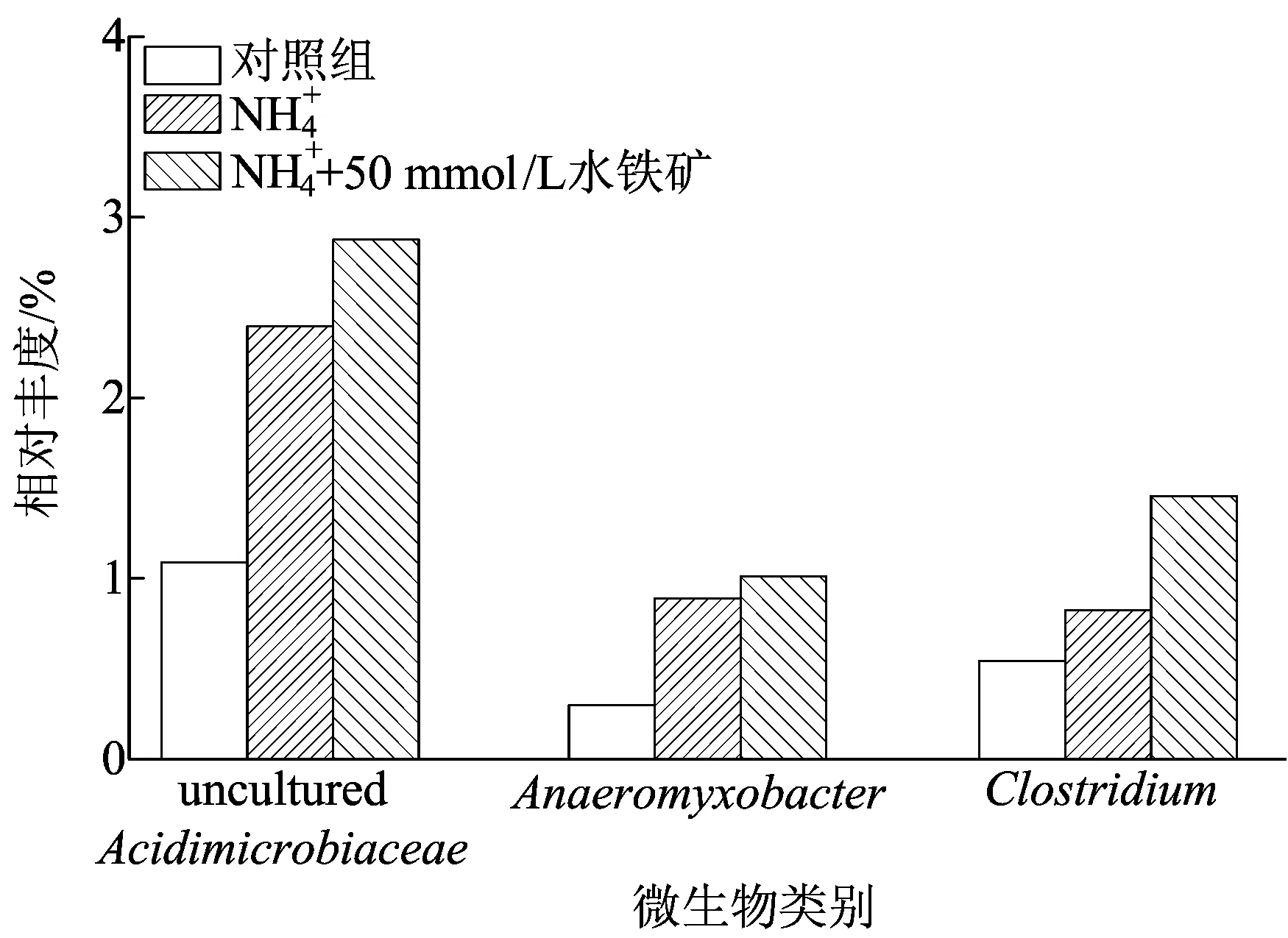
图5 不同实验组中主要属水平微生物相对丰度
Anaeromyxobacter是隶属δ变形菌门的呼吸型异化铁还原菌,广泛分布在厌氧沉积环境中,是一种能够具有金属还原功能的厌氧黏细菌[20]。本研究中,对照组中Anaeromyxobacter的相对丰度为0.29%,在添加NH4+后其相对丰度达到0.89%,再加入50 mmol/L水铁矿后,其相对丰度进一步提高,为1.01%。虽然这些铁还原微生物的丰度与N2的产生有显著的正相关关系,但没有足够的证据表明它们直接参与了Feammox过程。文献[11]分离了一株具有厌氧铁还原耦合氨氧化功能的细菌Acidimicrobiaceaebacterium A6,其可以将氨氮最终氧化为NO2-。本研究还发现一种unculturedAcidimicrobiaceae属微生物,在对照组中,其相对丰度为1.09%,在NH4+组和NH4++50 mmol/L水铁矿处理组中,其相对丰度明显提高,分别达到2.39%、2.87%。然而,由于技术限制,本研究无法对系统中的Acidimicrobiaceae属微生物进行更加详细细致的鉴定。同时,文献[11]报道的Acidimicrobiaceaebacterium A6细菌并不具有将氨氮氧化为N2的能力。Feammox过程功能微生物尚需进一步探究。
3 结 论
(1) 本研究通过模拟培养和乙炔抑制技术证明水稻土中存在Feammox过程,外加水铁矿有利于提高Feammox过程N2产生速率。
(2) 水铁矿的加入能够促进氨氮直接通过Feammox过程氧化为N2,随着水铁矿浓度从10 mmol/L增加到50 mmol/L,Feammox过程直接产N2占总产N2途径的比例从49.41%增加到62.82%。
(3) 高通量测序结果表明,随着Feammox过程产N2速率的增加,unculturedAcidimicrobiacea、Anaeromyxobacter和Clostridium的相对丰度显著提高,其可能参与了Feammox过程,或与Feammox过程具有协同关系。

