新疆克孜勒苏柯尔克孜地区帕米尔牦牛mtDNA COⅠ的遗传多样性分析
高勤学,杨文科,蒙永刚,牙生江·纳斯尔,买买提吐尔干·库瓦西
1.江苏农牧科技职业学院动物科技学院,江苏 泰州 225300;
2.克孜勒苏柯尔克孜自治州畜牧兽医局,新疆 阿图什 845350;
3.克孜勒苏柯尔克孜自治州畜禽繁育改良站,新疆 阿图什 845350
牦牛是主要生长在以青藏高原为中心及其比邻的高山、亚高山等海拔2 000—5 500 m以上的高原地区的珍奇稀有牛种[1]。帕米尔牦牛主要分布于新疆克孜勒苏柯尔克孜自治州(以下简称克州)、喀什地区塔什库尔干县境内,是经过长期自然选择和人工选育形成的乳肉兼用型的牦牛品种。2021年10月,经过国家畜禽遗传资源委员会现场鉴定审核,帕米尔牦牛被农业农村部列为畜禽遗传资源,并入选全国十大新发现畜禽遗传资源之一。帕米尔牦牛形成历史悠久,血统来源清晰,群体外貌特征与生产性能基本一致,主要性状遗传稳定,且耐粗饲,对帕米尔高原高海拔的自然生态环境具有良好的适应性。然而,由于受帕米尔高原地区高寒、干旱、自然灾害等自然环境的影响,先前的帕米尔牦牛个体整体偏小。随着人民生活水平的不断提高,国民对高品质牛肉及奶制品的需求日益增多,帕米尔牦牛因其牛乳的乳蛋白含量高[2],越来越受到人们的关注,同时牦牛肉价格也不断上涨。为了增加产肉量和牧民的收入,近几年帕米尔牦牛主产区也陆续开始对帕米尔牦牛进行杂交改良,希望改良帕米尔牦牛的体型。自2008年以来,克州3个县市分别从青海、西藏以及新疆巴音郭楞蒙古自治州和静县引进种公牦牛共计1 125头,对帕米尔牦牛进行遗传改良。目前,克州大约有青海高原牦牛、西藏高山牦牛、巴州牦牛的杂交后代约2万头。从整体上看,杂交个体普遍较没有引种的阿合奇县牦牛大,杂交改良的效果已经显现。此外,不同海拔地区的牦牛与帕米尔牦牛杂交改良,是否会改变新疆帕米尔牦牛的遗传多样性和高原低氧适应性等并不明确,因此急需通过测序等手段分析帕米尔牦牛群体的遗传多样性水平和进化关系。
线粒体细胞色素c氧化酶亚基Ⅰ(cytochrome oxidase Ⅰ,COⅠ)是线粒体DNA(mitochondrial DNA,mtDNA)的一段蛋白质编码基因,也是线粒体13个蛋白编码基因中研究最为透彻的基因之一[3],具有相对保守与变异稳定等优点,可用于区分亲缘关系相近的物种,因此被广泛应用于研究物种的遗传多样性和群体结构[4-5]。翁茁先等[6]利用线粒体COⅠ基因对我国乌骨鸡的遗传多样性和群体遗传结构进行了系统分析研究;向超等[7]对中甸牦牛mtDNAND6和COⅢ基因的全序列进行测定,分析其遗传多样性及系统进化关系,进一步证实了应将牦牛和野牦牛划分为牛亚科牦牛属;郭娇等[8]对西藏牦牛的mtDNACOⅠ基因全序列进行测序,研究西藏牦牛的群体遗传多样性及系统进化关系。本研究以帕米尔牦牛中心产区——克州阿克陶县、阿图什市、阿合奇县的牦牛群体为研究对象,测定其线粒体COⅠ基因序列,通过构建系统进化树来分析其遗传多态性。这也是帕米尔牦牛被正式命名以来,首次对其遗传多样性和系统进化关系进行的研究。旨在为畜禽遗传资源的保护及开发提供参考依据,为下一步建立保种场、建设良种繁育体系奠定基础,同时也为推动当地牦牛产业的振兴提供理论指导。
1 材料与方法
1.1 样品采集和试验材料
选取来自帕米尔牦牛中心产区的克孜勒苏柯尔克孜自治州的阿克陶县布伦口乡、阿图什市哈拉峻乡、阿合奇县苏木塔什乡的成年健康牦牛115头(表1),使用EDTA抗凝管采集牦牛新鲜静脉血样5 mL,放入4℃冰盒中带回实验室,于-20℃保存备用。血液基因组DNA提取试剂盒购自无锡百运纳米科技有限公司;DL2000 DNA Marker购自宝生物工程(大连)有限公司;琼脂粉和核酸染料购自南京擎科生物科技有限公司;QuickTaqHS Dye-Mix购自东洋纺(上海)生物科技有限公司;凝胶回收试剂盒购自无锡百运纳米科技有限公司;Nano-Drop 2000超微量分光光度计和PCR仪(ABI system Veriti®96-Well Fast Thermal Cycler)购自赛默飞世尔公司;DYY-6C型电泳仪购自北京六一仪器厂。
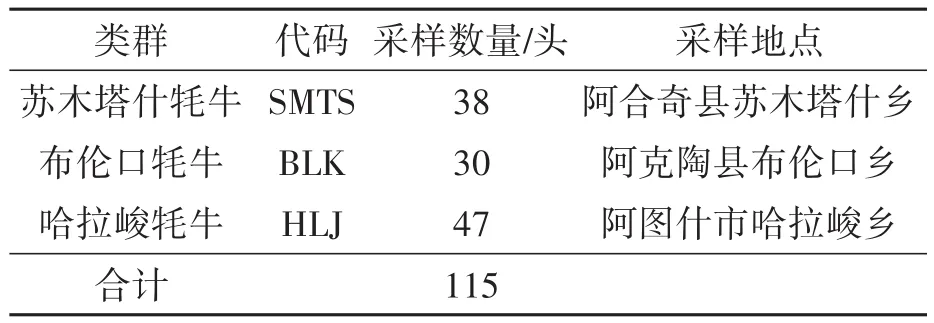
表1 试验牦牛类群、数量及采样地点Table 1 Test yak groups,number and sampling location
1.2 基因组提取、PCR扩增及COⅠ基因测序
使用血液基因组DNA提取试剂盒提取牦牛血液的基因组DNA。使用NanoDrop 2000超微量分光光度计检测DNA浓度和质量,用1%的琼脂糖凝胶电泳检测DNA的纯度后,于-20℃保存备用。以牦牛线粒体基因组DNA为PCR扩增模板,使用Primer 5.0设计mtDNA COⅠ基因引物F:5′-GTCTAATGCTTTACTCAGC-3′和 R:5′-GAGGTTATGATGTTGGCTTG-3′进行PCR扩增,引物由英维捷基(上海)贸易有限公司合成。PCR扩增反应体系(25 µL):DNA模板2.5 µL(100 ng·µL-1),上下游引物各 1 µL(10 pmol·µL-1),2×Quick Taq HS Dye Mix预混合酶12.5µL,灭菌ddH2O 8µL。PCR扩增的反应条件:95℃预变性5 min;95℃变性45 s,58℃退火35 s,72℃延伸1 min,8个循环;95℃变性45 s,68℃退火延伸95 s,27个循环;72℃延伸7min,4℃保存。PCR扩增完成后,取2µL产物在1%的琼脂糖凝胶电泳验证PCR扩增结果,使用凝胶回收试剂盒进行纯化、回收后送往上海立菲生物技术有限公司进行测序。
1.3 比对数据来源
从 NCBI获 得 野 牦 牛(GenBank:NC_025563.1)、巴州牦牛(GenBank:MN175233.1)、青海高原牦牛(GenBank:KR011113.1)、麦洼牦牛(GenBank:MK796240.1)、西藏高山牦牛(Gen-Bank:GU256940.1)、天 祝 白 牦 牛(GenBank:KM233416.1)、甘南牦牛(GenBank:KJ704989.1)、帕里牦牛(GenBank:KR052524.1)、九龙牦牛(GenBank:GQ464284.1)、大通牦牛(GenBank:KJ463418.1)、中甸牦牛(GenBank:MT850134.1)、娘亚牦牛(GenBank:MN319467.1)、斯布牦牛(GenBank:MN398192.1)、金川牦牛(GenBank:MN176980.1)、环湖牦牛(GenBank:MK124955.1)、雪多牦牛(GenBank:MK124956.1)、玉树牦牛(GenBank:MK704512.1)线粒体DNA测序结果以及山羊(GenBank:NC_005044.2)作为外群体COⅠ基因序列的来源。
1.4 数据处理及分析
首先使用DNAstar软件中的内置模块SeqMan对测序序列进行拼接和剪切处理;其次使用MEGA 10.1软件[9]对同源序列进行比对分析;然后使用DNASP 6.0软件[10]分析新疆帕米尔牦牛的DNA多态性,包括核苷酸多样性和单倍型多样性等;随后对突变位点进行Tajima's D中性检验[11];最后使用MEGA 5.0软件,统计变异信息、转换颠换信息,自展值(Bootstrap)设定为1 000进行构建系统进化树,并计算各类群牦牛COⅠ基因序列的遗传距离,邻接法(Neighbor-Joining,NJ)构建系统进化树[12]。
2 结果与分析
2.1 COⅠ基因PCR扩增
对新疆帕米尔地区3个牦牛类群共115头个体,进行mtDNA COⅠ基因扩增,用2%的琼脂糖凝胶电泳检测扩增结果,扩增产物大小约1 600 bp,条带清晰,明亮且单一,无特异性扩增产生(图1),提示COⅠ基因PCR扩增满足产物测序的要求。由图1可知,部分牦牛个体PCR产物无条带,提示部分个体扩增不成功,因此只将扩增成功且质检合格的42头帕米尔牦牛的PCR产物送公司测序。
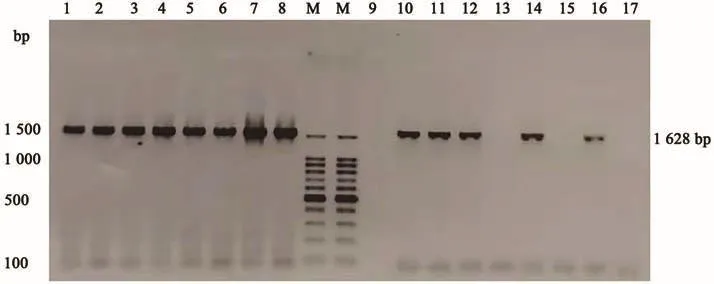
图1 新疆帕米尔牦牛mtDNA COⅠ基因PCR扩增Fig.1 PCR amplification of mtDNA COⅠgene of Pamir yaks in Xinjiang
2.2 新疆帕米尔牦牛mtDNA COⅠ序列的核苷酸组成
将测序结果使用DNAstar软件中的内置模块SeqMan进行拼接和剪切处理;使用MEGA 10.1软件与牦牛线粒体参考基因组(麦洼牦牛,Gen-Bank:AY684273.2)进行比对分析。结果发现:新疆帕米尔牦牛COⅠ基因全序列长度为1 048 bp,个体间序列长度无差异;无内含子,起始密码子为AUG(ATG),终止密码子为TAA,共编码349个氨基酸。T、C、A和G 4种核苷酸的平均比例分别为30.1%(29.9%~30.4%)、24.3%(23.9%~24.6%)、29.6%(29.3%~29.8%)和16.0%(15.8%~16.4%);A+T含量为59.7%;G+C含量为40.3%,提示新疆帕米尔牦牛mtDNA COⅠ序列的核苷酸组成具有明显的碱基偏好性。
2.3 新疆帕米尔牦牛COⅠ基因的遗传多样性
使用DNASP 6.0软件计算新疆帕米尔牦牛COⅠ基因序列的核苷酸多样性和单倍型多样性(haplotype diversity,Hd),共发现 10种单倍型,由表2、表3可知,无论从单倍型数、单倍型多样性还是核苷酸多样性来分析都表明苏木塔什牦牛的遗传多样性最高,而哈拉峻牦牛的遗传多样性最低。此外,单倍型多样性和核苷酸多样性值的变化范围基本一致,这表明两者具有较强的相关性。
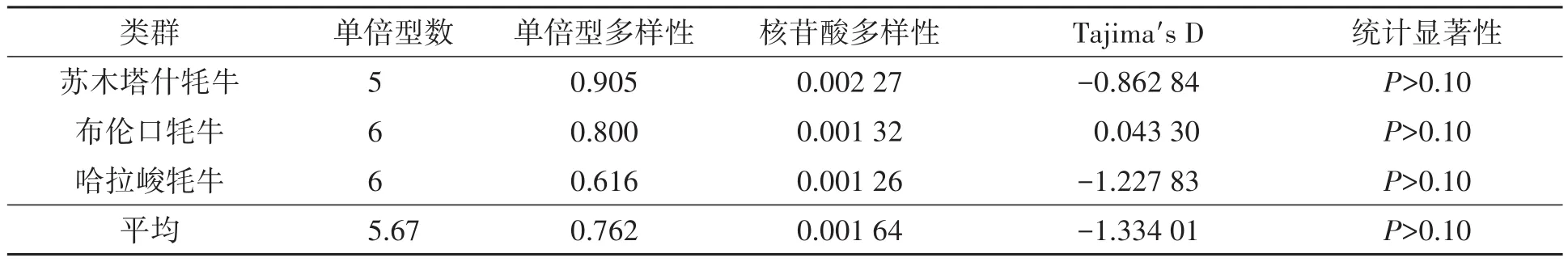
表2 新疆帕米尔牦牛的单倍型多样性和核苷酸多样性Table 2 Haplotype diversity and nucleotide diversity of Pamir yaks in Xinjiang
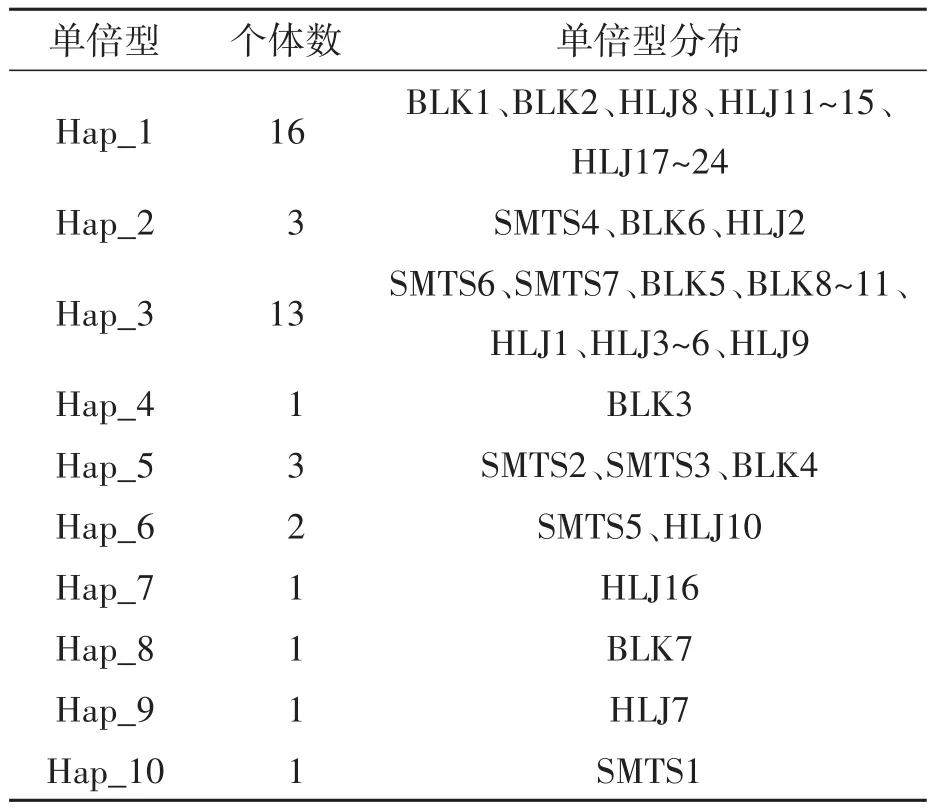
表3 新疆帕米尔牦牛的mtDNA COⅠ的单倍型分布Table 3 mtDNA COⅠgene haplotypes of Pamir yaks in Xinjiang
将本研究所测序列与牦牛线粒体全基因序列(AY684273.2)中的mtDNACOⅠ的核苷酸序列比对分析后,发现不变位点1 035个,可变位点13个,其中单态突变位点9个(位于4、5、6、14、30、38、155、217和478 bp处)、简约信息位点4个(位于92、302、497和649 bp处),包含转换和颠倒2种核苷酸变异类型,未发生插入删除事件。其中转换11次(占84.62%),A↔G间的转换6次(占54.5%),C↔T间的转换5次(占45.5%);颠换有2个(占15.38%),均为T↔G间的颠换。新疆帕米尔牦牛COⅠ基因在650~1 048 bp之间有1个保守区域,在该保守区域内,A、T含量为60.15%,序列保守度C为0.988;Tajima's D为-1.334 01,提示中性检验结果不显著(P>0.10),说明新疆帕米尔牦牛在较近的一段时期内没有出现种群扩张现象。
新疆帕米尔地区3个牦牛类群的单倍型多样性变化范围为0.616~0.905(表2),苏木塔什牦牛的单倍型多样性最高为0.905,哈拉峻牦牛的单倍型多样性最低为0.616;核苷酸多样性变化范围在0.001 26~0.002 27之间,其中苏木塔什牦牛的核苷酸多样性最高为0.002 27,其次是布伦口牦牛0.001 32,最低的是哈拉峻牦牛0.001 26。提示单倍型多样性和核苷酸多样性值变化范围基本一致,具有较强的相关性。
2.4 新疆帕米尔牦牛COⅠ的氨基酸组成
利用MEGA 6.0软件将新疆帕米尔牦牛COⅠ基因序列转换成氨基酸序列,推算COⅠ基因编码蛋白的氨基酸序列组成(表4)。结果表明,在3个牦牛类群中,COⅠ编码的蛋白均含有20种氨基酸,共由322个氨基酸组成,其中谷氨酸(Glu)、甘氨酸(Gly)、异亮氨酸(Ile)、丝氨酸(Ser)、苏氨酸(Thr)等5种氨基酸在牦牛类群间存在一定差异。异亮氨酸平均含量最多(13.059%),色氨酸的平均含量最少(0.311%)。碱性氨基酸、酸性氨基酸的含量分别为13.665%、8.548%;亲水性氨基酸、疏水性氨基酸分别为39.141%、60.859%。
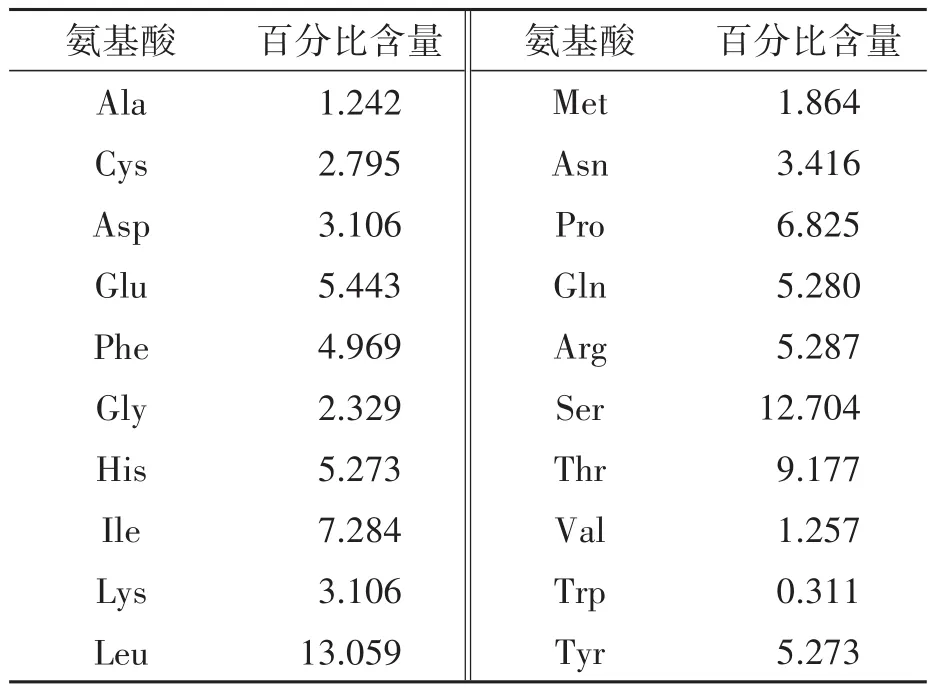
表4 新疆帕米尔牦牛COⅠ的氨基酸组成Table 4 COⅠaverage amino-acid composition of Pamir yaks in Xinjiang /%
2.5 新疆帕米尔牦牛类群间的遗传距离及其分类
利用MEGA 10.1软件对新疆帕米尔地区3个牦牛类群mtDNACOⅠ基因核苷酸序列进行分析,发现各类群间的遗传距离变化范围为0.003 72~0.005 22之间。其中,苏木塔什牦牛与哈拉峻牦牛的遗传距离最大(0.005 22),而苏木塔什牦牛与布伦口牦牛的遗传距离最小(0.003 72)(表5、图2、图3)。这提示新疆帕米尔地区3个牦牛类群间的遗传距离差异较小。
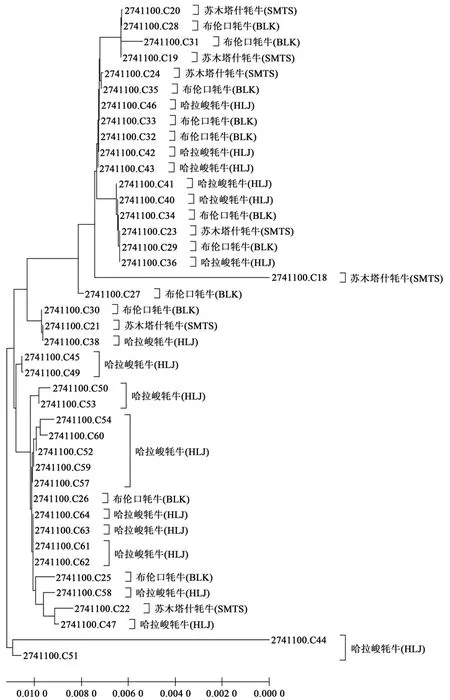
图2 基于kimura双参数遗传距离的新疆帕米尔牦牛类群间的NJ聚类关系Fig.2 NJ tree based on kimura 2-parameter distance between groups of Pamir yaks in Xinjiang

图3 基于kimura双参数遗传距离的新疆帕米尔牦牛类群间的UPGMA聚类关系Fig.3 UPGMA tree based on kimura 2-parameter distance between groups of Pamir yaks in Xinjiang
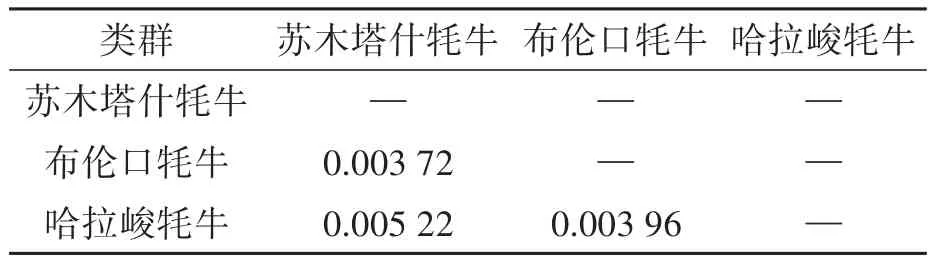
表5 新疆帕米尔牦牛类群间的kimura双参数遗传距离Table 5 Kimura 2-parameter genetic distance between Pamir yaks breeds in Xinjiang inferred from kimura
2.6 新疆帕米尔牦牛系统进化研究
选取野牦牛和《国家畜禽遗传资源品种目录(2021年版)》[13]收录的15个牦牛地方品种——巴州牦牛、青海高原牦牛、麦洼牦牛、西藏高山牦牛、天祝白牦牛、甘南牦牛、帕里牦牛、九龙牦牛、中甸牦牛、娘亚牦牛、斯布牦牛、金川牦牛、环湖牦牛、雪多牦牛、玉树牦牛以及1个培育品种——大通牦牛的线粒体DNA测序结果以及山羊作为外群体COⅠ基因序列的来源,用邻接法构建系统发育树(图4)。结果显示哈拉峻牦牛首先与甘南牦牛和九龙牦牛聚在一起,紧接着与天祝白牦牛聚在一起,其他13个地方牦牛品种和野牦牛聚在一起后依次与布伦口牦牛、苏木塔什牦牛一支聚在一起,山羊独立于牛亚科物种之外。
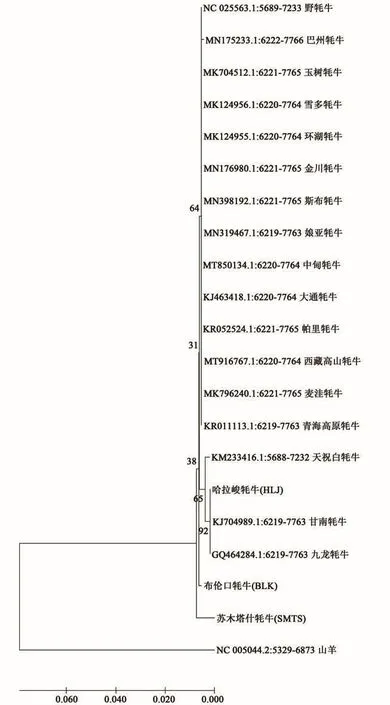
图4 基于NJ法构建21个物种的COⅠ基因系统进化树Fig.4 The phylogenetic tree of COⅠgene of 21 species based on NJ method
3 讨论
种群多样性是物种进化和维护生态系统平衡的重要驱动力,而物种内变异是保证生物多样性的一个重要前提,有时甚至比物种间变异具有更强的生态效应[14-15]。本研究通过对帕米尔地区3个牦牛类群的mtDNACOⅠ基因序列进行测定,分析了帕米尔牦牛的遗传多样性和群体遗传结构,有助于了解帕米尔高原地区生物多样性及保护该地区的生态系统。结果发现帕米尔牦牛mtDNACOⅠ基因序列长度为1 048 bp,这与前人报道的西藏牦牛mtDNACOⅠ基因序列长度有一定的差别,这可能是由于牦牛品种差异导致的。经过与牦牛参考序列进行比对后,发现COⅠ基因存在13个单核苷酸多态性(single nucleotide polymorphism,SNP)位点,大部分为转换(占84.62%),无插入、缺失现象,这符合COⅠ基因保守的特征[16]。此外,帕米尔牦牛mtDNACOⅠ基因A+T含量(59.7%)明显高于G+C含量(40.3%),具有一定的碱基偏好性。这与Song等[17]研究的西藏牦牛COⅢ基因,胡丹等[18]研究的新疆塔什库尔干牦牛Cytb基因富含A和T的结果一致。此外,大多数哺乳动物线粒体DNA也具有A、T含量偏高的普遍特征[19-20],这体现了动物线粒体DNA碱基组成的基本特点。
物种的遗传多样性大小是长期进化的产物,是其生存适应和发展进化的前提[21]。遗传多样性越高或遗传变异越丰富,其对环境变化的适应能力就越强[22]。因此,分析帕米尔牦牛的遗传多样性对该地区牦牛产业的可持续发展具有重要意义。Hd和Pi是从群体水平上评价某物种遗传多样性的重要指标,Hd和Pi的值越大,表明该类群的遗传多样性越丰富[23]。本研究发现帕米尔牦牛类群的COⅠ基因有13个变异位点,Hd和Pi分别为0.762、0.001 64。这低于新疆塔什库尔干牦牛的遗传多样性(Hd=0.778,Pi=0.008 39)[18],但高于王兰萍等[24]对新疆巴州Cytb基因(Hd=0.331,Pi=0.001 02)的研究结果。这说明新疆帕米尔牦牛mtDNACOⅠ基因的核苷酸替代率较高,具有丰富的遗传多样性和单倍型多样性。同时,也侧面反映出随着近些年新疆维吾尔自治区各地州政府对畜牧业的不断重视,从西藏自治区、青海省等地引进了高质量种公牛及其冻精,显著提高了新疆帕米尔牦牛的遗传多态性。
Tajima's D常用于检验统计群体基因数据,检验的目的是区分随机演变的DNA序列和在非随机过程中演化的DNA序列[25]。Tajima's D值为正数时,说明序列进化方式为平衡选择,且有一些单倍型分化;负值时说明为负向选择或者群体扩张。Tajima's检验如果差异不显著,则表示目标序列在进化上遵循中性模型[11]。在本研究中,帕米尔地区3个牦牛类群的Tajima D值为-1.334 01,且中性检验结果不显著(P>0.10)。这表明该地区的牦牛
在受到人工或者自然选择后,群体发生了扩张现象,同时线粒体DNA序列在进化上遵循中性模型。
群体间的遗传分化、遗传差异主要根据遗传距离大小来评价。在进化过程中,群体间遗传分化越大,其遗传距离值就越大[26]。根据双参数遗传距离,对新疆帕米尔地区3个牦牛类群进行聚类分析,依据NJ和UPGMA聚类关系构建进化树,发现苏木塔什牦牛与哈拉峻牦牛的遗传距离最大,而与布伦口牦牛的遗传距离最小,各类群间的遗传距离介于0.003 72~0.005 22之间。帕米尔地区3个牦牛类群的划分并不明显,各类群内的牦牛个体没有完全聚类到一起,这表明新疆帕米尔地区3个牦牛类群间的遗传距离差异较小,遗传分化不明显。同样地,有研究表明,西藏牦牛的多个类群的平均遗传距离为0.001 452,这与本研究结果基本一致[17]。然而,中国黄牛品种间的平均遗传距离较大(0.012 71±0.002 62),遗传分化差异较大[27]。这可能是由于牦牛产区本身就分布于高寒地区,且近年来的引种杂交、基因交流频繁导致牦牛群体遗传分化不明显,同时也一定程度上印证了牦牛“单一起源于野牦牛”的假说[28]。本研究基于COⅠ基因的牛亚科系统聚类分析得出哈拉峻牦牛首先与甘南牦牛和九龙牦牛聚在一起,紧接着与其他14个地方牦牛品种和野牦牛聚在一起。这表明哈拉峻牦牛与甘南牦牛和九龙牦牛亲缘关系较近。导致这一现象发生的主要原因是近年来克州地区人为对帕米尔牦牛进行改良育种。阿图什市从2009年陆续引进西藏种公牦牛45头,甘南牦牛分布在甘南藏族自治州境内,九龙牦牛分布在四川省甘孜藏族自治州,本身就是藏族同胞的居住地,在地理位置上较接近,因此有血缘渗入。此外,布伦口牦牛和苏木塔什牦牛与其他牦牛亲缘关系相距较远,可能是品种内部的差异导致。
本研究通过对帕米尔牦牛的线粒体COⅠ基因序列分析,发现帕米尔牦牛具有丰富的遗传多样性,且受到人工或者自然选择后,群体发生了扩张和基因交流的情况,但是各类群之间遗传分化不明显。本研究为新疆帕米尔牦牛的遗传改良及新疆优良畜禽遗传资源的保护和开发提供了科学依据。

