海洋藻栖真菌多样性及其活性研究
侯旭亮,宋银平,季乃云*
(1.中国科学院烟台海岸带研究所,山东 烟台 264003;2.中国科学院大学,北京 100049)
天然产物是现代药物研发的重要源泉,有相当数量的药物来源于天然产物或是以天然产物骨架为模板合成的类似物或拟药[1]。但是经过长时间的开发,从陆生生物次级代谢产物中发现新药或先导化合物的难度越来越大,抗药性问题也日益严重。而海洋生物量占地球生物总量的80%以上,同时,由于海洋生态环境的特殊性,海洋生物次级代谢产物的生物合成途径和酶反应系统与陆生生物有着巨大的差异,导致海洋生物,尤其是海洋微生物,在次级代谢产物研究上相比陆生生物具有一些显著的优势[2]。
海洋藻栖真菌主要指栖息于海藻或与海藻相关的丝状真菌,但不包括来自海草的丝状真菌[3]。近年来,海洋藻栖真菌来源的天然产物已成为研究者关注的热点,已有数百种新型天然产物被分离和鉴定,具有广泛的生物活性,包括抗癌、抗病毒、抗氧化、酶抑制或活化活性[3-5]。从海洋藻栖真菌次级代谢产物中发现的具有抗菌活性的新型化合物占海洋真菌来源的近76%[6]。可见,海洋藻栖真菌是天然产物研究中发现新药或先导化合物的重要来源。
为进一步了解海洋藻栖真菌的多样性及其生物活性,作者以在烟台海岸带采集的海藻为对象,分离内生真菌及附生真菌,通过形态学观察及ITS序列分析对藻栖真菌进行鉴定,并对其抗菌活性、抗微藻活性及海洋动物毒性进行评价,以期筛选出活性较高并具有较低毒性的良好菌株,为下一步次级代谢产物的分离奠定基础。
1 实验
1.1 材料、试剂与仪器
2020年8月从烟台栈桥附近的海岸带采集了33份新鲜海藻样品,包括江蓠、松节藻、凹顶藻、马尾藻、酸藻等,低温保存。
供试细菌:柠檬交替假单胞菌(Pseudoalteromonascitrea)、鳗弧菌(Vibrioanguillarum),保藏于实验室。供试微藻:东海原甲藻(Prorocentrumdonghaiense)、海洋卡盾藻(Chattonellamarina),保藏于实验室。供试海洋动物:丰年虾(Artemiasalina),为实验室保存卵孵化;褶皱臂尾轮虫(Brachionusplicatilis),青岛农业大学。
马铃薯葡萄糖琼脂(PDA),北京路桥技术股份有限公司;真菌培养基,青岛高科技工业园海博生物技术有限公司;葡萄糖、味精,国药集团化学试剂有限公司;酵母浸粉,北京双旋微生物培养基制品厂;蛋白胨,北京奥博生物技术有限责任公司;氯霉素。
洁净工作台,苏净集团苏州安泰空气技术有限公司;立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;恒温恒湿箱,上海一恒科学仪器有限公司。
1.2 真菌的分离及保藏
附生真菌的分离:将海藻样品用无菌海水至少冲洗3次,再将整株海藻或海藻的一部分置于加入适量氯霉素的PDA培养基中,28 ℃下培养2~3 d,待长出菌落后,使用接种针反复接种直至得到单一的附生真菌。
内生真菌的分离:采用组织块培养法[7],将海藻样品表面灭菌,用无菌海水冲洗3次,用75%乙醇浸泡灭菌1~2 min[8],再用无菌海水冲洗表面残余的乙醇,切成小块置于PDA培养基中。同上述步骤,从海藻切口处生长的菌落中分离得到单一的内生真菌。
采用超低温冷冻保藏法[9]对分离纯化后的菌株进行保藏。使用真菌培养基配制真菌培养液,灭菌,在冻存管中加入0.9 mL真菌培养液;将菌株接种至PDA培养基中,待菌落生长旺盛时,取适量菌落加入冻存管中,24 h后加入0.9 mL灭菌的50%甘油溶液,摇匀,使甘油终浓度为25%;将冻存管置于-80 ℃冰箱中保存,每种菌株保存3份。
1.3 藻栖真菌的鉴定
采用针对真菌核糖体RNA基因序列的通用引物ITS1和ITS4对真菌 rDNA序列进行PCR扩增[10],ITS1的碱基序列为5′-TCCGTAGGTGAACCTGCGG-3′,ITS4的碱基序列为5′-TCCTCCGCTTATTGATATGC-3′。PCR产物送青岛睿博生物技术有限公司测序,所得序列在GenBank数据库中进行相似性分析,结合形态学特征,鉴定真菌的属别。
1.4 真菌粗提物的制备
大米培养基:将12 g大米、20 mL培养液加入800 mL锥形瓶中,培养液成分为葡萄糖 20 g、蛋白胨 5 g、酵母浸粉5 g、味精5 g、淡水1 L。
将真菌在大米培养基中于25 ℃下发酵培养21 d,加入适量乙酸乙酯浸泡杀菌;过滤,分离发酵液和菌丝体。发酵液用乙酸乙酯多次萃取,有机相减压旋蒸浓缩,得到发酵液粗提物;菌丝体晾干后粉碎,用乙醇多次浸泡提取,过滤,有机相减压旋蒸浓缩,得到菌丝体提取物。二者所含成分基本相同,合并,得到真菌粗提物。
1.5 活性测试
1.5.1 抗菌活性测试
采用滤纸片扩散法[11],通过测量抑菌圈直径评价真菌粗提物的抗菌活性。供试细菌为柠檬交替假单胞菌和鳗弧菌,用比浊法稀释至5×104CFU·mL-1,真菌粗提物加量为20 μg/片,阳性对照为氯霉素。
1.5.2 抗微藻活性测试[12]
取对数生长期的供试微藻,用f/2培养基稀释至微藻细胞浓度约5×104个·mL-1。取96孔板,每孔加入195 μL 藻液,在20 ℃、光照强度为2 000 Lux、光暗比为14∶10(h∶h)的条件下,培养24 h。利用血球计数板在显微镜下观察记录死亡微藻数和微藻总数,计算微藻抑制率。样品组、空白组和对照组各设3个平行。样品组加入5 μL浓度为4 mg·mL-1的真菌粗提物溶液,溶剂为DMSO;空白组加入5 μL DMSO;对照组加入5 μL浓度为4 mg·mL-1的K2CrO7溶液。
1.5.3 海洋动物毒性测试
将400 mL抽滤后的海水、100 mg丰年虾卵加入到500 mL烧杯中,通入空气,室温孵化24 h,去除未孵化的卵和卵壳后,继续培养24 h,待用。采用Solis改良法,取96孔板,每孔加入195 μL 备用液,约有15个丰年虾幼体,培养24 h后,在解剖镜下观察记录死亡丰年虾数和丰年虾总数,计算致死率[13]。样品组、空白组和对照组各设3个平行。样品组加入5 μL浓度为4 mg·mL-1的真菌粗提物溶液,溶剂为DMSO;空白组加入5 μL DMSO;对照组加入5 μL浓度为4 mg·mL-1的K2CrO7溶液。
25 ℃下,分别以小球藻、盐藻和扁藻制成的浓缩藻液为饵料培养褶皱臂尾轮虫,实验开始前24 h停止投喂饵料,备用。取96孔板,每孔加入195 μL备用液,约有10个健康轮虫,培养24 h后,在解剖镜下观察记录死亡轮虫数和轮虫总数,计算致死率[14]。样品组、空白组和对照组各设3个平行。样品组加入5 μL浓度为4 mg·mL-1的真菌粗提物溶液,溶剂为DMSO;空白组加入5 μL DMSO;对照组加入5 μL浓度为4 mg·mL-1的K2CrO7溶液。
2 结果与讨论
2.1 真菌的分离及鉴定
通过形态观察,从33份海藻样品中分离获得无重复真菌菌株124株,其中内生真菌47株,附生真菌77株。将菌株的ITS序列在GenBank数据库中通过BLAST搜索,均可以找到相似度在98%以上的相似序列,并基于Neighbor-Joining(N-J)法,使用MEGA构建系统发育树(图1)。将ITS序列的对比分析结果与真菌形态及菌丝体特征观察相结合,有102株真菌鉴定到属,主要包括59株木霉属真菌、11株曲霉属真菌、9株镰刀菌属真菌、4株青霉属真菌及一些其它真菌(表1)。
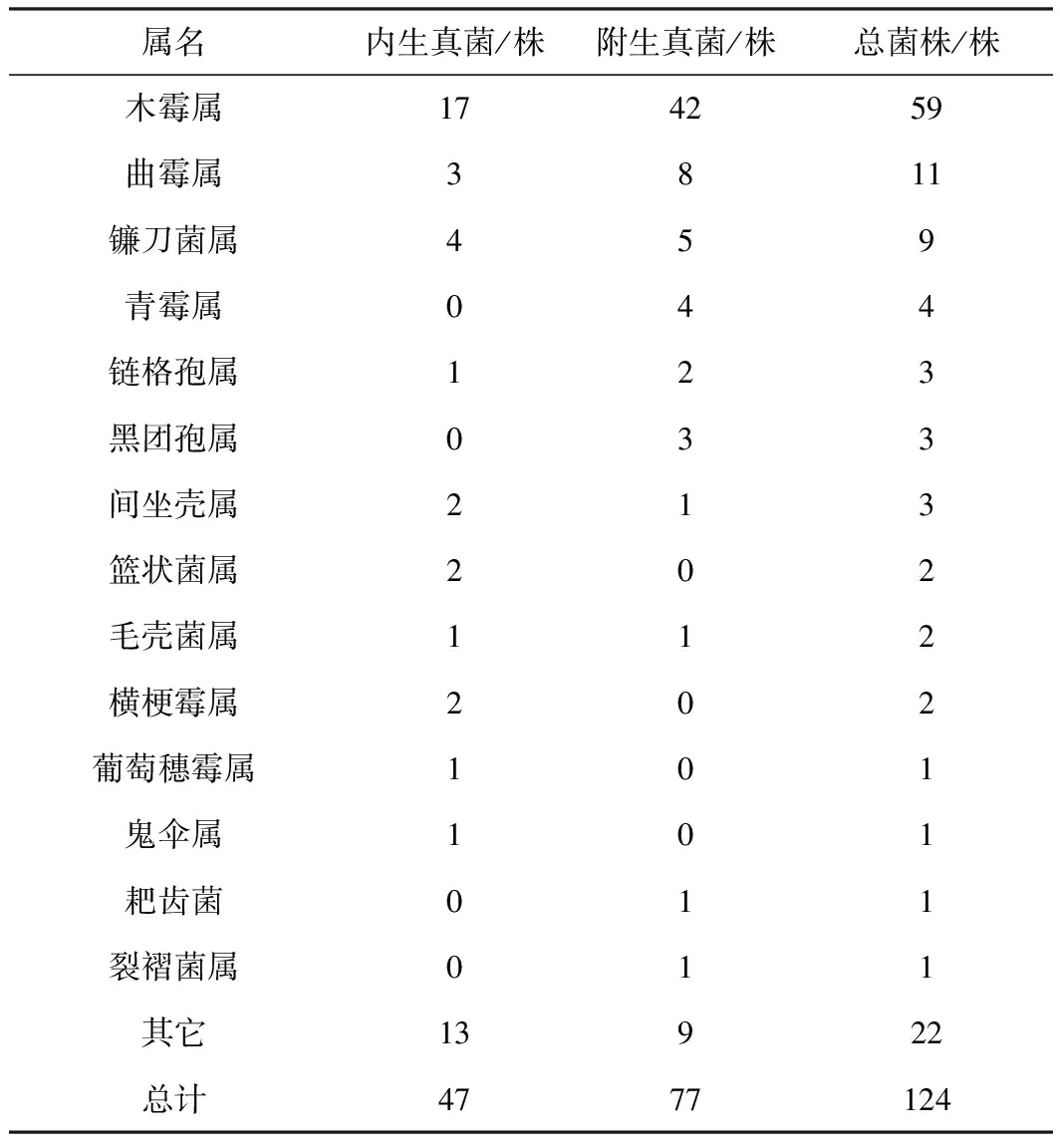
表1 藻栖真菌的分离及鉴定
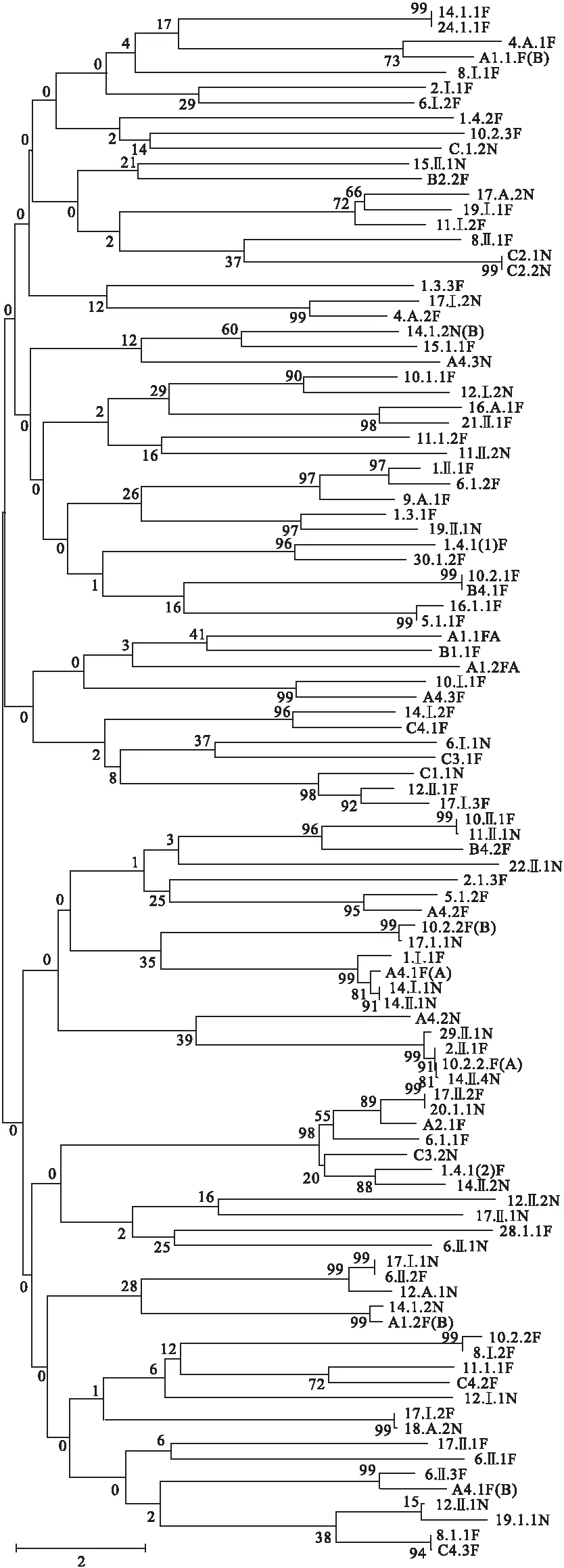
图 1 基于N-J法对102株藻栖真菌的ITS-rDNA序列构建的系统发育树
2.2 活性测试结果
2.2.1 抗菌活性
以柠檬交替假单胞菌和鳗弧菌为指示菌,挑选出62株真菌,测定其真菌粗提物的抑菌活性。结果显示,有40株真菌对柠檬交替假单胞菌表现出了抑菌活性,占菌株总数的64.5%;只有4株真菌对鳗弧菌表现出较弱的抑菌活性,菌株编号分别为12.Ⅱ.2N、19.Ⅰ.1F、B4.1F、C2.1N,分别属于镰刀菌属、黑团孢属、木霉属、横梗霉属,这4株真菌对2种致病菌均表现出了一定的抑菌活性。
2.2.2 抗微藻活性
以东海原甲藻和海洋卡盾藻为模型,挑选出62株真菌,测定其真菌粗提物的抗微藻活性。结果显示,对东海原甲藻抑制率大于50%的真菌有24株,占菌株总数的38.7%,其中有19株真菌的抑制率达到100%;对海洋卡盾藻抑制率大于50%的真菌有49株,占菌株总数的79.0%,其中有27株真菌的抑制率达到100%;有21株真菌对东海原甲藻和海洋卡盾藻的抑制率均大于50%,其中有17株真菌对2种海洋赤潮微藻的抑制率均达到了100%,编号分别为4.A.2F、5.1.1F、5.1.2F、6.Ⅱ.1F、10.Ⅱ.1F、11.Ⅱ.2N、12.Ⅱ.2N、14.1.1F、17.Ⅰ.1N、17.Ⅱ.1N、18.A.2N、26.1.2F、A1.1F(A)、A1.2F(B)、B1.2N、B4.1F、C3.1N,包括10株木霉属真菌、2株镰刀菌属真菌、1株葡萄穗霉属真菌、1株链格孢属真菌、3株未知属真菌。
2.2.3 海洋动物毒性
以丰年虾和褶皱臂尾轮虫为模型,挑选出62株真菌,测定其真菌粗提物的海洋动物毒性。结果显示,62株真菌均对轮虫表现出了较高的毒性;有13株真菌对丰年虾表现出了较低的毒性,编号分别为2.Ⅰ.1F、2.Ⅱ.1F、6.Ⅰ.1N、6.Ⅰ.2F、6.Ⅱ.3F、8.Ⅰ.2F、10.2.1F、10.2.3F、11.Ⅱ.2N、12.Ⅱ.2N、17.Ⅰ.1N、27.Ⅱ.2N、C4.2F,包括9株木霉属真菌、3株镰刀菌属真菌、1株未知属真菌。
2.3 讨论
从海藻样品中分离得到124株真菌,经过真菌形态学和ITS序列分析,鉴定到17个属,其中有59株真菌来自于木霉属,占比为47.58%,说明木霉是海洋藻栖真菌的优势种群之一。木霉属真菌在世界范围内广泛分布,已发现的木霉属真菌有250多种[15],其中哈茨木霉(T.harzianum)、绿木霉(T.virens)、绿色木霉(T.viride)等[16]因具有生防能力在农业上得到应用;另外,木霉属真菌在工业酶制剂生产、土壤或水源污染修复等方面也有着广泛的应用[17-19]。在天然产物研究方面,陆地和海洋来源的木霉属真菌能产生物活性显著的次级代谢产物,包括萜类、甾体类、聚酮类、生物碱和肽。本实验还分离得到了糙刺篮状菌(Talaromycestrachyspermus),属于罕见菌种,我国仅在浙江舟山市和河南郑州市分离得到。
124株真菌中,内生真菌有47株,附生真菌有77株,分别占菌株总数的37.9%和62.1%。内生真菌的数量比附生真菌的少,可能是因为,内生真菌寄生在海藻的内部组织中,其生长代谢活动与寄主藻类存在着复杂的密切关系。当把内生真菌从其寄生的组织中分离出来后,由于生长环境的改变,可能会导致菌株某些特性的改变,加大了内生真菌分离的难度[3]。因此,在分离过程中通过模拟宿主内部环境来优化培养条件,可能更利于内生真菌的分离及后续研究。
关于海洋藻栖真菌抗菌活性的报道较多,马悦欣等[20]分离得到的海藻附生真菌中,31.3%具有抗菌活性;Gao等[21]从海洋红藻的内生真菌PenicilliumchrysogenumQEN-24S中分离得到对耐甲氧西林金黄色葡萄球菌、荧光假单胞菌、绿脓杆菌和表皮葡萄球菌具有抑制活性的新型化合物。本实验分离得到的部分藻栖真菌对细菌尤其是柠檬交替假单胞菌具有抑菌活性,说明藻栖真菌具有产抗菌活性物质的潜力。有害赤潮在我国发生的规模和频率逐年上升,造成严重的环境危机和经济损失。Chen等[22]从海洋真菌中分离得到对海洋绿藻(Brachiomonassubmarina)和中肋骨条藻(Skeletonemacostatum)有抑制作用的活性物质;Redhead等[23]发现,头孢菌素可以在水华鱼腥藻周围形成溶藻圈;Kumar[24]研究发现,青霉素可以抑制组囊藻的生长。
本实验分离的藻栖真菌中有部分对2种海洋赤潮微藻具有抑制作用,这些真菌的次级代谢产物中可能含对抗赤潮微藻的有效成分。此外,藻栖真菌还具有其它生物活性,倪敏等[25]发现,部分海藻附生真菌的抗氧化活性显著;Abdel-Lateff[26]从藻栖真菌中分离得到对p56lck酪氨酸激酶具有显著抑制活性的物质。
研究表明,在我国海岸带蕴藏着丰富的藻栖真菌资源。对藻栖真菌的深入研究能促进我们对海洋生物生长习性和生态功能的了解。同时,藻栖真菌良好的生物活性说明其可能含有丰富的抗微藻和抗菌活性物质,是药用活性物质的重要来源,具有进一步研究和开发的价值。
3 结论
以在烟台海岸带采集的海藻为对象,分离内生真菌及附生真菌,通过形态学观察及ITS序列分析对藻栖真菌进行鉴定,并对其抗菌活性、抗微藻活性及海洋动物毒性进行评价。结果表明,从海藻样品中共分离得到124株真菌,包括47株内生真菌和77株附生真菌,其中102株真菌被鉴定到17个属。从124株真菌中挑选62株进行活性测试,有40株真菌对柠檬交替假单胞菌表现出抑菌活性,有4株真菌对鳗弧菌表现出抑菌活性,且这4株真菌对2种致病菌均表现出抑菌活性;有21株真菌对东海原甲藻、海洋卡盾藻的抑制率大于50%,且有17株真菌的抑制率达到100%;62株真菌均对褶皱臂尾轮虫表现出较高的毒性,有13株真菌对丰年虾表现出较低的毒性。表明海洋藻栖真菌生物多样性丰富,部分藻栖真菌具有一种或多种良好的生物活性,具有开发活性天然产物的巨大潜力,值得进一步研究。

