2020年国家医疗器械抽检体外诊断试剂品种质量状况分析
【作 者】李晓,张欣涛,郝擎,朱炯,洪伟
1 中国食品药品检定研究院,北京市,102629
2 上海市医疗器械检验研究院,上海市,201318
0 引言
体外诊断试剂是指按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。可以单独使用,也可以与仪器、器具、设备或者系统组合使用[1]。除血液筛查和采用放射性核素标记的体外诊断试剂外,均按照医疗器械类别进行监管。
随着临床医学、生物工程学、电子科学等学科的发展以及新的检验技术相互渗透和自动化仪器的应用,检验医学得到迅速发展[2]。同时,我国医疗水平不断提高,对临床诊断的需求持续增长,体外诊断试剂作为检验医学重要的物质基础,在现代医疗体系中发挥着不可替代的作用,堪称“医生的眼睛”,其质量稳定性、安全性直接关系到人民群众的切身利益[3]。
由于体外诊断试剂在临床的广泛应用,决定其必须接受更加严格的监管。一直以来,为助力体外诊断行业科学监管,提升我国体外诊断试剂质量水平,国家医疗器械抽检都十分关注体外诊断试剂的质量状况。通过整理2020年国家医疗器械抽检中体外诊断试剂的检验结果,并进一步研究分析,以期帮助企业找到最需关注的不合格产生原因,规范生产体系管理,保障产品质量。
1 2020年体外诊断试剂抽检情况
1.1 抽检结果
2020年国家医疗器械抽检共抽取体外诊断试剂11个品种,245批次。经检验,发现1个品种4批次不合格,均为恶性疟原虫抗原检测试剂盒(胶体金法),不合格检出率为1.6%。抽检的体外诊断试剂整体质量较好。
本次抽检共涉及5个管理类别为二类、6个管理类别为三类的体外诊断试剂品种。其中,二类品种均有各自的行业标准,且均为推荐性;三类品种中仅有1个品种有其行业标准,且为推荐性。本次抽检品种聚焦在生化筛查领域,充分考虑了产品临床使用的频率,均用于日常体检中检查率较高的健康指标的检测。其中,三类品种还侧重于对国家重点监管医疗器械目录中品种的考察。具体情况如表1所示。
1.2 探索性研究结果
1.2.1 采用统一标准物质进行探索性研究的结果
体外诊断试剂的校准品或质控品定值的溯源性必须通过已有的、可靠的参考方法和/或参考物质作为标准。因此除了使用企业提供的辅助材料进行监督检验之外,2020年国家医疗器械抽检还对kras基因突变检测试剂盒、梅毒螺旋体抗体检测试剂盒(免疫层析法)、人类EGFR基因突变检测试剂盒等6个体外诊断试剂品种的有关项目采用统一标准物质进行探索性研究。经检验,发现不合格检出率较低的检验项目为:kras基因突变检测试剂盒的准确性、特异性、检测限,不合格检出率均为0%;梅毒螺旋体抗体检测试剂盒(免疫层析法)的阴性参考品符合率、最低检出限、重复性,不合格检出率均为0%;人类EGFR基因突变检测试剂盒的检测限,不合格检出率为0%;人类B-raf基因突变检测试剂盒的准确性,不合格检出率为0%。此外,还发现部分品种的检验项目存在不合格,分别为:丙氨酸氨基转移酶测定试剂盒的重复性,不合格检出率为6.3%;梅毒螺旋体抗体检测试剂盒(免疫层析法)的阳性参考品符合率,不合格检出率为14.7%,乳酸脱氢酶检测试剂的准确度,不合格检出率为16.0%。具体情况如表2所示。
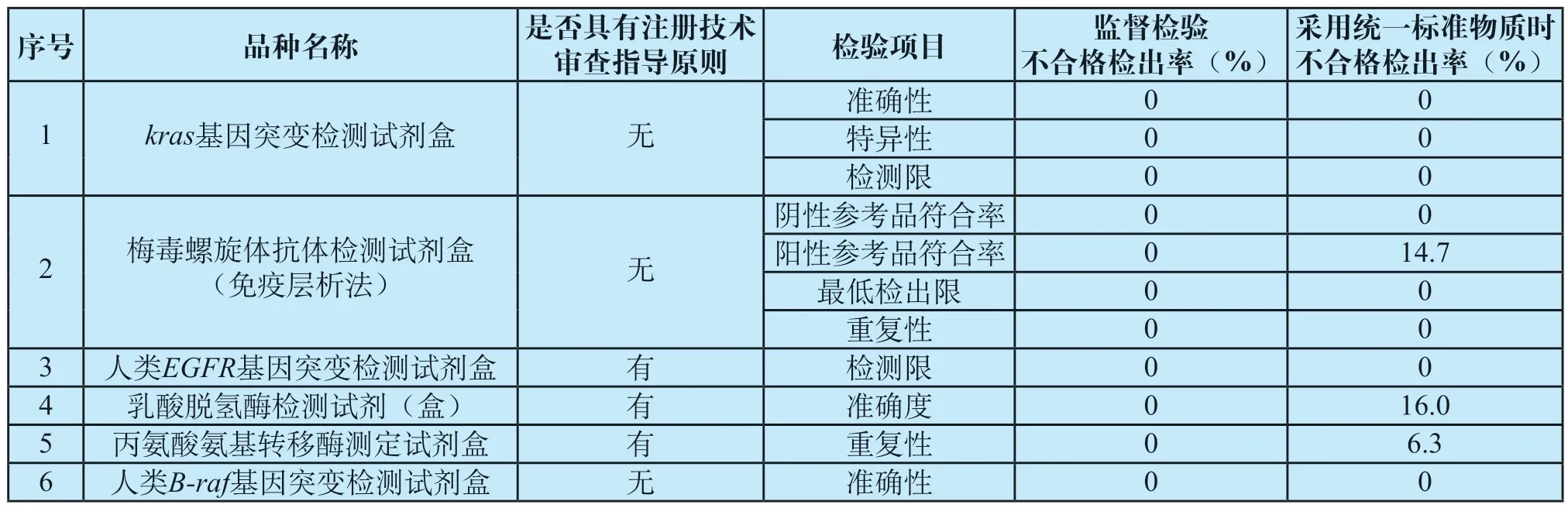
表2 监督检验不合格检出率与采用统一标准物质时不合格检出率Tab.2 The unqualified detection rate of supervision and inspection and the unqualified detection rate of unified reference materials
1.2.2 采用不同参考品进行探索性研究的结果
对低密度脂蛋白胆固醇测定试剂(盒)、铁蛋白测定试剂盒(免疫比浊法)等2个品种的有关项目采用不同参考品进行探索性研究。经检验发现,对于低密度脂蛋白胆固醇测定试剂(盒),依照YY/T 1253—2015行业标准采用三种不同的标准物质对各批次产品进行准确性检测,采用国家标准品A测试,不合格检出率为22.0%;采用国家标准品B测试,不合格检出率为75.0%;采用RANDOX质控品测试,不合格检出率为33.3%。对于铁蛋白测定试剂盒(免疫比浊法),依照YY/T 1456—2016行业标准对抽检的试剂盒的准确性进行评价。采用国家参考品检验,8批次产品中有5批次准确性试验无法达到要求,不合格检出率为62.5%。采用国际标准物质检验,8批次产品中有4批次准确性试验无法达到要求,不合格检出率为50.0%。
1.2.3 采用其他方式开展探索性研究的结果
对恶性疟原虫抗原检测试剂盒(胶体金法)、亚甲基二氧基甲基苯丙胺检测试剂盒(胶体金法)、补体C3测定试剂盒(免疫比浊法)等3个品种的阳性干扰、稳定性、准确度等项目进行探索性研究。经检验,恶性疟原虫抗原检测试剂盒(胶体金法)7批次产品均可检出恶性疟原虫国际标准株,除含有恶性疟原虫抗原检测线外,均可检测其他疟原虫。一家企业可检测出间日疟原虫,一家企业可检测4种疟原虫但不能区分4种疟原虫;亚甲基二氧基甲基苯丙胺检测试剂盒(胶体金法)全部10批次产品均具有较强的抗干扰性能。在考查企业参考品浓度的准确性时,发现7个企业参考品中有2个浓度相对较小,1个浓度偏差较大。温度对样品的影响不明显,高湿条件对样品影响较大;补体C3测定试剂盒(免疫比浊法),采用国际标准物质检测准确度,实测值与标示值的相对偏差在±5%范围内的生产厂家共有15家,相对偏差在±10%范围内的生产厂家共有22家,相对偏差在±15%范围内的生产厂家共有26家,有1家相对偏差超过20%。
2 发现问题原因分析
2.1 原材料管理不科学
对于体外诊断试剂而言,原材料尤其是核心原材料质量直接决定着产品的质量[4],良好的原材料采购控制程序是产品质量的首要保障。由于企业对原材料的选择、控制、验收不科学,导致产生质量问题:①选择原材料时,未结合体外诊断试剂产品本身的性质特点做充分的科学研究。以免疫学方法的体外诊断试剂为例,抗原抗体的配对筛选过程可能涉及众多的“抗体-抗体”“抗原-抗体”配对情况。通过试验验证适用于产品生产过程中的原材料,最终的筛选结果可能仅为其中一种或者两种组合,且原材料仅使用一次,其来源也各不相同。企业应当按照质量体系要求建立完整的采购溯源链,但实际存在链条数据信息不完整的情况。②不具备对原材料控制检验的能力,无法保证后续工序的安全性和有效性。③未科学制订原材料验收制度,对于存在安全风险的原材料,不具备相应的风险控制措施[5-6]。
2.2 参考品配制存在漏洞
体外诊断试剂中参考品用于校准测量系统,评价测量程序或为材料赋值,是实现体外诊断试剂临床监测及监督检验结果准确一致的主要工具,也是保证量值有效的计量实物标准。在实际应用中,参考品配制存在的不足主要有以下几方面:①部分企业可能对参考品配制的职责的权限不明确,相关文件、记录不完善,无法保证配制方法的有效运行。②部分企业可能对配制参考品时使用的辅料管理不当,同时,对于物料来源变更时,未对试样重新评估,也未进行工艺验证。③企业建立的参考品制备工艺研究及反应体系,但实际配制时可能由于称量误差、计算错误、配制方法错误等导致参考品准确度不佳,或者对全效期的稳定性验证、研究不充分,从而影响参考品质量[7]。
2.3 标准理解不透彻
部分企业存在对体外诊断试剂标准理解不透彻的现象。主要包括:①个别企业的产品技术要求存在漏项,如kras基因突变检测试剂盒特异性项目未设置对试剂盒检测范围外基因突变样本。②部分专业术语不规范,如“检测限”项目描述成“选择性”,未在条款中明确可以检出的最低突变频率。③部分企业的产品技术要求与行业标准不一致或低于行业标准规定。如乳酸脱氢酶测定试剂(盒)的产品技术要求基本上可以按照行业标准设立检验项目,但部分企业产品技术要求中的检验要求、检验方法与行业标准不一致;发现丙氨酸氨基转移酶测定试剂盒部分企业的产品技术要求中,线性项目低于行业标准规定。
2.4 说明书管理不重视
此次发现的问题还包括部分企业对说明书管理不重视。如:①补体C3测定试剂盒(免疫比浊法),部分企业说明书上的产品名称与产品技术要求、注册证上的名称有差异,可能由于企业出厂检验敷衍导致。此外,还存在说明书与产品技术要求的性能指标存在不一致的情况,可能为企业注册时未对说明书和产品技术要求内容进行严格把控。②人类B-raf基因突变检测试剂盒,部分企业的外包装标识及产品说明书的注册证号不一致,说明企业的质量控制意识薄弱,管理存在欠缺,忽略对标识和说明书内容的审查。
3 建议
3.1 体外诊断试剂生产企业强化风险管理意识
风险管理贯穿于产品研制、开发、生产、销售和使用全过程中。建议企业建立完整的量值溯源体系,并应当溯源到可靠的国家标准物质或者国际标准物质,从而控制产品质量,减小检验结果差异性和偏离值。同时,采取有力措施保证质量管理体系的运转,切实加强对企业不同环节、不同部门的约束[8]。建议体外诊断试剂生产企业强化产品的风险管理意识,切实履行质量安全主体责任,主动分析研判产品风险和成因,完成风险控制和消除,对于已经上市销售的产品进行召回,完成质量管理体系的整改,特别是对于国抽不合格产品的产生原因,应当及时制订整改方案并实施[9]。同时,还建议体外诊断试剂生产企业重视与监管部门的沟通,真正建立、保持、提升出厂检验能力。
3.2 规范产品说明书管理
体外诊断试剂说明书承载了产品预期用途、检验方法、对检验结果的解释、注意事项等重要信息,是指导使用者正确操作、临床医生准确理解和合理应用试验结果的重要技术性文件。由于体外诊断试剂产品专业跨度大、方法学多样、临床预期用途各异,产品的说明书内容不尽相同。企业应当根据产品特点及临床预期用途编写说明书,以便关注者获取准确信息。建议体外诊断试剂生产企业规范措辞、统一术语、完善内容描述,确保产品随附说明书与产品技术要求、备案说明书一致。
3.3 监管部门加强监督检查力度
建议监管部门持续压实企业主体责任,针对抽检发现问题较多的品种和企业,加大监督检查的力度和频次,对抽检不合格的企业,监督其完成整改,必要时开展跟踪抽检。重视体外诊断试剂抽检提示的质量安全风险,各级监管部门应当及时调查处理,加强对企业的监督指导,采取切实有效的措施,强化后续监管。
3.4 监管部门持续做好审评指导与标准宣贯
审评审批与上市后监管是互相联系的有机整体,在强化上市后监管体系建设的同时,也要遵循质量与效率并重的原则,持续优化审评机制,厘清审评各环节概念,统一科学审评理念,做好审评指导[10]。此外,标准作为规范性文件,为各类活动或其结果提供规则和指南。建议监管部门在体外诊断试剂标准发布之后,及时开展标准宣贯,提高标准使用率,推进标准实施,更好地发挥其应有作用[11]。
4 结语
相比于有源、无源医疗器械,体外诊断试剂由于其复杂的研发技术和严格的储运条件,以及关系到临床医生的诊断,病人的用药治疗等方面,是极为特殊的一种医疗器械[12]。随着精准医学大幕的拉开,相关的诊断技术将快速发展,体外诊断试剂的产品质量将会受到公众的持续关注和监督。抽检作为上市后产品监管的有效手段,可以发现问题、提供线索、促进整改引发反思。但是,安全优质的产品不是通过检验得来的,而是通过企业设计研发生产出来的。通过分析归纳2020年国家医疗器械抽检结果,提炼出发现主要问题背后的成因,并提出针对性建议,供企业和监管部门参考。希望体外诊断试剂从业人员重视质量状况,进一步提升体外诊断试剂产业水平,保障公众用械安全,为医疗器械全生命周期管理做出贡献。

