原发性胃腺鳞癌16例临床病理学分析
俞凯杰 朱 凯马丽莉左元元 毛海峰 王金胜
胃原发性肿瘤以腺癌(Adenocarcinoma,AC)最多见,食管原发性肿瘤以鳞癌(Squamous cell carcinoma,SC)最多见,而原发性胃腺鳞癌(Adenosquamous carcinoma,ASC)临床罕见,本文报道16例原发性胃ASC,进行回顾性分析并复习相关文献,探讨其临床病理学特征、诊断、治疗及预后等,旨在为临床、病理医师提供经验。
1 材料与方法
1.1 材料
收集2017—2021年山西省长治医学院附属和平医院13例、江苏省江阴市人民医院3例原发性胃ASC的临床资料。病例资料包括患者性别、年龄、病灶位置及大小、大体分型、病理学分型及分级、手术方式、术后放化疗及随访等信息,见表1、表2。纳入标准:(1)单一肿物且肿物主体位于胃;(2)经手术切除肿瘤的患者;(3)肿瘤中存在AC及SC成分,且AC及SC成分均大于25%;(4)无其他原发部位的ASC。
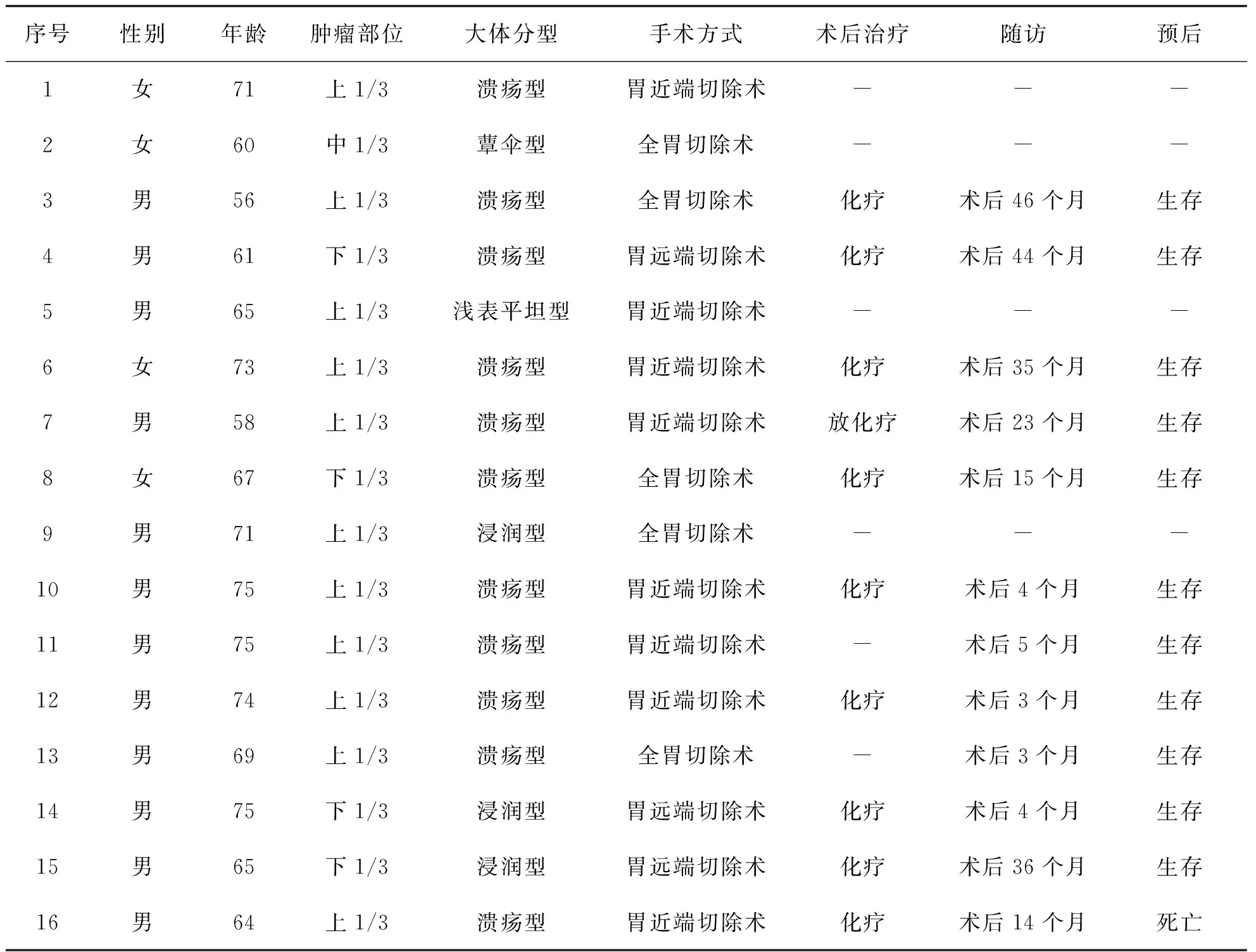
表1 16例原发性胃ASC患者临床资料
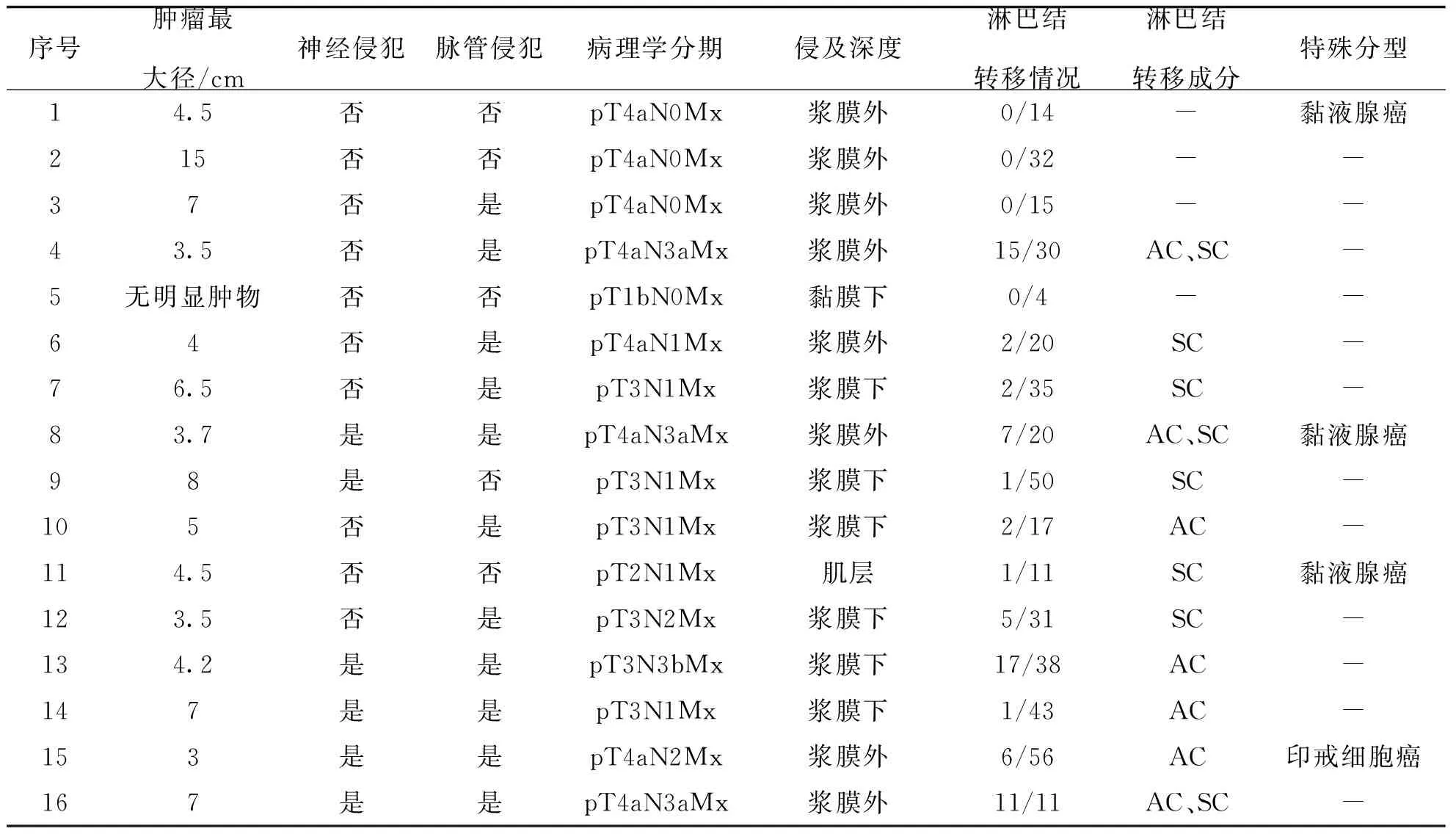
表2 16例原发性胃ASC患者病理资料
1.2 方法
标本经10%中性福尔马林固定,石蜡包埋,常规石蜡切片,行HE染色,免疫组化染色采用SP法,DAB显色,光镜观察。免疫组化抗体包括CK7、CK8、CAM5.2、P63、P40等,均购自上海基因科技公司,实验操作均为Leica全自动染色机染色。肿瘤分期采用2017 AJCC第8版,病理报告结果由3位10年以上工作经验的病理医师判读及审核。
2 结果
2.1 临床特征
16例原发性胃ASC患者中,男12例,女4例,以男性多见,主要发生于中老年人(56~75岁),中位年龄为68岁,临床症状主要为腹痛腹泻、进食梗阻,无特异性。
2.2 病理检查
肉眼观察:肿瘤最常见部位为胃上1/3(11例),其次是胃下1/3(4例)和胃中1/3(1例)。肿瘤多为灰白实性,大体分型以溃疡型为主(11例),其次是浸润型(3例),蕈伞型(1例),浅表平坦型(1例)(见图1、图2)。1例早期胃ASC无明显肿物,其余15例肿瘤最大径为3~15 cm,平均5.8 cm。
镜检:16例原发性胃ASC患者中均可见AC和SC成分,AC成分分化程度不等,SC成分可见细胞内角化或角化珠。其中有4例AC成分伴有黏液腺癌或印戒细胞癌(见图3),SC和AC成分界限清楚(见图4)。肿瘤侵及深度8例为浆膜外,6例浆膜下,1例为肌层,1例为黏膜下,其中11例可见脉管侵犯,6例可见神经侵犯。12例患者出现淋巴结转移,淋巴结转移成分5例为SC,4例为AC,3例为AC和SC两种成分。肿瘤组织免疫组化CK7、CK8、P40、P63等指标均为阳性,可见独立存在的P40标记的SC成分(见图5)与CK7标记的AC成分(见图6),也可见部分区域的低分化肿瘤细胞同时表达CK7及P40(见图7、图8)。
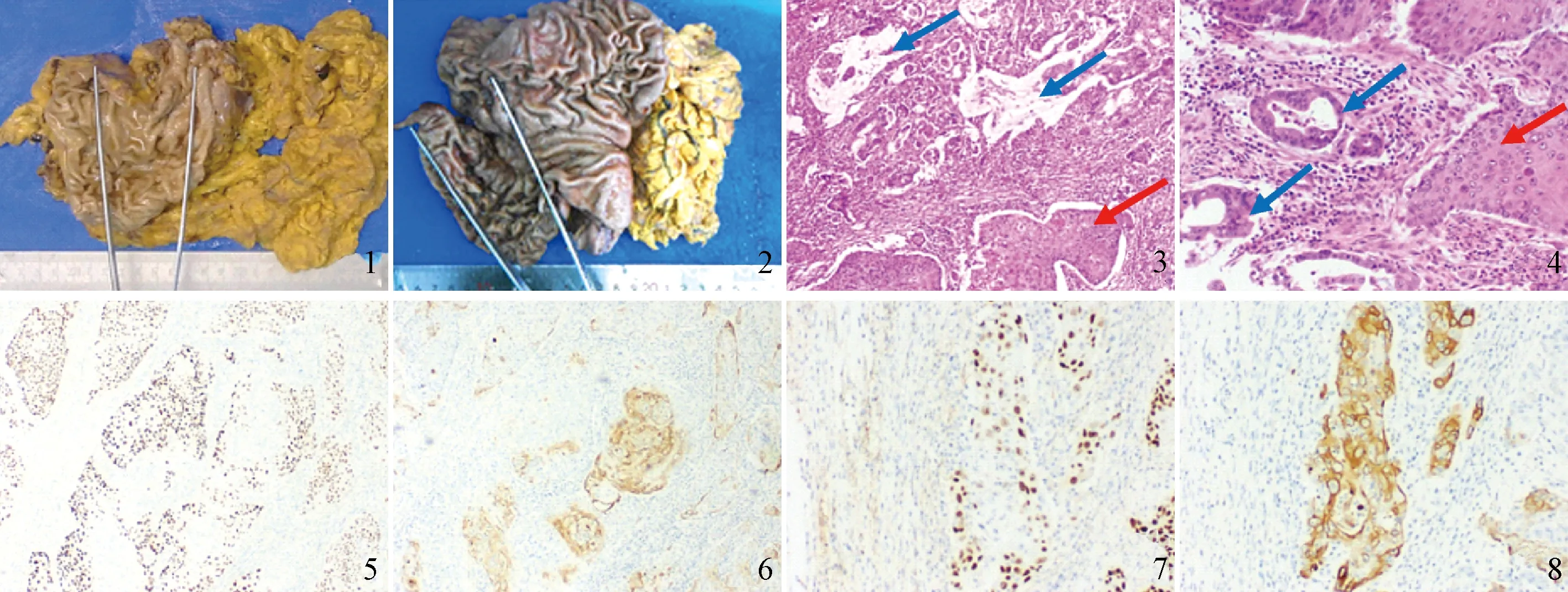
图1 胃ASC大体图(溃疡型);图2 胃ASC大体图(溃疡型);图3 胃ASC肿瘤区 HE×40(蓝色箭头标记黏液腺癌,红色箭头标记鳞癌);图4 胃ASC肿瘤区 HE×100(蓝色箭头标记腺癌,红色箭头标记鳞癌);图5 胃ASC免疫组化 P40(鳞癌细胞+),SP法;图6 胃ASC免疫组化 CK7(腺癌细胞+),SP法;图7 胃ASC免疫组化 P40(低分化肿瘤细胞+),SP法;图8 胃ASC免疫组化 CK7(低分化肿瘤细胞+),SP法
2.3 治疗及预后
16例均行肿瘤切除术,其中8例行胃近端切除术,5例行全胃切除术,3例行胃远端切除术,16例均行区域淋巴结清扫。截至2022年3月15日,10例术后行化疗或放化疗;4例失访,12例获得随访信息,中位随访时间14.5个月(3~46个月),1例术后14个月死亡,11例生存且复查无复发。
3 讨论
原发性胃ASC临床罕见,发病率不到全世界胃癌的1%[1-4],男女比例为2.3~3.3∶1[4-5],以男性、亚洲人多见[1,5-6],而白种人少见[7]。自2017年以来,长治医学院附属和平医院就诊胃癌患者共计12 648例,原发性胃腺鳞癌仅有15例,发病率约占胃癌的0.1%,而本报道男女比例为3∶1。
临床症状与其他类型胃肿瘤相同,无特异性临床特点,以上腹痛、吞咽困难、反酸为主[5]。CHEN等[5]报道中胃ASC多位于胃上1/3,AJOODHEA等[8]及FENG等[4]报道胃ASC最常见的位置是胃下三分之一,李旸等[9]报道该病主要发病部位为胃窦部、胃底部和胃体。本报道发现胃上1/3的ASC最为常见。
胃ASC的诊断必须同时存在独立的AC和SC成分,SC成分必须大于或等于肿瘤组织的25%[6]。ASC在AC与SC成分之间或相邻的AC成分之间有一个明显的过渡区[5]。FARIA等[3]认为对于胃ASC的诊断,需要排除贲门处食管鳞癌和胃腺癌的碰撞、侵犯食管的胃癌及其他部位原发ASC的胃转移,即发生于远离贲门的胃体和胃窦部的肿瘤,但此观点仍有待考证。需要与以下几种疾病鉴别:(1)同时存在免疫组化表达腺癌指标和鳞癌指标的低分化癌及未分化癌,虽部分ASC中存在此类肿瘤区,但是ASC的诊断需存在独立AC和SC成分的肿瘤区;(2)腺样SC,仅存在管腔样结构的单纯SC;(3)AC鳞化,AC的鳞状上皮化生,化生的鳞状上皮成分分化良好,无明显异型。
关于胃ASC的起源尚无定论,主要是以下5种假说[3,7]:(1)AC的SC化生;(2)化生的鳞状细胞癌变;(3)异位鳞状上皮癌变;(4)AC和SC的碰撞;(5)干细胞向两种细胞系分化。发生于贲门部的ASC可能为AC和SC的碰撞或者化生的鳞状细胞癌变,而在低分化区出现免疫组化表达腺癌和鳞癌的现象可能是由于肿瘤为同一起源即干细胞向两种细胞系分化。
胃ASC尚无规范化的治疗方案[4,6],手术切除是治疗原发性胃ASC的首选治疗方法,化疗、放射治疗可以延长生存时间[5,9-10]。KIM[1]和FENG[4]表明原发性胃ASC较单纯AC表现出较早的肿瘤进展和较差的预后,通常诊断时已经侵入肌层,伴有静脉和淋巴管侵犯[6],中位生存期22个月[2]。ASC的生物学行为通常由AC成分决定[11],25.4%的患者伴有远处转移[4],且SC和AC成分都有可能发生远处转移[2],最常见的转移部位是肝脏,其次是腹膜[5]。半数肿瘤病理学分期为T4期,淋巴结转移发生率为86.2%[4]。本研究中16例原发性胃ASC,50%的病例病理学分期为T4,75%的病例伴有淋巴结转移,转移成分AC和SC无明显差异,AC及SC成分占比高者淋巴结内转移概率及比例更高;在同时存在AC和SC成分淋巴结转移的3例患者中,均可见AC成分较SC成分比例高;获得随访的病例总体预后较以往报道的好,仅1例死亡,11例无远处转移,这与随访时间过短或行术后预防性的化疗及放疗有关,提示术后放化疗可能有效改善胃ASC患者预后。
原发性胃ASC发病率低,其发病机制尚不能明确,无特异性临床症状,镜下可见AC及SC成分,且AC和SC成分均可发生转移,恶性程度高,病理学分期多为T3及T4期,但与以往报道不同,本报道胃ASC的预后与单纯AC无显著性差异。治疗以手术切除为主,术后放化疗可以有效提高生存率。

