双边栝楼的组织培养与快速繁殖
张冰冰, 叶艳英, 周劲松, 汤泳萍, 尹玉玲, 罗绍春
(江西省农业科学院蔬菜花卉研究所, 南昌 330200)
refine seedlings and transplant
双边栝楼(TrichosantheskirirowiiMaxim)俗名吊瓜、药瓜、野葫芦等,为葫芦科栝楼属的多年生攀缘草质藤本植物[1],其果实(全栝楼)、种子(栝楼籽)、果皮(栝楼皮)及根(天花粉)均可入药[2]。栝楼具有改善心血管、祛痰止咳、抗肿瘤、降血脂、降血糖、抗溃疡、抗菌等药理作用[3]。栝楼籽风味独特,可食率达60%[4],入药或休闲食品的研发推广,其保健作用和食用价值都得到市场的认可。近年来,栝楼在农业结构调整和助力精准脱贫中发挥了巨大作用,产业前景广阔。
栝楼属雌雄异株,种子繁育后代的雌雄株比约为3∶7[4],幼苗期雌雄株无典型性状差异,直至开花期才能辨别且后代性状分离严重,种子不宜用于繁育种苗。目前生产上基本采用1~2年生植株当年生新根繁育种苗,繁殖系数低,种根易受病虫侵害,种性退化严重。利用植物组织培养,建立栝楼无性快繁体系,可快速定向繁育出性状优良、基因稳定的优质种苗,弥补种子与块根繁育的不足,实现优质栝楼的市场推广。阮建等[5]、钱骅等[6]对其组织培养展开研究,但建立的体系差异较大。笔者选用数种已建立的栝楼组织体系对双边栝楼皖楼20号进行组织培养,发现并不适用。究其原因可能与所取材料品种(材料基因型)、生长年龄或生长时期有关。因此,本研究针对已建立的栝楼组培快繁体系进行适应性优化,旨在为双边栝楼的组培快繁与工厂化生产提供技术支撑。
1 材料与方法
1.1 试验材料
试验材料为双边栝楼皖楼20号一年生块根,2020年2月下旬种植于江西省农业科学院高安创新示范基地(115°E、28°N)。于5—7月份采集生长健壮的优质单株带腋芽茎段为外植体。
1.2 试验方法
1.2.1材料灭菌与接种
取新生幼嫩的栝楼枝条放入冰盒中带回实验室,剪去多余的叶和叶柄,洗洁精清洗浸泡20 min清除灰尘,流水冲洗约30 min,将茎段剪成上下2~3 cm带芽小段,茎段不宜过短,无菌水冲洗3~4次,用灭菌滤纸吸干水分。于超净台中将其放入无菌培养瓶中,采用4种方式进行灭菌(表1),最后用灭菌滤纸吸干水分,接入纯MS培养基中,MS培养基添加0.1 g/L的益培灵,抑制微生物的污染。分别于第4天、第7天和第13天统计污染率。

表1 外植体的不同灭菌方式Table 1 Different methods of sterilization of explants
1.2.2培养基与培养条件
外植体各时期诱导培养基组成(表2),MS+不同种类和水平的激素+30 g/L蔗糖+8 g/L琼脂粉,pH值5.8。高压灭菌锅116 ℃灭菌30 min。各时期培养条件:专用组培室温度为(25±1)℃,光照时长12 h/d,光照强度2 000~3 000 lx。
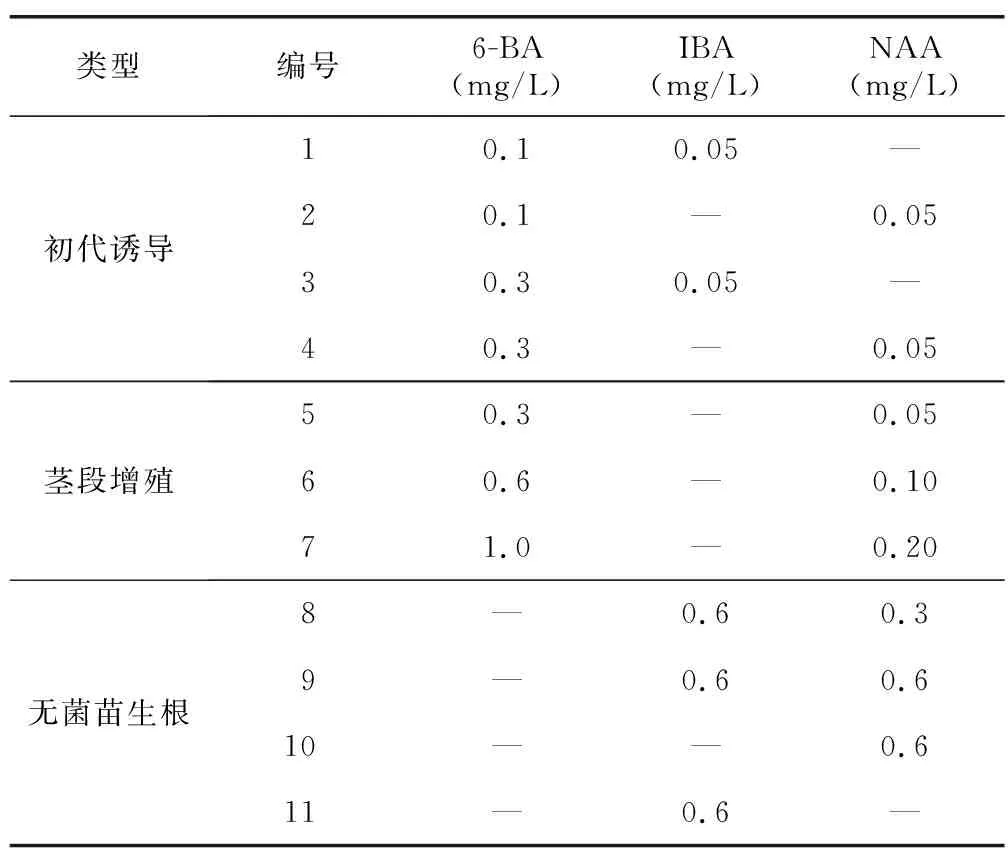
表2 各时期外植体组织培养的MS培养基Table 2 MS medium for tissue culture of explants in each period
1.2.3接种与统计
获得的无菌外植体接种至初代诱导培养基,每处理10瓶,每瓶接种3~4个,于第3天、第5天、第7天和第20天观察并记录芽诱导情况,并于第20天计算各处理栝楼外植体的分化系数。栝楼芽点长至3~4 cm高时,分剪成带芽茎段,转接至不同增殖培养基,每处理10瓶,每瓶接种3~4个,20 d后观察并记录茎段的增殖情况,筛选最佳增殖培养基。选择苗高3 cm以上且带有3个或3个以上茎间段的无菌苗接种至生根培养基,每处理10瓶,每瓶接种3~4个,观察并记录外植体的生长状况及生根情况,筛选最佳生根培养基。最后,将根系健壮组培苗瓶盖打开,放入少许水炼苗2 d,然后洗去根部附着培养基,移栽至混合比为1∶1的蚯蚓土和育苗基质的花盆中,放置光照培养箱中并覆盖白色塑料薄膜,防止水分蒸发。光照设置2 400 lx、光照时长12 h/d、温度26 ℃、湿度70%,于第4天缓苗后除去薄膜,7~10 d后,移栽至田地中。
1.3 数据统计分析
采用WPS软件进行试验数据的统计分析。相关指标的计算公式为:
腋芽萌发率(%)=[萌发出腋芽(成活)的外植体总数/接种外植体总数]×100%;
分化系数=诱导分化芽点总数/接种成活外植体初芽点总数;
平均芽点数=外植体生长总芽点数/外植体个数;
增殖系数(%)=(芽生长到可供切割或增殖的外植体数/接种时的单芽或单外植体总数)×100%;
生根率(%)=(生根的无菌苗/接种的无菌苗总数)×100%。
2 结果与分析
2.1 灭菌试验
于第4天、第7天和第13天分别对每处理组外植体污染个数进行统计,并在第13天计算各处理的污染率(表3)。结果表明,第4天各处理污染个数较少,处理1和处理3无污染外植体,处理2和处理4有细菌污染。第7天污染外植体显著增加,增长率在18%~53%之间,且污染外植体以真菌污染为主,在其基部或茎段有菌丝产生,多以白色孢子为主,个别有黑色孢子发生。第13天各处理污染率降低,处理3的污染率降到10%以下。综合统计处理2总污染率最高(84%),处理3的污染率最低(26.3%)。所以处理3(75%酒精30 s+无菌水冲洗2~3次+0.1% HgCl210 min+无菌水冲洗3~4次)对栝楼外植体的灭菌效果最好。

表3 不同灭菌方式外植体污染情况Table 3 Statistical analysis of the contamination of explants in different sterilization methods
2.2 初代诱导培养
将无菌外植体分别接种至1~4号培养基进行诱导,第3天和第5天统计各培养基褐化外植体总数,第7天统计死亡和成活总数,第20天统计诱导芽总数,并计算分化倍数。结果(表4)显示:低浓度激素组合明显优于高浓度组合,即褐化外植体总数依次为培养基1号<2号<4号<3号,死亡总数依次为2号<1号<3号<4号。第7天发现各培养基外植体基部均膨大有愈伤产生,高浓度激素组合基部膨大较快且产生愈伤较多,此时芽点已经伸长。第12天已经有节间段产生,且叶片开始展开(图1 A、图1 B)。2号培养基芽点总数最多,为57个,4号同比高浓度激素组合芽点总数最少,为18个,分化倍数从大到小依次为2号、1号、3号、4号。因此,最佳初代诱导培养基为2号培养基(MS+6-BA 0.1 mg/L+NAA 0.05 mg/L)。
2.3 茎段增殖培养
将上述诱导茎段转接至增殖培养基,第20天随机选择其中3瓶的无菌株,观察记录茎段的增殖情况,并计算平均分化茎段数(增殖倍数)和平均芽点数(表5,图1 C)。6号培养基茎段增殖倍数最大(4.75),显著大于5号与7号培养基的增殖倍数,各培养基外植体生长状态详见表5。因此,栝楼最佳茎段增殖培养基为6号培养基(MS+6-BA 0.6 mg/L+NAA 0.1 mg/L)。

表5 各培养基茎段增殖统计与描述Table 5 Statistics and description of stem proliferation of each medium
2.4 无菌株生根培养
将无菌茎段分别转接至8~11号生根培养基,观察并记录生根情况(表6,图1 D、图1 E)。第4~6天发现各培养基无菌株基部有少量愈伤产生。9号培养基第7天栝楼苗开始生根,继续培养15 d主根系变长且粗壮,伴随有侧根产生,第19~20天观察根系发达,组培苗生长健壮。8号培养基相对9号培养基生根率较低,相差58%,且平均每株生根数较9号培养基少2~3条。9号培养基第7天最先生根,8号培养基第10天开始有根产生,11号培养基18 d以后个别外植体有根产生,截止第20天,10号培养基无菌株无根系产生,11号培养基仅2株无菌株生根,其绝大多数外植体基部膨大凸起,被愈伤包裹,无生根迹象。因此,最佳生根培养基为9号培养基(MS+ IBA 0.6 mg/L+NAA 0.6 mg/L)。

表6 各培养基诱导生根统计与描述Table 6 Statistics and description of induced rooting of each medium
2.5 组培苗炼苗移栽
随机挑选30株上述生根组培苗,炼苗移栽,截止第15天时统计死亡3株,组培苗清洗时因为其茎秆和根系较脆,清洗掉根死亡1株,成活率为86.7%,成活率较高。
3 结论与讨论
目前外植体常用灭菌剂有75%酒精,0.3%~0.6% NaClO和0.1% HgCl2,选用何种灭菌剂和灭菌时间由外植体部位及幼嫩程度所决定。一般在彻底杀死表面微生物的同时,又要尽可能减少灭菌剂对外植体组织和表层细胞的伤害。本研究选用上述灭菌剂,采用单一灭菌剂对比交替灭菌的方式,发现交替灭菌效果(平均总污染率35.7%)明显优于单一灭菌剂的效果(平均总污染率71%)。所以,在实践中可以采取交替灭菌和多次灭菌相结合的方式,以达到灭除杂菌的目的。本研究发现,使用75%酒精30 s+无菌水冲洗2~3次+0.1% HgCl210 min+无菌水冲洗3~4次效果较好,污染率为26.3%。虽然0.1% HgCl2在建立外植体无菌系中起着重要作用,显著优于其他灭菌剂,但HgCl2附着其外植体表面,无菌水难以彻底清洗干净,会对切口处造成损伤,增加褐化,抑制生长。因此,在初次修剪时,将茎段剪成上下2~3 cm带芽小段,方便HgCl2灭菌后剪去切口。其次,HgCl2属于重金属离子废液,对环境危害较大[7]。因此,建立效率高、危害小的灭菌体系是现实所需的。笔者前期采用钱骅等[6]的灭菌方法处理外植体,其除菌效果不太理想,原因可能与采样环境、外植体状态有关。种植基地距实验室较远,采样时均碰上雨天,极大地增加了外植体污染的概率。
在植物组织培养中,植物生长调节剂是培养基中的关键物质,在植物组织培养中起着重要的作用[8]。生长素和细胞分裂素是启动细胞分裂、脱分化和再分化的关键性激素。如何平衡两者种类和比例以控制植物细胞的发育方向,是组织培养体系建立的核心。前人研究结果均表明,6-BA在外植体芽诱导中具有显著作用。如杨丽娜等[9]指出,MS+6-BA 1.5 mg/L最适合诱导栝蒌腋芽生长;江毅凡[10]指出,在MS+6-BA 2.0 mg/L+ NAA 0.1 mg/L诱导的分化苗质量较好;林贵美等[11]研究发现,MS+BA 0.3 mg/L+IBA 0.06 mg/L较适合初代诱导的启动培养。另廖华俊等[12]、曹孟德等[13]、陈惠等[14]都对其进行芽诱导研究,发现不同的体系激素水平差异较大,如BA浓度均在0.3~2.0 mg/L之间,且激素种类多围绕BA、IBA和NAA展开。笔者前期采用上述体系对徽记2号进行无性扩繁,发现各体系外植体诱导情况不佳,第3天出现死亡,于接种第5天绝大部分死亡且褐化程度严重,仅少部分诱导腋芽伸长。所以笔者设置4个相对低浓度组合进行诱导,发现相同6-BA用量条件下组配NAA分化倍数2.1比IBA分化倍数1.5更适宜芽的诱导,且6-BA的用量增大时,其分化倍数分别为1.4和1.3,明显抑制了芽的分化。综上,最佳诱导培养基为MS+6-BA 0.1 mg/L+NAA 0.05 mg/L。增大激素水平,根据茎段生长状态筛选增殖培养基,获得最佳增殖培养基为MS+6-BA 0.6 mg/L+NAA 0.1 mg/L。
IBA和NAA是诱导栝楼无菌株生根的关键激素,获得健壮根系吸收水分与养分,是最后移栽成活的关键。林贵美等[11]诱导生根为MS+IBA 0.3~0.5 mg/L,杨晓伶等[4]建立生根培养基MS+NAA 0.1 mg/L+IBA 0.2 mg/L,钱骅等[6]诱导生根以MS+IBA 0.1 mg/L最好,其次是MS+NAA 0.1 mg/L。余慧琳等[15]、郑明福等[16]、韩琳娜等[17]对栝楼组培苗诱导生根都进行了相应研究,其激素水平绝大部分在0.5 mg/L及以下。笔者对上述部分体系进行生根诱导,发现材料的差异造成体系的不通用性,第25天统计各培养基生根率在8%以下,生根率极低,部分培养基无根系产生。所以笔者针对本皖楼20号增加了各激素的水平,设置4个组合对其生根进行诱导。发现IBA和NAA组合使用时诱导生根率高,当NAA与IBA水平同为0.6 mg/L时(MS+IBA 0.6 mg/L+NAA 0.6 mg/L),其根系发生快且健壮,移栽成活率高。
本研究初步建立了双边栝楼的组织培养快速繁殖体系,解决了已建立的栝楼组织培养体系对双边栝楼的不适用性,为双边栝楼的组培快繁与工厂化规范生产奠定基础,也可为栝楼属植物快速繁殖提供技术参考。

