不同激素对山韭种子萌发特性的影响
李韦瑶, 肖汇川, 张碧莹, 李 杰, 苏滢淼, 崔国文, 秦立刚
(1.东北农业大学动物科学技术学院, 黑龙江 哈尔滨 150030;2.东北农业大学食品学院, 黑龙江 哈尔滨 150030)
山韭(AlliumsenescensL.)为百合科(Liliaceae)葱属(AlliumL.)多年生草本植物,别称山葱、岩葱、忙给日[1-2],主要分布于海拔2 030 m以下的草原、草甸或山坡上,在我国东北、华北、内蒙古、甘肃、新疆均有分布,中亚、西伯利亚、俄罗斯及蒙古等地也较为常见[3-4]。山韭的经济价值高,具有食用、药用、饲用和观赏等价值[5]。山韭嫩叶可作蔬菜食用[6],在营养生长期和结实期,花茎、嫩叶和花均可食用,同时具有饲用价值、药用价值和观赏价值。各生育期山韭均含有较高的蛋白质,是肥育家畜的优等牧草,各种家畜均喜食;叶子晒制后可用于冬春季节补喂羔羊和弱畜。山韭全草可入药,味咸、性平,具有健脾开胃、益肾补虚的功效,主治脾胃气虚、饮食减少、肾虚不固、小便频数等症状[7]。山韭花序半球形,花淡红色或紫红色,有很高的观赏价值[8-9]。
外源激素法是揭示种子休眠和萌发的激素调控机理的重要研究方法,已被广泛应用于种子萌发特性研究,使用植物生长调节剂浸种可以打破种子休眠,破坏妨碍种子萌发的活性物质,从而促进种子胚的发育和种子发芽[10]。植物生长调节剂作为重要的内源激素,在植物的生长中发挥着重要作用。在已发现的多种外源植物生长调节剂中,其不同浓度施用在不同部位作用不同[11,12]。萘乙酸(Naphthalene acetic acid,NAA)可以促进细胞分裂和组织分化,诱导形成不定根。也能影响细胞分裂、细胞伸长和分化,促进种子发芽和不定根、侧芽的形成[13]。使用适量的乙烯利(Ethrel,ETH)能活化细胞的某种酶,促使细胞分裂,使种子萌发,过量的ETH则会破坏细胞结构[14]。崔雪艳,李永军[15]研究表明,适宜浓度的ETH浸种可以显著提高花生种子的萌发。袁芳等[16]研究指出,一定浓度的IAA浸种对喜马拉雅紫茉莉种子的萌发有促进作用。兰琳英等[17]研究发现,NAA和IAA浸种对海州常山种子萌发均有促进作用。鉴于此,为寻求可提高山韭种子发芽的外源植物生长调节剂及其适宜浸种浓度,研究了IAA、NAA和ETH等3种外源植物生长调节剂对山韭种子萌发的影响,以期为山韭种子萌发机理研究提供参考。
1 材料与方法
1.1 试验材料
供试种子由东北农业大学草学实验室提供。试验所用NAA、IAA购于博奥拓达公司,ETH为阿拉丁公司生产。
1.2 试验设计
实验设置6个不同浓度的NAA、IAA和ETH处理(见表1)。挑选大小均一且饱满的山韭种子,经0.5%次氯酸钠溶液灭菌后,用无菌水反复冲洗5遍,再置于不同处理溶液中浸泡24 h,取出后再用蒸馏水清洗数次,用滤纸吸干种子表面水分。放入垫有2层滤纸直径为9 cm的培养皿中,在恒温培养箱内发芽,培养箱光周期为光照12 h/黑暗12 h,温度为25 ℃。每处理100粒种子,重复3次。

表1 植物生长调节剂的处理浓度Table 1 Treatments for concentrations of plant growth regulators
1.3 测定方法
1.3.1萌发指标
每隔24 h观察并记录发芽种子数,以幼芽达到种子长度一半、根长与种子等长作为发芽指标。种子萌发试验持续15 d,在第7天统计山韭种子的发芽势,在第15天统计发芽率、发芽指数、活力指数和苗干重,并计算活力指数。
发芽势(%)=(7 d内正常发芽的种子数/供试种子总数)×100%;
发芽率(%)=(15 d内正常发芽的种子数/供试种子总数)×100%;
发芽指数(GI)=∑(Gt/Dt);
活力指数=GI×S;
式中,Dt表示t日的发芽数,Gt表示相应的发芽天数,S为发芽结束时单株芽的平均干质量。
1.3.2根、芽长度及干重
15 d发芽结束后,将幼苗用蒸馏水冲洗干净,用滤纸吸干表面水分。每处理随机取10株测量株高、根长和干重。
1.3.3生理指标的测定
分别取IAA、ETH和NAA处理后发芽表现最好的山韭幼苗叶片,进行生理指标测定。生理指标包括:可溶性蛋白、可溶性糖、淀粉酶、脂肪酶和中性蛋白酶,均采用苏州科铭生物技术有限公司测定试剂盒进行测定。IAA、脱落酸(Abscisic Acid,ABA)、赤霉素(Gibberellins,GA3)和ETH的测定采用上海酶联生物科技有限公司试剂盒进行。
1.4 数据分析
数据统计及图表制作采用Microsoft Office Excel2010软件,采用IBM SPSS Statistics 22.0统计软件进行显著性方差分析并进行差异显著性检验(Duncan),主成分分析及相关性分析采用Origin 2021软件。
2 结果与分析
2.1 IAA、ETH和NAA处理对山韭种子发芽的影响
由表2可知,与ck相比,IAA处理显著提高了山韭种子的发芽指数和活力指数,当IAA浓度为100 mg/L时,活力指数达到最大值(1 199.92);当IAA浓度增加到250 mg/L时山韭种子的发芽指数达到最大值(29.85)。100~250 mg/L的IAA处理显著提高了山韭种子的发芽势,在IAA浓度为200 mg/L时,发芽势达到最大值(26.67%);但当IAA浓度增加到300 mg/L时,山韭种子的发芽势降低,为6.00%。IAA处理下的发芽率虽没有显著变化,但与ck相比,也稍有提升,在IAA浓度达到100 mg/L时发芽率达到最高值(83.33%)。
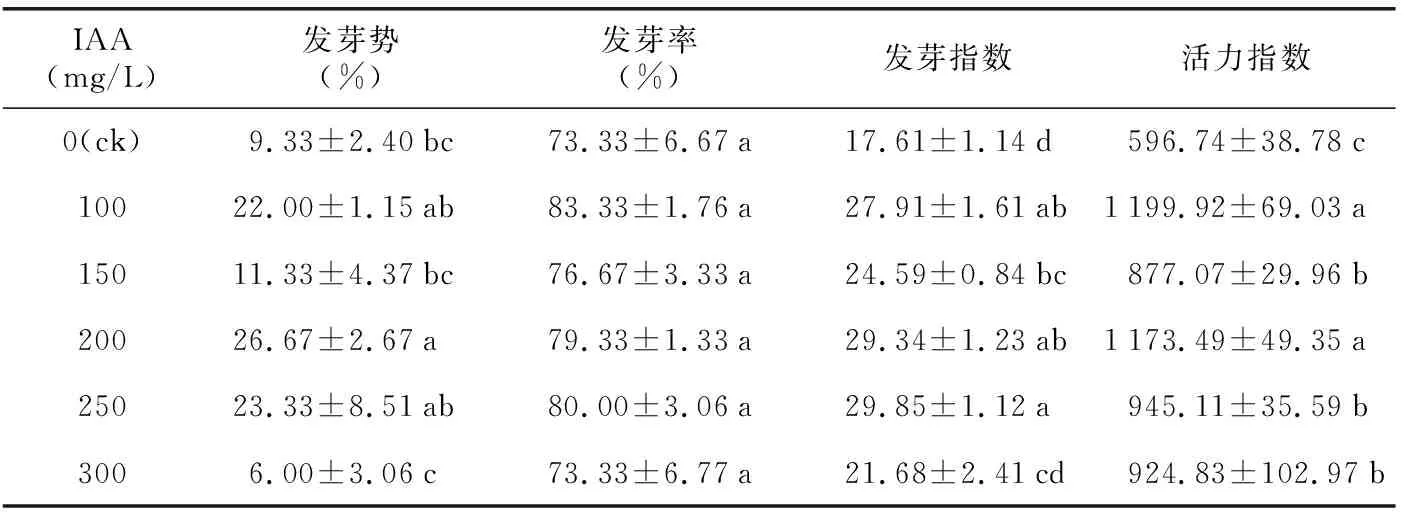
表2 IAA处理对山韭种子发芽的影响Table 2 Effects of IAA treatments on seed germination of Allium senescens L.
由表3可知,与ck相比,ETH处理显著提高了山韭种子的发芽势、发芽指数、活力指数。50、75 mg/L的ETH处理显著提高了山韭种子的发芽率。ETH处理下,山韭种子发芽势、发芽率、发芽指数和活力指数均呈先升后降的趋势。当ETH浓度增加到50 mg/L时,发芽势和发芽率均达到最大值,分别为68.00%和84.00%,而当ETH浓度增加到75 mg/L时,发芽指数和活力指数也均达到最高值,分别为54.39、2 574.27。但在25 mg/L和100~125 mg/L ETH的处理下,山韭种子的发芽率则显著低于ck。说明只有适宜浓度的ETH才有助于促进山韭种子的萌发。

表3 ETH处理对山韭种子发芽的影响Table 3 Effects of ETH treatments on seed germination of Allium senescens L.
由表4可以看出,与ck相比,NAA处理显著降低了山韭种子的发芽势、发芽指数和活力指数,且在NAA浓度800 mg/L时降到最低值,分别为0、7.66和80.88。发芽率在200 mg/L NAA处理下有所升高,为75.33%,但不显著,与ck相比仅提高了2.00%。100 mg/L NAA处理下山韭种子发芽势降为0,当NAA浓度增加到200 mg/L,发芽指数达到最大值,为13.89,仍比ck低3.72。当NAA浓度为800 mg/L时,活力指数降到最低值(80.88),与ck相比,降低了515.86。说明NAA处理对山韭种子的萌发有抑制作用。

表4 NAA处理对山韭种子发芽的影响Table 4 Effects of NAA treatments on seed germination of Allium senescens L.
2.2 IAA、ETH和NAA处理对山韭幼苗形态指标的影响
由图1可见,与ck相比,IAA处理显著增高山韭幼苗的芽根长和芽根重。由图1 A可知,山韭幼苗的芽长和根长均在IAA浓度为100 mg/L时达到最高,分别为43.00 mm和22.00 mm。但当IAA浓度超过100 mg/L后,山韭幼苗的芽长和根长则呈下降趋势,250 mg/L时,芽长最低,为31.67 mm;根长则在IAA浓度300 mg/L时最低,为3.33 mm,且显著低于ck。IAA处理下山韭幼苗的芽长/根长则呈上升趋势,且当IAA浓度为300 mg/L时显著高于ck,为13.02。由图1 B可知,山韭幼苗的芽重、根重均在IAA浓度200 mg/L时达到最大值,分别为0.021 0 g和0.006 0 g。山韭幼苗的芽重在IAA浓度为250 mg/L时达到最低,为0.011 4 g;根重则在IAA浓度为300 mg/L时达到最低(0.000 5 g),且显著低于ck。IAA处理下,山韭幼苗芽重/根重则总体呈上升趋势,当IAA浓度为300 mg/L时显著高于ck,为32.75。
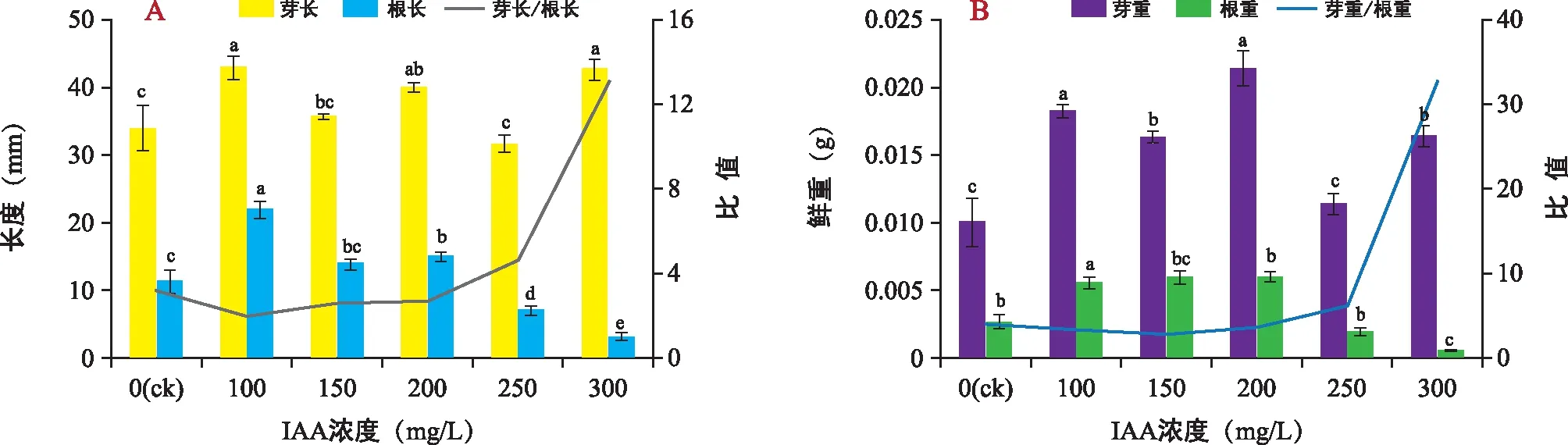
注:同一指标不同小写字母表示差异显著(p<0.05)。下同。图1 IAA处理对山韭幼苗形态指标的影响Fig.1 Effects of IAA treatments on morphological of Allium senescens L. seedlings
由图2可见,与ck相比,低浓度的ETH处理下山韭幼苗的芽根长和芽根重显著提高。由图2 A可知,山韭幼苗的芽长在ETH浓度为100 mg/L时达到最高,为51.00 mm。但当ETH浓度为125 mg/L时,芽长则降到最低,为33.67 mm。山韭幼苗根长则在ETH浓度增加到75 mg/L时达到最高,为31.33 mm。山韭幼苗的芽长/根长则在ETH处理下呈先下降后上升的趋势,当ETH浓度增加到125 mg/L时显著高于ck,为8.77。由图2 B可知,山韭幼苗的芽重和根重均呈先上升后下降的趋势,ETH浓度为100 mg/L时,山韭幼苗芽重达到最大值,为0.017 5 g。山韭幼苗的根重则在ETH浓度为75 mg/L时达到最高,为0.004 6 g;125 mg/L时最低,为0.000 7 g。在ETH处理下的山韭幼苗芽重/根重则总体呈上升趋势,当IAA浓度为125 mg/L时显著高于ck,为16.94。
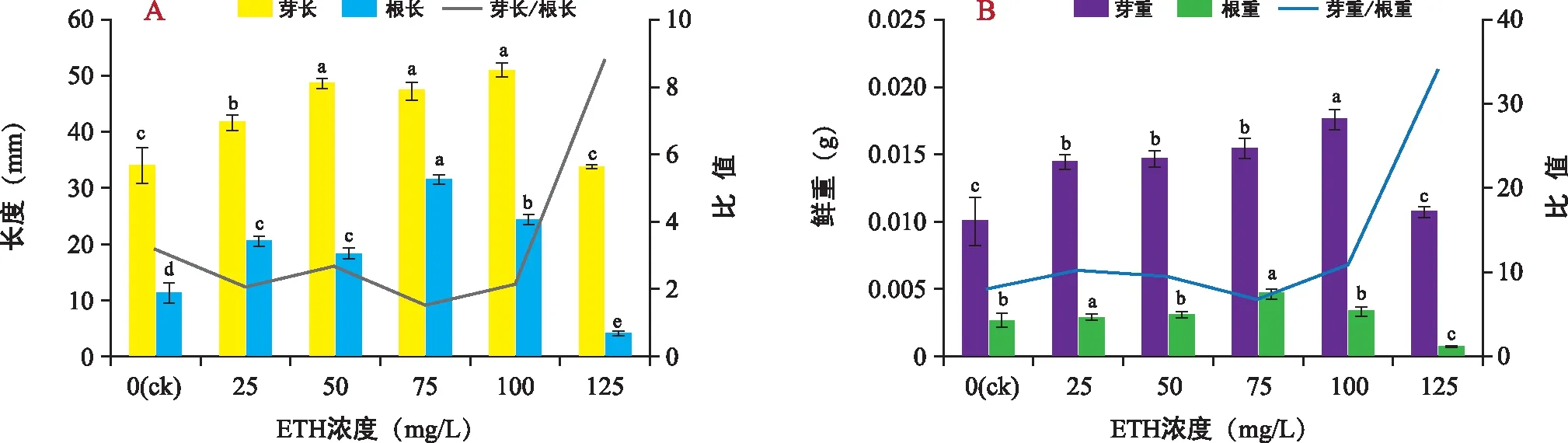
图2 ETH处理对山韭幼苗形态指标的影响Fig.2 Effects of ETH treatments on morphological of Allium senescens L. seedlings
由图3可见,与ck相比,NAA处理下的山韭芽根长与芽根重总体均呈下降趋势。由图3 A可知,随着NAA浓度的增加,山韭幼苗芽长和根长均显著下降。山韭幼苗芽长/根长则呈先升后降的趋势,在NAA浓度为200 mg/L时,芽长/根长达到最大值(15.38),且显著高于ck。由图3 B可知,随着NAA浓度增加,山韭幼苗的根重呈下降趋势,而芽重仅在NAA浓度为50 mg/L时稍有上升,之后随NAA浓度的增加显著下降。山韭幼苗芽重/根重随NAA浓度的增加呈先升后降的趋势,当NAA浓度为200 mg/L时达到最高(23.47),且显著高于ck。

图3 NAA处理对山韭幼苗形态指标的影响Fig.3 Effects of NAA treatments on morphological of Allium senescens L. seedlings
2.3 IAA、ETH和NAA处理对山韭幼苗生理指标的影响
由图4可见,与ck相比,100 mg/L IAA、50 mg/L ETH和200 mg/L NAA处理下的山韭幼苗可溶性蛋白和可溶性糖含量显著增加,其中50 mg/L ETH处理下的可溶性蛋白含量(27.24 mg/g)显著高于其他两种激素;200 mg/L NAA处理下可溶性糖含量最高,为25.00 mg/g。山韭幼苗在100 mg/L IAA、50 mg/L ETH和200 mg/L NAA处理下,其α-淀粉酶、β-淀粉酶、(α+β)淀粉酶均无显著变化,但稍有上升。100 mg/L IAA、50 mg/L ETH和200 mg/L NAA处理下山韭幼苗脂肪酶和中性蛋白酶活性也有显著提高,50 mg/L ETH处理下脂肪酶含量显著高于其他处理,为42.73 μmol/(min·g);100 mg/L IAA处理下的山韭幼苗中中性蛋白酶活性最高,为12 566.68 μmol/(min·g)。3种处理下的山韭幼苗ABA激素含量并无显著变化,但与ck相比有所下降。而3种处理下的内源IAA含量与ck相比则显著下降,其中50 mg/L ETH处理下的内源IAA含量下降最为显著,为142.82 μg/L。与ck相比,50 mg/L ETH处理下的山韭幼苗内源ETH含量显著上升,且高于其他处理,为5 161.96 μg/L。山韭幼苗内源GA3含量在3种激素处理下则无显著变化。

图4 IAA、ETH和NAA处理对山韭幼苗生理指标的影响 Fig.4 Effects of IAA, ETH and NAA treatments on physiological indicators of Allium senescens L.
2.4 IAA、ETH和NAA处理下山韭种子萌发各指标的综合分析
由图5 A可见,山韭种子各处理下的指标主要分布在1、2、4象限,即在100 mg/L IAA、50 mg/L ETH和200 mg/L NAA处理之间。芽长/根长和芽重/根重二者之间近乎重合,说明它们之间有很强的相关关系。在100 mg/L IAA和50 mg/L ETH之间,可溶性蛋白、α-淀粉酶和脂肪酶之间距离较近,说明它们之间相关性较强;GA3与发芽率距离很远,说明二者之间有极强的相关性;发芽势、活力指数、发芽指数之间距离也很近,说明它们之间存在极强的相关关系,这些指标均与100 mg/L IAA和50 mg/L ETH存在较强相关关系。(α+β)淀粉酶和根重之间距离较近,二者之间也有很强相关性。由图5 B可见,发芽率、发芽势、发芽指数、活力指数、芽根长、芽根重之间均存在极强的正相关关系;而芽重/根重和芽长/根长则与它们之间存在很强的负相关关系。同时,发芽率、发芽势、发芽指数和活力指数与可溶性蛋白之间也存在较强的正相关关系。可溶性糖与芽根长、芽根重之间又有较强的负相关关系,但与芽长/根长和芽重/根重则呈正相关。α-淀粉酶与发芽势和可溶性蛋白呈正相关,(α+β)淀粉酶与β-淀粉酶正相关。脂肪酶与可溶性蛋白和α-淀粉酶相关。蛋白酶与(α+β)淀粉酶与β-淀粉酶之间负相关。ABA与发芽率、α-淀粉酶和蛋白酶存在负相关关系。IAA与发芽率、发芽势、发芽指数、活力指数、芽长β-淀粉酶和(α+β)淀粉酶存在很强的负相关性。ETH与发芽势发芽指数、活力指数、可溶性蛋白、(α+β)淀粉酶和脂肪酶存在极强的正相关性。GA3与发芽率发芽势发芽指数、活力指数、可溶性蛋白、脂肪酶和ETH存在显著正相关关系。ETH和GA3与IAA显著负相关性。

图5 IAA、ETH和NAA处理下山韭各指标主成分分析和相关性分析Fig.5 Principal component analysis and correlation analysis of all indices of Allium senescens L. under IAA, ETH and NAA treatments
3 讨 论
3.1 植物激素处理对种子活力的影响
外源激素不仅对植物生长发育具有调控作用[18-20],还对植物种子萌发起到促进或抑制的作用[21]。张薇等[22]研究表明,低浓度外源激素溶液浸种促进种子发芽,高浓度外源激素溶液浸种则产生抑制作用;闫艳华等[23]研究了外源激素处理对曼陀罗(Daturastramonium)种子萌发的影响,结果表明,随IAA浸种浓度升高,种子发芽率和发芽势逐渐提高,且幼苗芽根的长势也最好。本研究中,山韭种子在100~250 mg/L的IAA处理下,发芽势、发芽率、发芽指数、活力指数等指标与ck相比均有显著增高,但当IAA浓度增加到300 mg/L时,山韭种子的发芽势和发芽率则有所下降。
ETH是外源植物生长调节剂,具有打破种子休眠、调节植物生长发育、增强抗逆性和提高果实品质等作用[24-26]。研究表明,ETH能够增加甘蔗的出苗率、幼苗茎干重和根干重[27]。适量的ETH能活化细胞的某种酶,促使细胞分裂,使种子萌发,过量的ETH则会破坏细胞结构。本研究表明,25~125 mg/L ETH处理对山韭种子的萌发均有促进作用,但125 mg/L ETH处理对山韭幼苗的根长和根重会产生抑制作用,其中50 mg/L ETH处理对山韭种子的萌发促进最为显著。
NAA可促进植物根系生长,具有促进细胞分裂与扩大,诱导形成不定根的作用[28]。袁芳等[29]研究发现,NAA处理不利于喜马拉雅紫茉莉种子的萌发。本试验结果表明,50~800 mg/L NAA处理对山韭种子的萌发有抑制作用,且随NAA浓度的增加,山韭种子的发芽和形态指标均呈下降趋势;这与靳祖石等[30]的研究结论有所不同,推测是因为不同植物种子对不同植物生长调节剂的敏感程度不同。
3.2 植物激素处理对山韭种子贮藏物质和酶活性的影响
种子成熟的过程中会积累大量的可溶性糖、可溶性蛋白等贮藏物质,当种子打破休眠进入萌动状态时,首先动用胚部或胚中轴的可溶性糖及贮藏蛋白[31]。而贮存物质分解需要酶的参与,因此,与贮存物质分解有关的酶活性升高是促进种子萌发的重要原因,蛋白酶活力提高,导致蛋白质的水解速度加快,增加了种子萌发所需的物质和能量供应[32]。闫晓娜等[33]研究发现,IAA处理显著提升偃松种子的可溶性蛋白。可溶性蛋白质是主要的氮源,在萌发时被动员。本实验中,激素处理的山韭种子在萌发过程中蛋白质含量显著增加,表明种子萌发和形态建成需要蛋白质提供能量和物质[34]。可溶性糖是种子萌发的呼吸底物,作为能量来源被逐渐分解[35]。激素处理下,山韭的可溶性糖和可溶性蛋白质含量较其他处理高,说明激素处理对种子萌发的生化指标有一定影响。而3种激素处理下的山韭α-淀粉酶、β-淀粉酶、(α+β)淀粉酶活性则无明显变化;但脂肪酶活性则均有明显提升。与ck相比,蛋白酶在100 mg/L IAA和200 mg/L NAA处理下也有显著增加。
3.3 植物激素处理对山韭种子内源激素影响
种子发芽与其内源激素的含量变化密切相关[36],本研究显示,与ck相比,100 mg/L IAA、50 mg/L ETH和200 mg/L NAA处理均显著增加了山韭IAA含量;50 mg/L ETH处理显著提升山韭的内源ETH含量,ETH主要是通过增强种子的呼吸作用影响种子的萌发,同时促进胚根细胞的扩大和胚轴的伸长与根毛分化,外源ETH可以促进多种休眠或非休眠植物种子的萌发。在种子休眠与萌发的过程中,ABA和GA3作为两种最为重要的植物激素,相互拮抗[37],3种激素处理下的山韭内源ABA和GA3含量无明显变化,可能是处理期间山韭种子中ABA和GA3拮抗作用不明显。
3.4 植物激素处理下山韭各萌发指标的综合分析
由主成分分析可知,在100 mg/L IAA和50 mg/L ETH处理下,山韭的发芽势、发芽指数和活力指数距离很近,说明ETH处理对山韭种子的萌发影响较大;发芽率与GA3和ETH之间距离较近,说明GA3和ETH是影响山韭发芽率的主要因素。在200 mg/L NAA处理下,芽重/根重和芽长/根长之间距离很近,说明NAA对山韭芽根长、芽根重比值影响很大。通过相关性分析发现,可溶性蛋白、ETH和GA3含量之间存在显著正相关关系,说明山韭种子萌发期间,可溶性蛋白会大量积累来提供能量,同时ETH和GA3含量也很大程度影响山韭种子的发芽。IAA含量与ETH和GA3含量之间则存在显著负相关性,说明IAA与二者可能存在拮抗作用。α-淀粉酶也与发芽率存在极显著正相关关系,说明山韭种子的发芽率受α-淀粉酶的控制。
4 结 论
与ck相比,100 mg/L IAA和50 mg/L ETH对山韭种子的萌发和形态有显著促进作用,NAA处理则对山韭种子萌发和生长有抑制作用。100 mg/L IAA处理显著提高山韭种子可溶性蛋白含量和蛋白酶活性。50 mg/L ETH处理显著增加了山韭可溶性蛋白、可溶性糖含量、脂肪酶活性、内源IAA和ETH含量,但却显著降低了蛋白酶活性。200 mg/L NAA处理也显著提升了山韭的可溶性蛋白、可溶性糖含量、蛋白酶活性和内源ETH含量。综合种子发芽情况及形态指标得出,100 mg/L IAA和50 mg/L ETH是促进山韭萌发的最佳浓度。

