湿地植物根系分泌物中有机酸对NSAIDs胁迫的响应
叶彬,周涛,廉杰,李祎飞*,邹华
(1.江南大学环境与土木工程学院,江苏 无锡 214122;2.东珠生态环保股份有限公司,江苏 无锡 214101)
非甾体类消炎药(Non-steroidal anti-inflammatory drugs,NSAIDs)是应用最为广泛的一类消炎药,具有解热、止痛、抗炎等作用,在农村地区使用量大且检出频率高,其会通过人和牲畜的排泄、污水排放、废弃药物的不合理处置等途径进入农村地表水环境。地表水是农业灌溉和养殖用水的主要来源,NSAIDs不断被排入到地表水环境中,易形成“持久性”污染,会对农作物和水产品造成潜在危害。已有文献报道:莴苣和菠菜中富集的NSAIDs会损害植物线粒体、细胞膜等细胞结构;NSAIDs中的布洛芬和双氯芬酸会在鲤鱼组织中累积,并产生细胞遗传毒性。因此,如何有效控制农村地表水环境中NSAIDs的污染在保障农业安全方面具有重要意义。
地表水体具有水域广、水量大等特点,采用传统的水处理技术(混凝沉淀、吸附、离子交换、膜分离等)进行集中处理的可行性低,目前,国内普遍采用的技术为生物修复技术,其中最主要的一个技术为植物修复技术,如人工湿地。人工湿地是适用于农村地区的分散式污水处理设施,处理农村生活污水中的药物污染物(如布洛芬和双氯芬酸)效果较好。但是,地表水和生活污水水质差异大,地表水药物污染物浓度更低,已有少量研究发现人工湿地去除地表水体中的药物存在去除不完全且耗时长的问题。因而,深入探索NSAIDs(地表水浓度级别)在人工湿地中的降解机制,是对湿地技术进行改进以有效控制地表水环境NSAIDs污染的重要前提。
植物在人工湿地中发挥重要作用,其根际微生物具有降解有机污染物的能力。根系分泌物是根际微生物重要的碳源、能源和信号物质,微生物对根系分泌物的偏好可以驱动根际微生物的构建。在非生物胁迫下,植物根系分泌物的组分会发生改变以减轻胁迫的影响,从而推动根际微生物群落的变化。有机酸是根系分泌物的重要组成部分,在响应非生物胁迫过程中其组分会发生改变以抵制胁迫,如一些有机酸的释放速率增大从而吸引有益微生物在根际定殖。在有机污染物降解方面,已有文献报道了有机酸(如柠檬酸)促进微生物降解多环芳烃的现象。综上可以推测,根系分泌物中的有机酸组分在NSAIDs胁迫下会发生改变,从而促使NSAIDs降解菌在根际定殖。因此,明确根系分泌物中哪些有机酸具有促进根际微生物降解NSAIDs的潜力,尤其是针对人工湿地常用的植物,具有重要的现实意义,可以为改进人工湿地技术以提高地表水体NSAIDs的去除效率打开新思路,如模拟根系分泌物有机酸组分,人工配制根际NSAIDs降解菌的促生剂等。为实现这一目标,一方面需要准确定量湿地植物根系分泌物中的有机酸,另一方面需要揭示湿地植物根系分泌物中有机酸组分在NSAIDs长期胁迫下的变化,显著增多的有机酸可能具备吸引有益微生物在根际定殖以降解NSAIDs的功能。
针对人工湿地常用的植物芦苇(),本研究开展了NSAIDs长期胁迫实验。鉴于NSAIDs在地表水环境中不是孤立存在的,且NSAIDs混合物的生态风险需要引起高度重视,本研究采用我国水环境风险评估高的5种NSAIDs(双氯芬酸、布洛芬、吲哚美辛、酮洛芬、萘普生)进行了混合暴露实验,各NSAID的浓度为水环境常见浓度(100 ng·L)。
在实验过程中,本研究首先优化了测定12种有机酸的高效液相色谱(HPLC)方法,以降低同时检测10种以上有机酸时的检测限和检测时间。然后,在实验室分别构建水培体系(营养液培养)和人工湿地体系(表面流型人工湿地),收集NSAIDs胁迫下芦苇幼苗期、展叶期和快速生长期的根系分泌物,分析有机酸的释放速率,并同时检测植物的生长生理指标和根部累积的NSAIDs浓度。12种目标有机酸为丙二酸、琥珀酸、苹果酸、乙酸、丙酸、柠檬酸、富马酸、乳酸、反乌头酸、酒石酸、草酸和奎尼酸,这些是非生物胁迫下根系分泌物中易发生变化的组分,也是芦苇根系分泌物中常见的有机酸。另外,根系分泌物很容易被微生物降解,开展水培研究可以尽量减少微生物的影响从而更全面地了解有机酸的组分变化;而人工湿地体系更为复杂,开展湿地体系研究可以深入了解实际条件下有机酸的释放情况。通过综合分析两个体系中有机酸组分变化规律,揭示芦苇根系分泌物中有机酸响应NSAIDs长期胁迫的特点,从而判断哪些有机酸组分具备吸引有益微生物在根际定殖以降解NSAIDs的潜力。
1 材料与方法
1.1 仪器与试剂
定量有机酸的仪器为Scientific-Ultimate 3000高效液相色谱仪(美国Thermo Fisher公司),色谱柱型号为安捷伦ZORBAX SB-AQ(4.6 mm×250 mm,5 µm)。检测5种NSAIDs的仪器为超高效液相色谱-三重四极杆串联质谱仪(HPLC-MS/MS,美国Waters公司),冷冻干燥根系分泌物收集液的仪器为Alpha1-4 LSCbasic真空冷冻干燥机(德国Christ公司)。
双氯芬酸(DCF)、布洛芬(IBP)、吲哚美辛(IMC)、酮洛芬(KTP)、萘普生(NPX)5种NSAIDs标准品购自英国LGC(英国政府化学家实验室)公司;有机酸标准品包括丙二酸、琥珀酸、苹果酸、乙酸、丙酸、柠檬酸、富马酸、乳酸、反乌头酸、酒石酸、草酸和奎尼酸,其均购自国药集团化学试剂有限公司。HPLC流动相所需试剂有磷酸二氢钾、磷酸(调节pH)、甲醇,其均购自国药集团化学试剂有限公司和百灵威科技有限公司。
5种NSAIDs的理化性质详见表1。
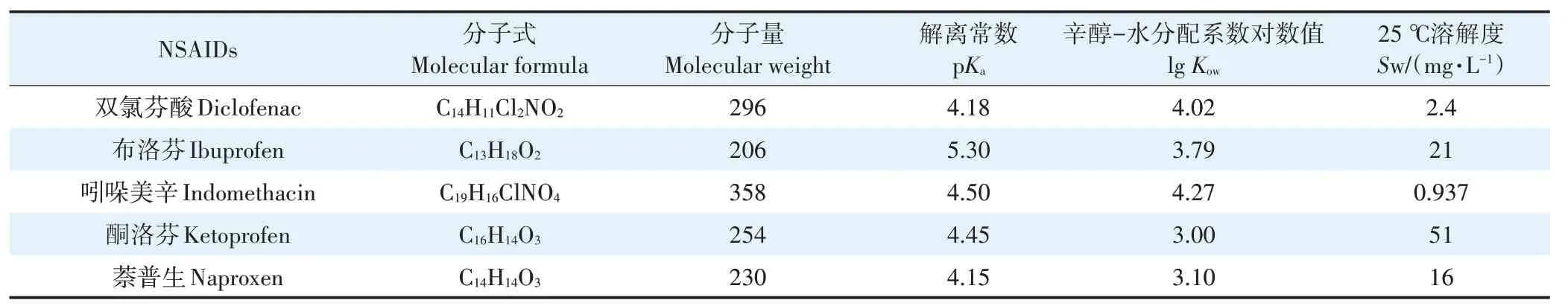
表1 5种NSAIDs的理化性质Table 1 Physicochemical properties of the five NSAIDs
1.2 HPLC测定有机酸的方法优化
HPLC的初始色谱条件设计为进样量20 µL、流速1 mL·min、柱温30℃,流动相为10 mmol·LKHPO(磷酸调节pH至2.6)与甲醇的混合溶液(97∶3,/)。然后,分别于波长200、205、210、215 nm,柱温30、31.5、33、34.5、36℃,流动相pH 2.4、2.5、2.55、2.6、2.7的条件下,考察有机酸混合标准溶液(500 mg·L)中各有机酸的峰型和信号值,确定最优的波长、柱温和流动相pH。由于草酸、富马酸和反乌头酸的信号值明显高于其他有机酸,这3种有机酸的浓度级别设计为0.08、0.16、0.4、0.8、1.6、4、8、16、40 mg·L,其他有机酸标准曲线构建的浓度级别为1、2、5、10、20、50、100、200、500 mg·L。
1.3 根系分泌物中有机酸的释放速率测定
1.3.1 水培体系中根系分泌物的收集与预处理
在温室环境中构建营养液水培体系(图1A),培育芦苇幼苗,开展NSAIDs混合物的胁迫实验。温室条件:温度25℃,光照强度10 000 lx,光照时间16 h/8 h(光/暗),湿度75%。在温室中用芦苇根状茎培育幼苗,将植株幼苗经自来水、超纯水和无菌水清洗后,移入800 mL霍格兰营养液(灭菌)中继续培育,分别在30 d(幼苗期)、60 d(展叶期)和120 d(快速生长期)收集根系分泌物样本。实验分为两组:NSAIDs胁迫组和对照组(无NSAIDs胁迫),每组实验6个平行,每个平行在营养液中种植一株植物。在植物培育期间,每3 d更新一次营养液,每天补充蒸腾损失的水分,并加入5种NSAIDs,各消炎药的浓度均为100 ng·L,以保证持续的NSAIDs胁迫。

图1 实验装置图Figure 1 Experimental setups
根系分泌物收集时,将芦苇从营养液中小心取出进行清洗,期间避免根部损伤,然后将每株芦苇分别放入灭菌烧杯(包裹锡箔纸)中,加入无菌水没过其根部,在温室条件下培养2 h,而后将收集的根系分泌物溶液经0.22 µm膜过滤。为了进一步收集根表面残留的根系分泌物,将芦苇的根切下,切面以下部分浸入盛有无菌水的灭菌烧杯中,超声振荡10 min(20 kHz、200 W、间隔时间5 s,4℃),同样将溶液经0.22µm膜过滤。将两次的根系分泌物滤液充分混合,进行冻干处理,每组实验的冻干根系分泌物混合后称质量,储存在-20℃冰箱。
根系分泌物中有机酸在HPLC测定前,需要将冻干的根系分泌物进行预处理,具体方式如下:称取1 mg冻干的根系分泌物溶解在100µL甲醇中,静置30 min后,加入400 µL无菌水,振荡10 s后用0.22 µm PTFE膜过滤。
1.3.2 人工湿地体系中根系分泌物的收集与预处理
在1.3.1所述的温室环境中,于实验室构建微宇宙表面流型人工湿地(图1B)。湿地直径20 cm,高40 cm,内部填充20 cm深的土壤,土壤表面保持10 cm水深,在每个湿地中种植一株芦苇。将芦苇幼苗按照
1.3.1 所述方法处理后,移栽到湿地中培育,收集根系分泌物样本,收集时间同1.3.1所述。实验分为两组:NSAIDs胁迫组和对照组,每组实验3个平行。每个湿地系统每天补水以弥补蒸腾损失,每3 d换一次水,胁迫处理组每天还需加入5种NSAIDs(100 ng·L)以保持持续的NSAIDs胁迫。根系分泌物的收集方法和HPLC测定有机酸的预处理方法同1.3.1。
1.3.3 根系分泌物中有机酸释放速率的定量分析
水培体系和人工湿地体系芦苇根系分泌物中有机酸的释放速率按照公式(1)计算。
有机酸释放速率=有机酸检测浓度×样品体积×根系分泌物总质量/(根系分泌物样品质量×收集时间×干根质量)×100% (1)式中:有机酸检测浓度为HPLC方法测定的根系分泌物中有机酸的浓度,mg·L;样品体积为500µL;根系分泌物总质量为每组实验冻干的根系分泌物混合后的总质量,mg;根系分泌物样品质量为1 mg;收集时间为2 h;干根质量为每组实验所有芦苇根部冻干后的总质量,g。
1.4 NSAIDs在芦苇根部的累积浓度测定
芦苇根组织中NSAIDs浓度的测定:首先采用超声提取法和固相萃取法(SPE)对样本进行预处理,然后采用HPLC-MS/MS方法进行定量分析。
超声提取的具体步骤:取一些冻干的芦苇根组织研磨成粉末,称取0.5 g加入20 mL Mcllvaine-EDTA缓冲盐-甲醇提取液,超声提取30 min,离心20 min(4 000 r·min),收集上清液,重复上述提取过程,充分混合两次的上清液,用0.45 µm膜过滤。然后,将滤液经氮吹浓缩至20 mL,用超纯水稀释至200 mL,并用磷酸调节pH为4,继续采用固相萃取法进行净化。固相萃取采用Waters Oasis HLB萃取柱(200 mg,6 mL),首先用10 mL甲醇和10 mL超纯水(调节pH至4)进行活化,然后上样(3 mL·min),进样完毕后用10 mL超纯水淋洗,再负压抽干30 min,最后用12 mL甲醇洗脱HLB小柱,收集的洗脱液缓和氮吹至干,用甲醇定容至0.5 mL,过0.22µm PTFE膜待测。
HPLC-MS/MS仪器配备Water Acquity BEH C18色谱柱(2.1 mm×100 mm,1.7 µm),运行条件:柱温40℃,毛细管柱电压3 kV,离子源温度150℃,干燥气温度500℃,干燥器流量900 L·h,锥孔反吹气流量50 L·h,碰撞气流量0.16 mL·min。NSAIDs的检测为MRM模式,电喷雾离子源(ESI)为负离子,流动相A为5 mmol·L醋酸铵,流动相B为乙腈,进样量5µL。具体的洗脱程序:0~0.25 min,10% B;0.25~3 min,10%~90% B;3~4 min,90% B;4~4.01 min,90%~10% B;4.01~5 min,10% B。DCF、IBP、IMC、KTP、NPX的质谱定量离子对分别为294.0>250.0、205.1>161.0、357.9>110.9、253.0>197.0、229.1>170.0。
1.5 芦苇生长生理指标测定
从水培体系或人工湿地体系中取出芦苇植株,清洗干净后用纸巾擦干,测量植株高度和主根长,并选择芦苇自上而下完全展开的第2~3片叶子进行叶绿素a和叶绿素b的测定。
1.6 图像和数据处理
利用液相色谱仪的Chromeleon 7数据系统对HPLC色谱图进行分析,利用SPSS 20和Origin 2018处理数据和制图。实验组和对照组相同生长期各指标的差异采用SPSS软件的独立样本检验进行分析。
2 结果与讨论
2.1 HPLC法测定有机酸的优化结果
本研究最终优化的HPLC色谱条件为检测波长210 nm、柱温34.5℃、流动相pH 2.55,可以在10 min内同时定量草酸、酒石酸、奎尼酸、苹果酸、丙二酸、乳酸、乙酸、柠檬酸、琥珀酸、丙酸、富马酸和反乌头酸(图2)。
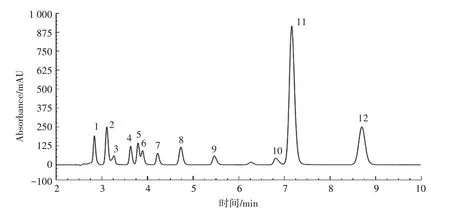
图2 HPLC优化图谱Figure 2 Optimized HPLC chromatogram
12种有机酸的标准曲线参数和回收率如表2所示,相关系数为0.994 01~0.999 98,表明各有机酸的浓度与相应色谱峰的峰面积存在良好的线性关系。各有机酸的检测限(LOD)为0.01~0.95 mg·L,定量限(LOQ)为0.02~3.18 mg·L,其中LOD均低于1 mg·L。另外,各有机酸的加标回收率在90.70%~127.58%范围内,回收率良好。

表2 12种有机酸的标准曲线参数和回收率Table 2 Standard curve parameters and recovery rates for 12 organic acids
2.2 水培体系芦苇根系分泌物中有机酸对NSAIDs长期胁迫的响应
优化的HPLC法可以定量分析水培体系芦苇根系分泌物中11种有机酸(图3),即奎尼酸、乙酸、酒石酸、乳酸、琥珀酸、柠檬酸、丙酸、丙二酸、草酸、苹果酸和反乌头酸。通过比较实验组和对照组的有机酸释放速率可知,在NSAIDs胁迫下,实验组幼苗期芦苇的有机酸释放速率与对照组相比差异较小,而展叶期和快速生长期芦苇的奎尼酸、柠檬酸、丙二酸、草酸和苹果酸的释放速率显著高于对照组,并且丙酸在快速生长期也显著增多。值得注意的是,实验组快速生长期芦苇根系释放乙酸、乳酸和琥珀酸的速率显著低于对照组。
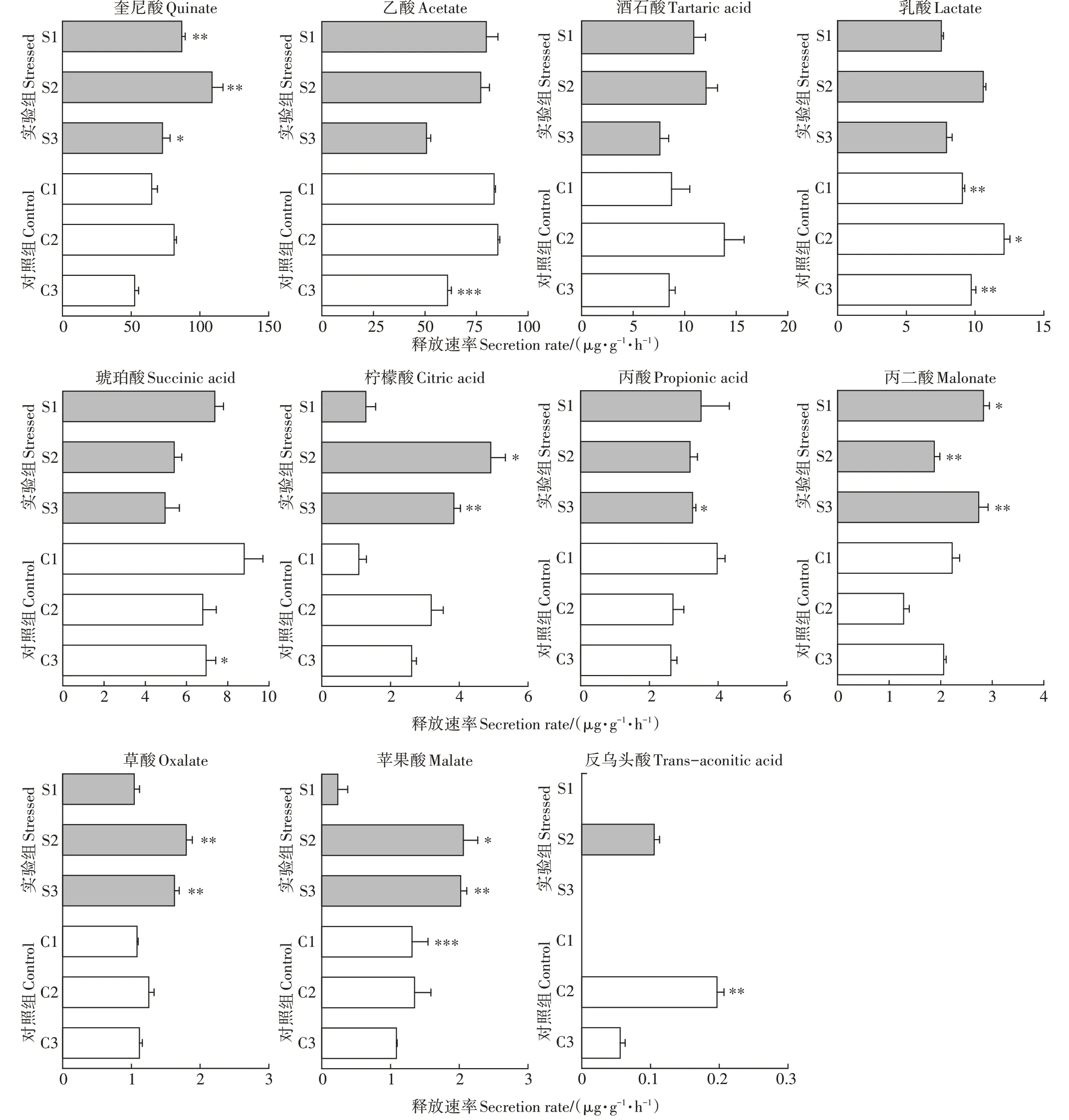
图3 水培体系中芦苇在NSAIDs长期胁迫下有机酸的释放速率Figure 3 Organic acids'secretion rates of Phragmites australis roots under long-term NSAIDs stress in the hydroponic system
如表3所示,水培体系中,NSAIDs胁迫下芦苇在3个生长期的株高和主根长整体略低于对照组,且无显著性差异,但叶绿素a和叶绿素b含量显著低于对照组(幼苗期叶绿素a除外)。NSAIDs在芦苇根部的累积浓度如图4所示,5种NSAIDs在芦苇根组织中均被检出,幼苗期、展叶期和快速生长期的NSAIDs累积浓度分别为30、54 ng·g和101 ng·g,随着植物的生长,NSAIDs在植物根部的累积呈现递增趋势,在快速生长期累积水平较高。
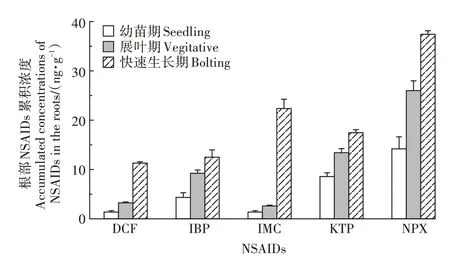
图4 水培体系中芦苇根部NSAIDs的累积浓度Figure 4 Accumulated concentrations of NSAIDs in the roots of Phragmites australis in the hydroponic system
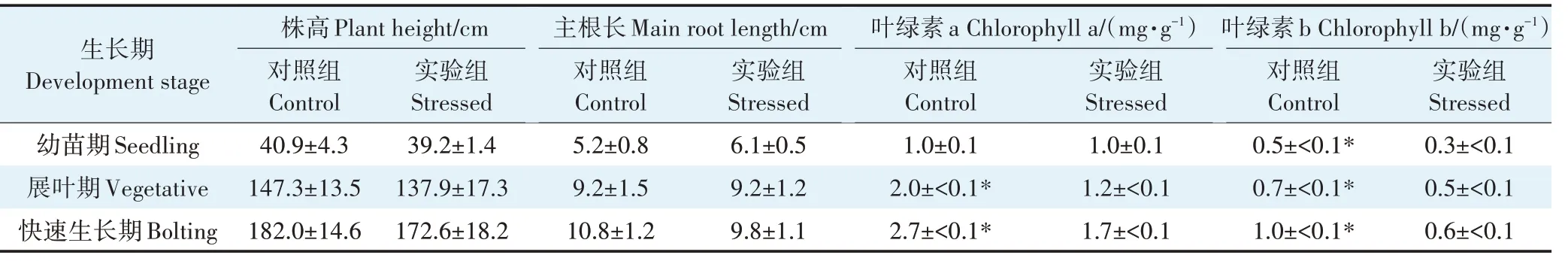
表3 水培体系中芦苇的生长生理指标Table 3 Growth and physiological indices of Phragmites australis under NSAIDs stress in the hydroponic system
已有文献报道了植物具有吸收药物并在体内转运和累积的特点。通常情况下,药物在植物体内累积后会产生过量的活性氧物质(ROS),从而诱发氧化应激现象。本研究发现水培体系中芦苇根部的NSAIDs浓度随着植物的发育而增加,至快速生长期已达到较高水平(图4),并且叶绿素含量受到显著抑制(表3),表明氧化应激和氧化损伤发生的可能性很大。
根系分泌物中的有机酸是植物根际微生物的一种优质碳源,可以为微生物提供营养和能量,从而吸引有益微生物在根际定殖,例如:在芘污染土壤中,添加苹果酸和琥珀酸可以显著提高芘降解菌的生物量。本研究采用灭菌营养液和灭菌器皿构建水培体系,但无法实现完全的灭菌环境,由此可以推测,本研究发现的NSAIDs胁迫下快速生长期芦苇释放速率显著提高的6种有机酸(奎尼酸、柠檬酸、丙酸、丙二酸、苹果酸和草酸),可能具备吸引有益微生物在根际定殖以减轻胁迫影响的潜力。需要注意的是,释放速率显著降低的乙酸、乳酸和琥珀酸相较于其他有机酸,仍然具有较高水平的释放量,可能同样会吸引NSAIDs降解菌在根际定殖。
2.3 人工湿地体系芦苇根系分泌物中有机酸对NSAIDs长期胁迫的响应
在人工湿地体系中,优化的HPLC法检测到芦苇根系分泌物中11种有机酸(图5),包括奎尼酸、柠檬酸、丙酸、苹果酸、丙二酸、琥珀酸、草酸、乳酸、反乌头酸、乙酸和富马酸。在NSAIDs胁迫下,芦苇在幼苗期分泌的有机酸中除奎尼酸和乙酸外均显著低于对照组,但从展叶期开始,乳酸、丙酸、琥珀酸、草酸、柠檬酸等有机酸的释放速率显著高于对照组,至快速生长期,除乙酸外的10种有机酸的释放速率均显著高于对照组。

图5 人工湿地体系中芦苇在NSAIDs长期胁迫下有机酸的释放速率Figure 5 Organic acids'secretion rates of Phragmites australis roots under long-term NSAIDs stress in the constructed wetland system
如表4所示,在NSAIDs胁迫下,人工湿地体系中芦苇3个生长期的株高和主根长基本均低于对照组,且无显著差异,但叶绿素a和叶绿素b在幼苗期和展叶期整体上显著低于对照组,随着植物的生长差异逐渐减小(快速生长期)。NSAIDs在芦苇根部的累积浓度如图6所示,4种NSAIDs可以检出(DCF除外),在幼苗期、展叶期和快速生长期的总浓度分别为8、11、15 ng·g,表明NSAIDs会随着植物的发育逐渐累积在根部,但累积水平较低。NSAIDs中KTP在芦苇根部的累积浓度最高,这可能是由于KTP的lg值在5种消炎药中最低,而lg较低的有机污染物较易在水-土界面被植物根系吸收。

图6 人工湿地体系中芦苇根部NSAIDs的累积浓度Figure 6 Accumulated concentrations of NSAIDs in the roots of Phragmites australis in the constructed wetland system
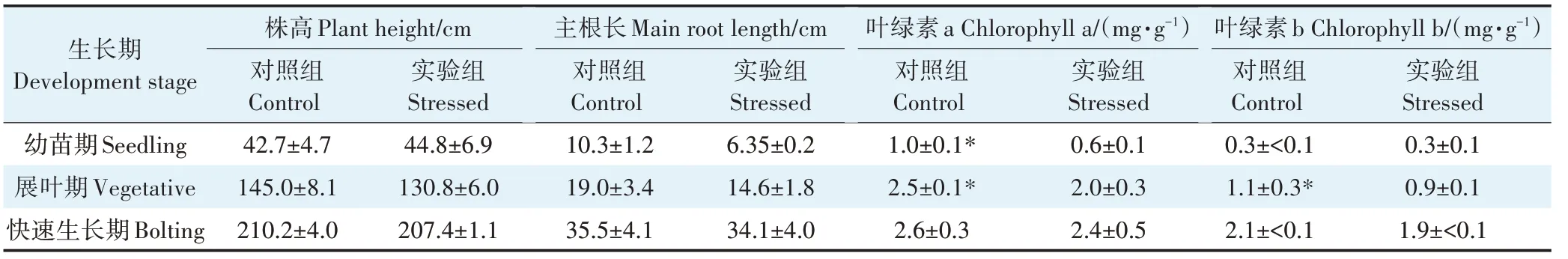
表4 人工湿地体系中芦苇的生长生理指标Table 4 Growth and physiological indices of Phragmites australis under NSAIDs stress in the constructed wetland system
本研究构建的人工湿地体系比水培体系复杂得多,更接近实际条件,体系中微生物群落更丰富、生物量更大,根系分泌物中有机酸对根际微生物的调节作用也会更加明显。芦苇为减轻NSAIDs的胁迫影响可能更倾向于吸引有益微生物在体外降解NSAIDs,从而减少根系对NSAIDs的吸收,本研究发现人工湿地体系中芦苇根部累积的NSAIDs要显著低于水培体系(图4和图6),这也间接支持了这一猜测。在人工湿地中,芦苇的株高和主根长整体上大于水培体系,且叶绿素在快速生长期没有受到显著抑制(表3和表4),可能由于芦苇根系对NSAIDs的吸收量降低,减少了因NSAIDs累积造成的不利影响(如氧化应激)。
随着芦苇的发育,在水培和人工湿地体系的快速生长期芦苇根系分泌物中,均检测到6种有机酸在NSAIDs胁迫下释放速率显著增大,即奎尼酸、柠檬酸、丙酸、丙二酸、苹果酸和草酸,表明这些有机酸可能在吸引有益微生物在根际定殖以降解NSAIDs的过程中发挥重要作用。已有文献报道了有机酸对微生物降解有机污染物的促进作用,如柠檬酸可以吸引枯草杆菌以加速菲的降解,有机酸混合物(柠檬酸、苹果酸、乳酸、草酸和琥珀酸)可以促进寡养单胞菌对多环芳烃的降解。通常微生物降解有机污染物有两种方式:以有机污染物为唯一碳源;以其他碳源为生长基质的同时共代谢有机污染物。基于此,可以推测奎尼酸、柠檬酸、丙酸、丙二酸、苹果酸和草酸这6种有机酸在促进根际有益微生物降解NSAIDs的过程中发挥的作用主要包括:促进直接以NSAIDs为碳源的微生物生长;促进以这些有机酸为碳源共代谢NSAIDs微生物的生长。
3 结论
(1)本研究优化的检测有机酸的高效液相色谱(HPLC)方法,可以在10 min内分离12种有机酸(草酸、酒石酸、奎尼酸、苹果酸、丙二酸、乳酸、乙酸、柠檬酸、琥珀酸、丙酸、富马酸和反乌头酸),检测限为0.01~0.95 mg·L,低于1 mg·L。
(2)在非甾体类消炎药(NSAIDs)胁迫下的水培体系中,随着芦苇的发育,根系释放的奎尼酸、柠檬酸、丙二酸、草酸、苹果酸、丙酸明显增多;株高和主根长未显著降低,但叶绿素a和叶绿素b受到显著抑制;5种NSAIDs在芦苇根组织中均有检出,且随着植物的生长呈现递增趋势,在快速生长期可达101 ng·g,累积水平较高。
(3)在NSAIDs胁迫下的人工湿地体系中,随着芦苇的发育,根系分泌物中有10种有机酸的释放速率显著增大,包括水培体系明显增多的有机酸;株高和主根长未显著降低,叶绿素未受到显著抑制;在芦苇根组织中检出4种NSAIDs(双氯芬酸除外),且其浓度随着植物的生长呈现递增趋势,在快速生长期为15 ng·g,累积水平较低。
(4)综合来看,湿地植物芦苇在响应NSAIDs长期胁迫的过程中,可能倾向于通过释放特定的有机酸促进根际微生物降解NSAIDs,从而减少根系对NSAIDs的吸收,释放速率明显增多的奎尼酸、柠檬酸、丙酸、丙二酸、苹果酸和草酸具备提高人工湿地处理地表水NSAIDs效率的潜力。

