磁性HAP/Fe3O4材料去除水土环境中Cd的效果研究
尹文华,刘迎春,王杰,王圣森,王小治,尹微琴
(扬州大学环境科学与工程学院,江苏 扬州 225127)
随着社会经济的快速发展,环境中重金属污染日益严重。镉(Cd)是环境中常见的重金属之一,会通过食物链对人体造成永久、持续且不可逆转的伤害,因此,开发高效、经济的Cd去除技术势在必行。
吸附法被认为是治理废水重金属污染的首选方法。在众多吸附剂中,磁性纳米材料结合了磁性材料和纳米材料的优势,为高效去除水中重金属离子提供了新的方向,其中,四氧化三铁(FeO)纳米材料具有体积小、稳定性强等特点,近年来被广泛研究。李静等合成的纳米FeO负载酸改性椰壳炭,对Cd的最大吸附量达25.79 mg·g,为未改性椰壳炭的2.23倍。另外磁性核的存在可以实现磁性纳米颗粒快速分离回收,展现出良好的重复利用性。
不仅水体重金属污染严重,土壤重金属污染问题也不容小觑。在众多土壤修复方法中,使用钝化剂形成高度不溶的重金属化合物的原位修复是一种常用的方法。研究表明,黏土矿物吸附重金属的能力很强,羟基磷灰石[HAP,Ca(PO)(OH)]是自然界中天然存在的矿物质,具有水溶性低、稳定性好、吸附能力强等优点,具备较强的吸附和载体作用,因此更具有合成羟基磷灰石(HAP)类复合材料的优势。纯HAP高制备成本限制了其大规模应用,近年来,许多科学家倾向于使用低成本的材料而不是昂贵的化学试剂制备HAP,如李超群等用贻贝壳制备了HAP多孔微球。作为农业大国,我国每年向环境中排放大量农业废弃物,这不仅造成生物质资源的严重浪费,而且加剧了环境污染。米糠是稻谷加工的主要副产物,富含大量植酸,是一种理想的钙源。
目前的报道多将FeO和HAP用于单一水体或土壤污染修复,而对水土环境重金属的治理研究比较缺乏,因此,本研究以米糠为原料制备HAP,并掺入FeO作为磁性核,将合成的HAP/FeO材料应用于水土环境治理。探究该材料对水体中Cd的去除机理,同时分析HAP/FeO对污染土壤中Cd的钝化效果和对Cd稳定性的影响。
1 材料与方法
1.1 实验试剂
六水合氯化铁(FeCl·6HO,99%),七水硫酸亚铁(FeSO·7HO,≥99%),氨水(NH·HO,25%~28%),盐酸(HCl,37%),尿素(CHNO,99%),无水氯化钙(CaCl,96%),氢氧化钠(NaOH,96%),四水硝酸镉[Cd(NO)·4HO,99%],硝酸钠(NaNO,≥99%),乙醇(CHCHOH,99.7%)均为分析纯化学试剂,购自国药控股有限公司。米糠购自扬州农贸市场。
1.2 材料制备
1.2.1 FeO的制备
将2.70 g FeCl·6HO和1.39 g FeSO·7HO按Fe和Fe摩尔比为2∶1溶于100 mL去离子水中,快速加入20 mL浓氨水,升温至60℃超声30 min,用磁铁收集悬液中黑色颗粒,转入高压反应釜中于150℃反应4 h,反应产物用去离子水和无水乙醇洗涤3次,60℃真空干燥12 h后研磨,得到黑色FeO纳米颗粒备用。
1.2.2 HAP的制备
在250 mL烧杯中称取10 g脱脂米糠和80 g 0.1 mol·L盐酸溶液,同时加入0.5 g尿素以防止蛋白质等物质浸出,超声8 min,抽滤,对滤渣二次提取,合并两次提取的滤液,加入1 g活性炭脱色15 min,得到纯净植酸溶液。随后按Ca和P原子比为1.67加入适量CaCl,用1 mol·LNaOH调节pH为10,静置1 h,去除上清液,转移至100 mL反应釜,升温至190℃反应10 h,自然冷却至室温,收集沉淀用无水乙醇洗涤3次,真空干燥,研磨,得到HAP粉末备用。
1.2.3 HAP/FeO的制备
HAP/FeO与HAP的制备方法类似。在加入CaCl的同时加入7.10 g FeO,用1 mol·LNaOH调节pH为10,氮气氛围下搅拌30 min,生成沉淀后静置,反应釜190℃反应10 h,收集反应后的沉淀,无水乙醇洗涤干燥,得到HAP/FeO。
1.3 表征方法
用多晶X射线衍射仪(D8-ADVANCE)分析材料反应前后的结构变化;扫描电子显微镜(S-4800II,日本)观察材料的表面形貌;采用美国Micromeritics ASAP 2460进行Brunauer-Emmett-Teller测试,测定材料氮气吸附-脱附等温线和比表面积;HAP/FeO吸附Cd后滤液中Cd浓度用电感耦合等离子体质谱仪(ICP-MS)测定。
1.4 材料对溶液Cd的吸附
本研究进行了吸附动力学实验以及pH影响实验。所有吸附实验均在室温25℃下进行,材料投加量为1 g·L。吸附动力学反应时间为10、15、30、60、120、180、240、360 min,溶液pH为8。为探究pH对吸附量的影响,用1 mol·LHCl和1 mol·LNaOH将污染液pH分别调至3、4、5、6、7、8。为探究吸附剂的可重复利用性,将反应后的吸附剂从溶液中分离,浸泡在0.75 mol·L的HNO溶液中,振荡12 h,吸附剂真空干燥后用于下一个循环吸附实验。
1.5 材料对土壤Cd的钝化固定
实验所用土壤取自江苏省扬州大学农学院稻麦轮作试验田,质地为砂壤,pH为7.51。将Cd污染液与土壤充分混合,老化60 d后,得到pH为8.1、Cd全量为4.12 mg·kg的污染土。按照HAP/FeO与污染土的质量比为0.3%、0.5%、1.0%的比例添加材料,另设不添加HAP/FeO的对照,混合均匀后,土壤湿润至最大持水量的70%,每个处理3个平行,室温培养3、7、12、20、30、42 d后自然风干,进行后续实验。
CaCl浸提法测定土壤可提取态Cd含量。用BCR连续提取法测定污染土中各形态Cd的含量。土壤浸出实验包括pH为6.0的标准实验、pH为4.0的短期酸雨实验和pH为2.8的长期酸雨实验,该评估方法是由日本地质环境保护中心(GEPC)提出的,已在日本广泛使用。标准实验按1 g土壤与10 mL去离子水的比例混合,用0.1 mol·LHSO调节pH为6.0,160 r·min振荡6 h;短期酸雨暴露实验将pH调节至4.0,长期酸雨暴露实验将pH调节至2.8。
2 结果与讨论
2.1 材料表征结果与分析
材料的XRD表征结果如图1a。HAP/FeO的衍射峰与HAP(JCPDS 19-0432)和FeO(PDF 22004)的标准特征峰吻合,衍射角为27.21°、32.45°、40.22°分别对应HAP的(002)、(112)、(310)晶面,衍射角为54.12°、59.73°对应FeO的(422)、(551)晶面,没有其他杂峰出现,衍射峰窄而尖。图1b是氮气吸附-脱附曲线,3个材料均属于Ⅲ型等温线,具有H3型迟滞回线,证明材料中存在微孔和中孔,HAP和HAP/FeO的BET比表面积分别为43.41 m·g和83.28 m·g,孔体积分别为0.122 cm·g和0.143 cm·g。
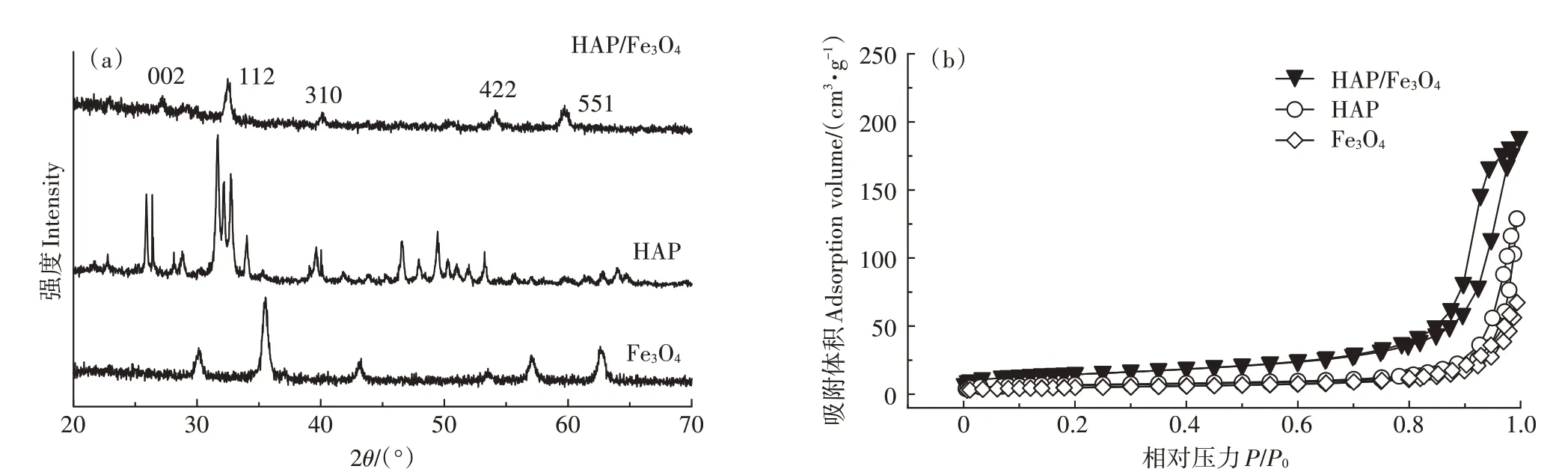
图1 材料的X射线衍射图和氮气吸附-脱附曲线Figure 1 XRD spectra and N2 adsorption-desorption isotherm of materials
扫描电镜(SEM)结构如图2。球状FeO颗粒表面光滑且大小均匀;纯HAP为棒状堆积结构;在HAP/FeO中,球状FeO颗粒附着在棒状HAP表面,粗糙程度增加,比表面积增加,进而提高了吸附能力。

图2 Fe3O4、HAP和HAP/Fe3O4的SEM图(×100 000倍)Figure 2 SEM images of Fe3O4,HAP and HAP/Fe3O4(×100 000 times)
2.2 水体Cd2+的吸附实验
2.2.1 吸附动力学实验
通过伪一阶和伪二阶动力学模型探究材料对溶液中Cd的去除率,结果如图3所示,相关参数见表1。
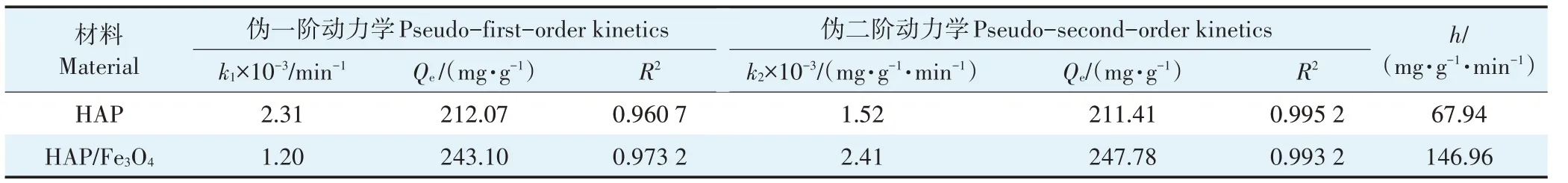
表1 吸附动力学参数Table 1 Adsorption kinetic parameters
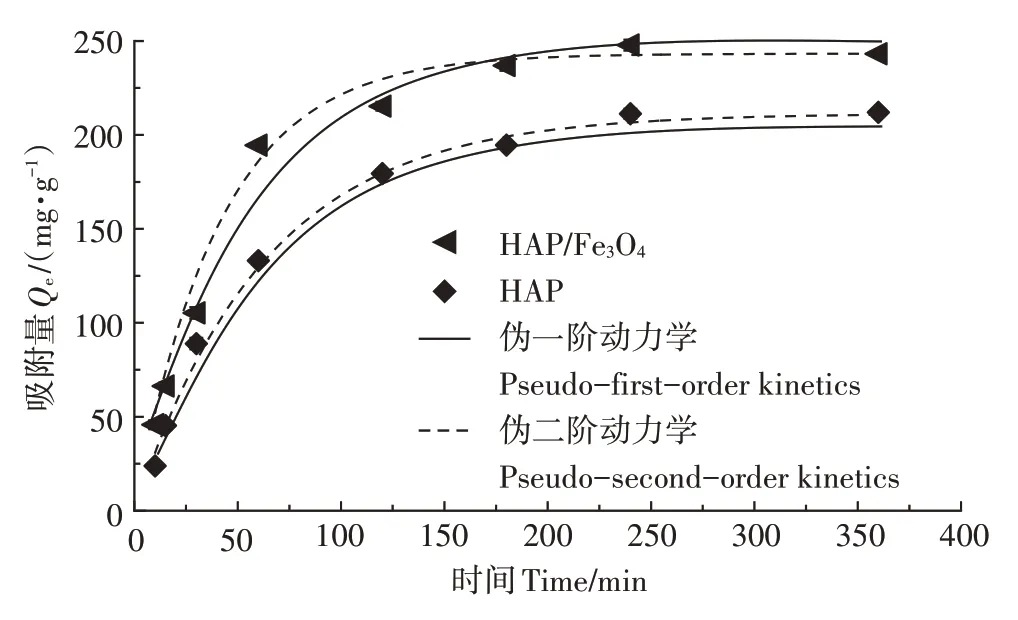
图3 吸附动力学模型曲线(pH 8.0,298 K)Figure 3 Adsorption kinetic model curves(pH 8.0,298 K)
HAP和HAP/FeO的伪二阶动力学方程均高于伪一阶,说明伪二阶动力学模型能更准确地描述HAP/FeO对Cd的吸附过程,说明HAP/FeO对Cd的吸附以化学吸附为主。HAP/FeO对Cd吸附的初始速率(146.96 mg·g·min)高于HAP(67.94 mg·g·min)。反应刚开始时HAP/FeO有较多的活性位点,并且初始Cd浓度较高,大量Cd吸附在HAP/FeO上,随着时间的推移,吸附位点的消耗以及Cd的减少导致吸附速率逐渐下降。
2.2.2 内部扩散模型
内部扩散模型对吸附过程的分析结果如图4所示,所有拟合直线的截距均不为0,说明HAP/FeO对Cd的吸附过程较为复杂,吸附过程可分为3个步骤:第一步,层间表面吸附,溶液中Cd占据HAP/FeO表面活性位点;第二步,Cd分散在吸附剂孔隙中,并伴随着一系列化学反应;第三步,达到吸附平衡。
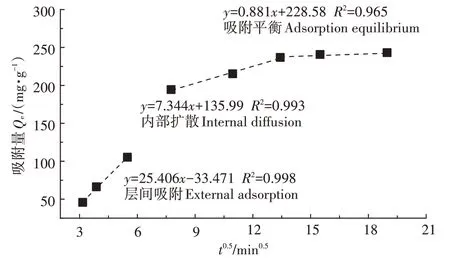
图4 HAP/Fe3O4对Cd2+的内部扩散模型Figure 4 Internal diffusion model of Cd2+by HAP/Fe3O4
2.2.3 pH影响实验
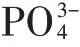
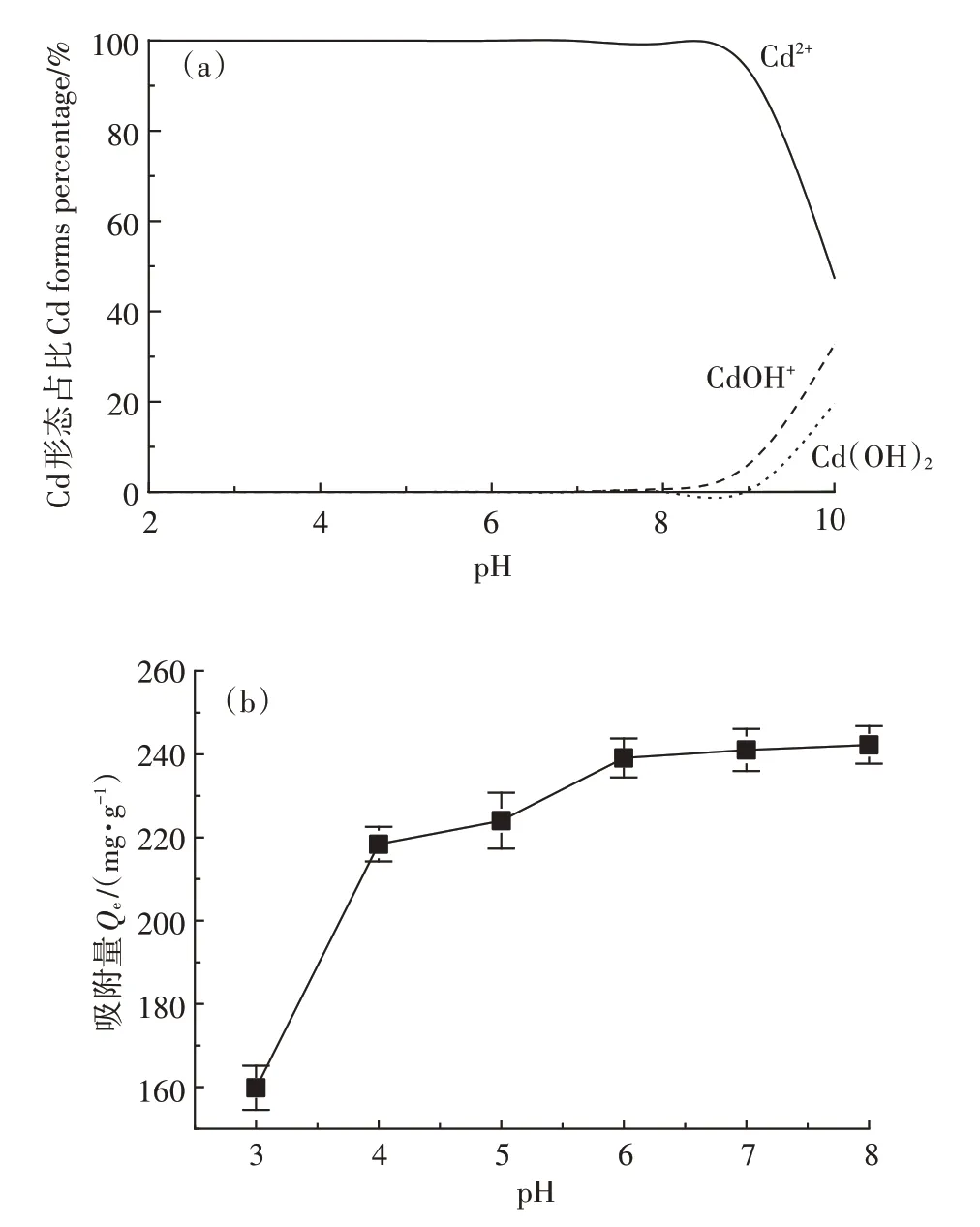
图5 pH对Cd2+形态占比及对HAP/Fe3O4吸附性能的影响Figure 5 Effects of pH on the morphology ratio of Cd2+and adsorption capacity of HAP/Fe3O4
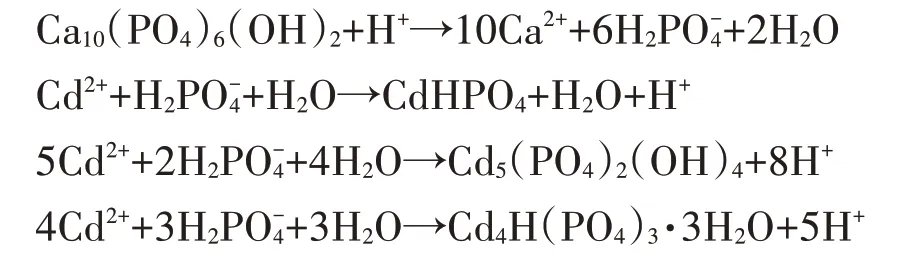
在中性和碱性条件下,HAP/FeO对Cd的吸附主要依赖于与HAP的离子交换,通过扩散过程取代HAP中的Ca。
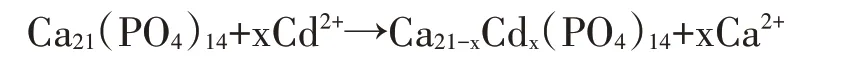
随着初始pH的增加,HAP/FeO对Cd的吸附量也逐渐增加,pH为8时达到242.24 mg·g(图5b)。在较低pH范围内,大量HO出现,排斥力会阻碍Cd接近吸附位点;随pH升高,HO数量减少,与Cd之间的竞争作用减弱,有利于Cd吸附。
2.2.4 循环利用实验
连续5次循环利用后,HAP/FeO对Cd的吸附量仅降低了12.73%,达到210.92 mg·g(图6)。吸附量下降的原因可能是吸附剂上Cd的不完全解吸导致吸附位点的损失以及在循环实验过程中吸附剂质量的损失。通过与其他吸附剂的比较,进一步评价了HAP/FeO对Cd的去除性能,如表2所示。与大多数吸附剂相比,HAP/FeO有更强的去除水中Cd的能力,因此,从环境友好性、可循环性和操作简便等方面考虑,HAP/FeO对去除Cd有良好的实际应用前景。
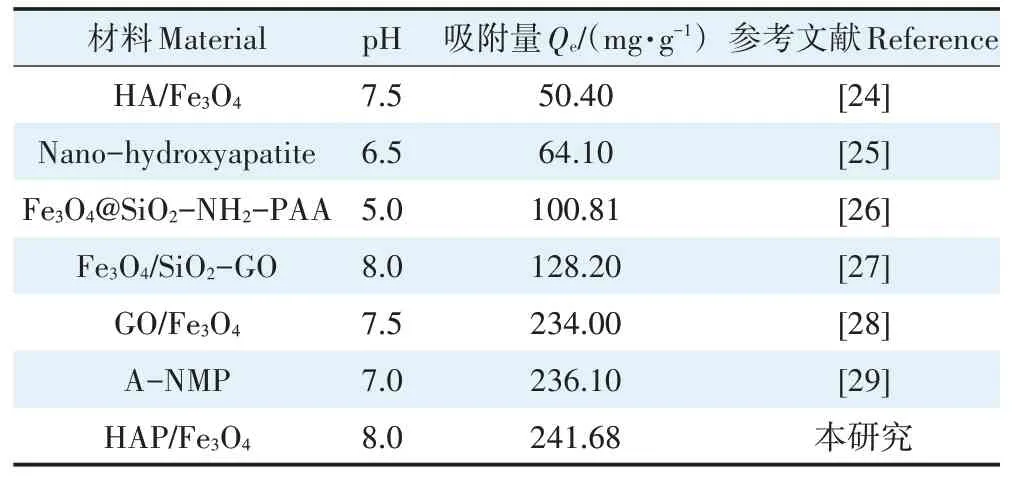
表2 不同吸附剂对Cd2+的吸附性能比较Table 2 Comparison of the removal capacity for Cd2+with different adsorbents
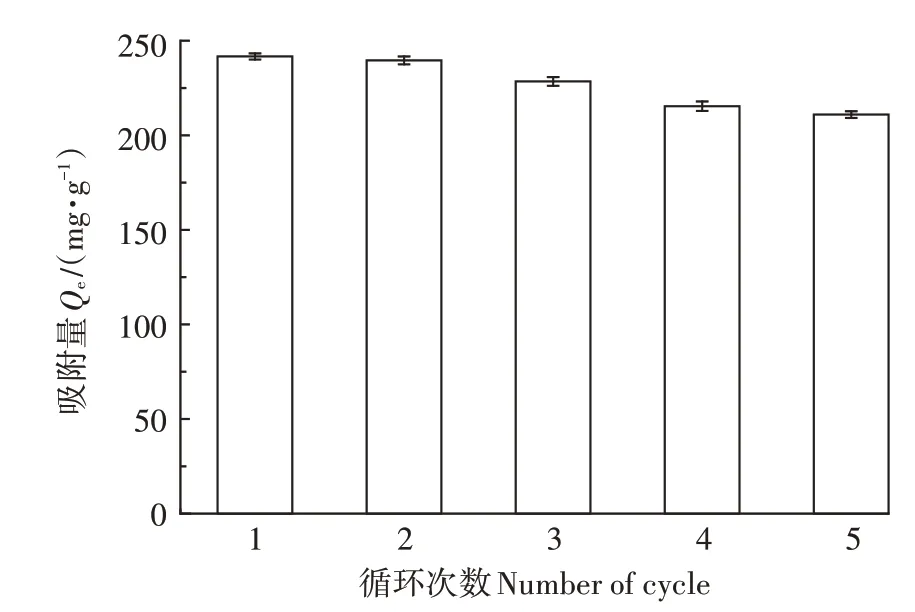
图6 循环次数对HAP/Fe3O4吸附性能的影响Figure 6 Effects of cycling times on HAP/Fe3O4adsorption capacity
2.3 土壤Cd的固定实验
2.3.1 培养时间对土壤pH的影响
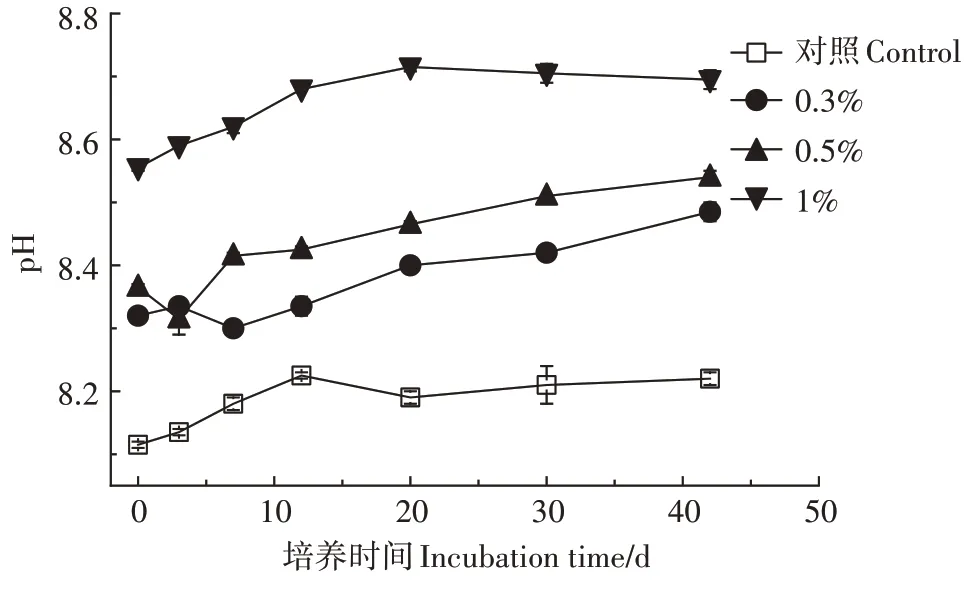
图7 不同处理培养期间土壤pH的变化Figure 7 Changes of soil pH during incubation with different treatments
2.3.2 添加量对CaCl提取态Cd的影响
如图8所示,随着HAP/FeO添加量的增加,土壤中CaCl提取态Cd含量逐渐降低。添加量为0.5%的处理CaCl提取态Cd含量显著低于对照组,从初始的2.50 mg·kg降低到0.96 mg·kg,降幅达62%,但进一步增加添加量后CaCl提取态Cd含量未再显著降低。CaCl提取态Cd含量的降低可能是因为与HAP/FeO丰富的羟基官能团发生络合反应,形成稳定的磷酸盐络合物从而固定了土壤活性Cd,或与CaSO和Ca(PO)(OH)中的晶体Ca进行了离子交换。
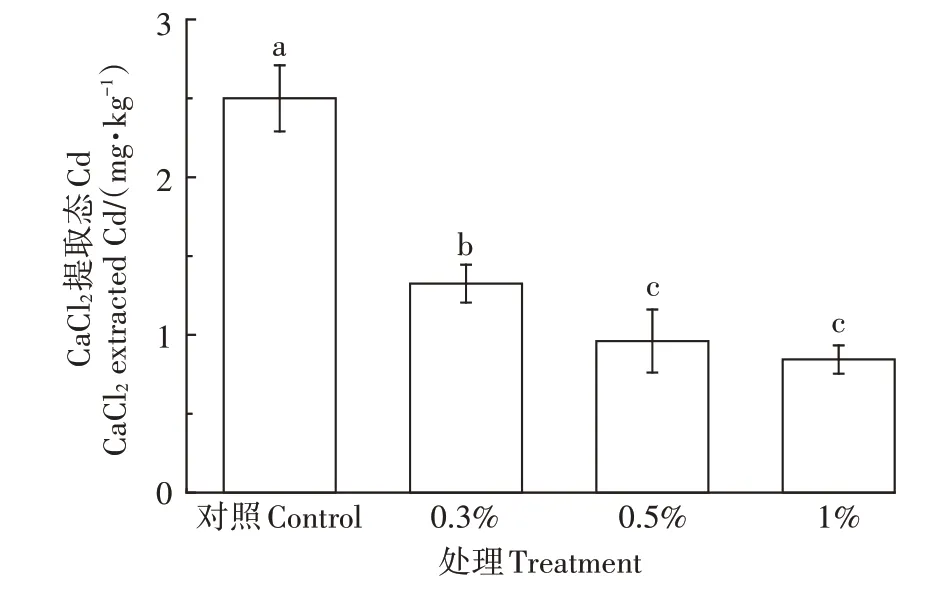
图8 不同处理培养42 d后CaCl2提取态Cd含量Figure 8 Content of CaCl2extracted Cd after 42 d incubation with different treatments
2.3.3 培养时间对各形态Cd含量占比的影响
弱酸可提取部分代表最容易被利用的形态,可还原和可氧化部分代表具有潜在有效性的形态,而残渣部分代表可利用性较差的形态。从图9可知,随着HAP/FeO添加量和培养时间的延长,土壤活性较低的残渣态含量比例明显增加,活性较高的弱酸可提取态含量比例降低,土壤重金属Cd钝化程度逐渐增高。与对照组相比,添加量为1.0%的处理培养20 d和42 d后残渣态含量比例从5.03%分别增加到9.56%、15.72%,弱酸可提取态含量比例从51.21%分别降低到45.67%、40.18%。有研究证明,磷酸盐类固定剂固定重金属的主要机理是磷酸盐与二价重金属形成溶解度很低的类似磷氯铅矿的矿物,这些矿物在环境中相当稳定。
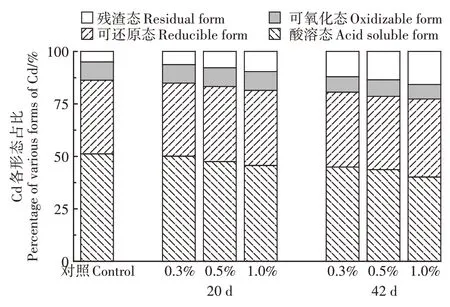
图9 培养20 d和42 d时不同处理Cd形态占比Figure 9 Cd morphology after 20 d and 42 d incubation with different treatments
2.3.4 培养土壤中重金属的浸出性
如图10所示,随着HAP/FeO投加量的增加,各浸出液中Cd的浓度均有不同程度的降低。长期酸雨暴露的土壤浸出液Cd浓度从0.138 mg·L降低到0.029 mg·L,降幅达78.99%,短期酸雨暴露的土壤从0.068 mg·L降低到0.024 mg·L,降幅为64.71%。实验结果说明HAP/FeO可有效阻碍土壤重金属的淋溶,保持土壤重金属在酸雨条件下的稳定性。
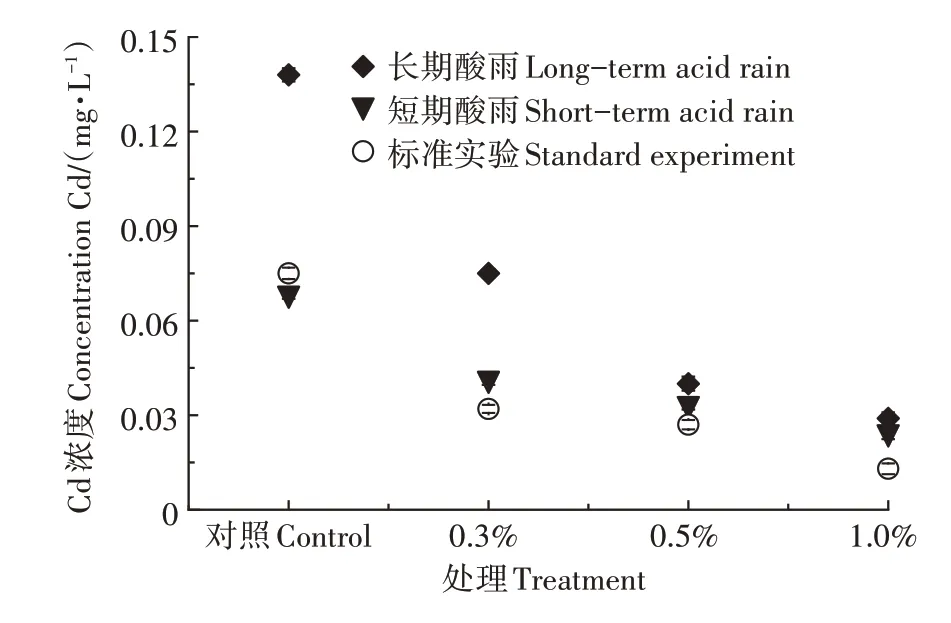
图10 培养土壤浸出液中Cd浓度Figure 10 Cd concentration in the leaching solution of incubated soil
3 结论
(1)以米糠为原料采用水热法合成了羟基磷灰石/四氧化三铁(HAP/FeO)纳米材料,制备过程简单,原料价格低廉,对重金属Cd有很强的去除能力。
(2)HAP/FeO对Cd的去除符合伪二阶动力学模型,说明吸附过程以化学吸附为主。随着溶液pH的增加,HAP/FeO对Cd的吸附能力也逐渐增强,pH为8时吸附量达到242.24 mg·g。
(3)HAP/FeO添加量为0.5%的处理显著降低了土壤CaCl提取态Cd含量,降幅达62%;添加HAP/FeO可降低弱酸可提取态Cd含量,增加残渣态Cd含量,Cd与磷酸盐形成了稳定的矿物,土壤Cd钝化程度变高。
(4)HAP/FeO可以有效降低污染土壤浸出液中Cd浓度,从而降低Cd淋溶到地下水的环境风险。

