阿特拉津在太平洋牡蛎体内的蓄积、分布与消除
郑旭颖,孙晓杰*,郭萌萌,邢丽红,李风铃,彭吉星,朱盼盼3,李兆新*
(1.农业农村部水产品质量安全检测与评价重点实验室,中国水产科学研究院黄海水产研究所,山东 青岛 266071;2.上海海洋大学食品学院,上海 201306;3.青岛大学生命科学学院,山东 青岛 266071)
阿特拉津,又名莠去津,化学名为2-氯-4-乙胺基-6-异丙胺基-1,3,5-三嗪,分子式为CHClN,由于其杀草谱较广,且成本低、效率高,是三嗪类除草剂中应用最广泛的一种。因其具有肝脏、免疫、生殖、甚至潜在致癌性等多种毒性效应,对生态环境和人类健康均构成潜在威胁,已成为国际上持续关注的环境问题。
自2003年起,欧盟禁止使用阿特拉津,同时,阿特拉津也被美国环保署列为优先控制污染物名单。但加拿大、澳大利亚等一些国家仍有使用。在农业生产中每年使用约7~9万 t阿特拉津。目前,阿特拉津已在水体、土壤、生物和食物等不同物质中检出。根据急性中毒阈值,地表水中阿特拉津的浓度一般不被视为对生态有害,合理的无观测效应水平为20 μg/L。然而,环境中阿特拉津大部分通过降雨或灌溉进入地下水或地表径流,最终流至沿海水域。2017年8月29日—9月24日,Yang Liqiang等在中国黄海和渤海设置了64 个站点对阿特拉津等10 种三嗪类除草剂的分布及浓度进行了调查,发现渤海湾地区阿特拉津浓度明显高于黄海海域,最高浓度为2.50 nmol/L。有研究表明,阿特拉津对鱼类具有一定急性毒性,并导致其生长率下降、行为改变、生化和血液学指标等改变。阿特拉津还对其他水生生物有害,如小龙虾、青蛙、双壳贝类等。
目前关于阿特拉津在水生生物中的生物富集和消除规律研究已有报道,陈家长等研究了鲫鱼多种组织对不同浓度阿特拉津的富集效应,结果表明,当暴露浓度相同时,鲫鱼不同组织器官对阿特拉津的富集能力表现为肝脏>肾脏>肌肉,且均在19 d对阿特拉津的富集达到稳态。王玮云等将菲律宾蛤仔分别暴露在质量浓度为1.0、10.0 μg/L和200 μg/L的阿特拉津海水中,发现菲律宾蛤仔中阿特拉津的最大富集系数分别为15.4、6.15和3.56,消除实验显示菲律宾蛤仔对阿特拉津具有快速消除能力。此外,在暴露相同阿特拉津质量浓度下,刺参最大富集系数分别为1.77、1.46和1.23,表明贝类对阿特拉津的富集能力远大于海参。
太平洋牡蛎()属滤食性双壳贝类,通过过滤海水获取浮游藻类作为食物。因其生长周期短、活动范围小,可作为监测海洋污染状况的生物标志物。同时,我国是世界上最大的贝类养殖和出口国家,太平洋牡蛎是国内重要的养殖经济贝类,而有关阿特拉津在太平洋牡蛎体内的富集和消除效应鲜见报道,阿特拉津在贝类各组织中的富集残留动态仍缺乏研究。因此,本研究以太平洋牡蛎为实验生物,研究阿特拉津在太平洋牡蛎闭壳肌、内脏、鳃、外套膜和性腺各组织中的蓄积、分布及消除动态,通过统计分析计算生物富集系数(bioconcentration factor,BCF),更准确地反映各参数影响,以期为深入研究阿特拉津对水生生物的危害程度和作用机理提供基础性资料,为研究阿特拉津在贝类各组织中富集分布及代谢途径提供参考,同时也为双壳贝类食品安全风险评估和海洋生态环境保护提供理论依据。
1 材料与方法
1.1 材料与试剂
实验用太平洋牡蛎取自青岛胶南贝类养殖基地,选取体长12~15 cm、健康均一的1.5~2 龄牡蛎。实验前将太平洋牡蛎在实验条件下((20f5)℃)暂养1 周,每天更换1 次水,定时投喂螺旋藻粉1 次,日投饵量约为30 mg/(天·只),期间连续充氧。驯养期间及时清除状态不佳和死亡个体,选择活动性强的健康太平洋牡蛎进行实验。
实验海水取自青岛近海的黄海海域,水温(18f2)℃,盐度25‰~30‰,溶解氧6.5~7.0 mg/L,pH 7.8~8.5,实验用水符合GB 11607ü1989《渔业水质标准》。
阿特拉津标准品、-阿特拉津皆(纯度>96%)德国Dr.Ehrenstorfer GmbH公司;乙腈、水(均为质谱级)德国Merck公司;甲酸(HPLC级) 美国Sigma公司;其他未作特殊说明的试剂均为分析纯。
1.2 仪器与设备
QTRAP 5500三重四极杆复合线性离子阱质谱仪美国AB Sciex公司;XW-80A旋涡混合器 上海医大仪器厂;Himac CR 22GII高速离心机 日本Hitachi公司;N-EVAP 112氮吹仪 美国Organomation公司。
1.3 方法
1.3.1 暴露实验设计
分别设置10 μg/L和100 μg/L 2 个质量浓度的暴露实验组和1 个空白对照组,其中暴露阶段为15 d,代谢消除阶段为14 d。每个实验水箱(80 L)内注入新鲜海水40 L,加入适量的阿特拉津储备液(二甲基亚砜溶解),使水体中的阿特拉津最终质量浓度分别为0、10 μg/L和100 μg/L,命名为空白对照组、实验组1和实验组2。各放入经暂养的健康太平洋牡蛎110 只。采用半静态水质接触染毒法,每24 h更换一半含相同质量浓度阿特拉津的海水,并投喂一次螺旋藻粉。分别在暴露实验开始后的第6、12小时以及第1、2、3、5、7、10、15天取样,每个时间点从各水箱内随机取出太平洋牡蛎样品6 只,2 只为一个样本,分成3 个平行样本,迅速解剖分离为闭壳肌、内脏、鳃、外套膜和性腺5 个组织,并于-80 ℃冷冻密封保存。暴露实验结束后进行太平洋牡蛎体内阿特拉津的消除实验,把所有实验水箱换成清洁海水,分别在换水结束后的第1、2、3、5、7、10、14天进行取样,取样方法和保存条件与暴露阶段一致。实验过程中及时捞出死亡的太平洋牡蛎个体。为研究阿特拉津分别在环境及太平洋牡蛎体内的消除过程,设置空白海水中添加100 μg/L阿特拉津的实验组S,与上述实验组2进行对照。
1.3.2 样品预处理
太平洋牡蛎组织样品及粪便:分别准确称取2 g样品于15 mL离心管中,加入50 μL内标溶液(1 μg/mL),5 mL 80%乙腈溶液,涡旋混匀,超声提取2 min,4 500 r/min离心5 min,取上清液;剩余残渣加入5 mL 80%乙腈溶液重复提取1 次,合并2 次上清液。上清液中加入5 g无水硫酸钠,涡旋混匀,4 500 r/min离心5 min,取上清液于40 ℃氮气吹干,用1 mL初始流动相复溶,15 000 r/min离心10 min,过0.22 μm滤膜,待测。
空白海水样品:采用HLB固相萃取柱富集净化(使用前依次用3 mL甲醇和3 mL水活化),取10 mL水样,加入50 μL内标溶液(1 μg/mL),上柱富集,然后用3 mL的3%甲醇溶液淋洗,挤干后,6 mL甲醇洗脱,40 ℃氮气吹干,1 mL初始流动相复溶,涡旋溶解后过0.22 µm滤膜,待测。
暴露阿特拉津的海水样品:同样采用HLB固相萃取柱富集净化,如上述活化后,取5 mL水样,加入50 μL内标溶液(10 μg/mL),上柱富集,然后用3 mL的3%甲醇溶液淋洗,6 mL甲醇洗脱,40 ℃氮气吹干,10 mL初始流动相复溶后,取1 mL过0.22 µm滤膜,待测。
1.3.3 仪器分析
液相色谱条件:C色谱柱(150 mmh2.1 mm,2.6 µm);流动相:A为0.1%甲酸溶液,B为乙腈;柱温40 ℃;进样量10.0 μL;流速0.25 mL/min;洗脱方式:梯度洗脱,梯度洗脱程序见表1。
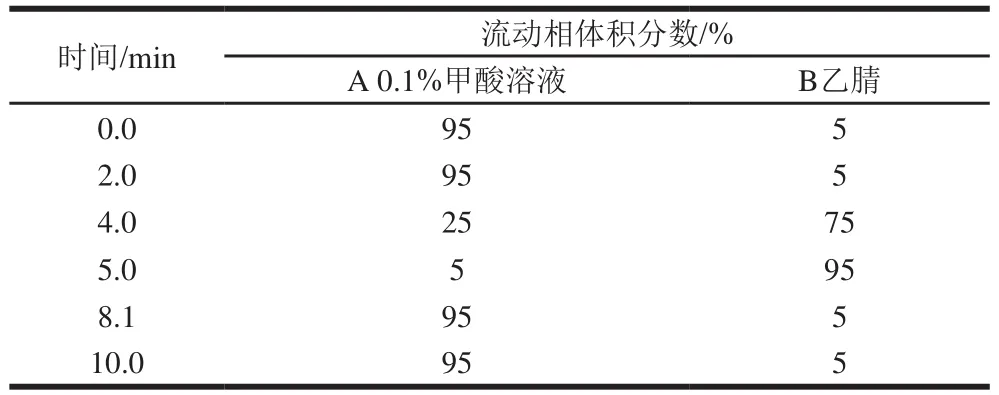
表1 梯度洗脱程序Table 1 Gradient elution procedure
质谱条件:电喷雾离子源;多反应监测,正离子模式;喷雾电压2.8 kV;离子源温度320 ℃;阿特拉津的定性离子对为/216.1/174.0,定量离子对为/216.1/132,碰撞能分别为18 eV和23 eV。
1.3.4 质量控制
阿特拉津标准曲线的线性范围为1~200 µg/mL,相关系数()在0.995以上;太平洋牡蛎样品检出限为0.1 μg/kg(>3),选3 个不同含量的空白太平洋牡蛎加标实验(0.5、5.0 μg/kg和10 μg/kg,=6),回收率均在70.0%~120%之间;海水样品检出限为5.0 ng/L(>3),加标回收率在70.0%~120%之间(加标量分别为20、100 ng/L和200 ng/L,=6)。
1.4 数据处理
数据分析参考Paterson和崔文杰等的方法。采用Origin 8.5.1非线性拟合方法,将净化实验数据拟合到一阶衰减模型中,按式(1)、(2)计算净化速率常数和消除半衰期:

式中:C为时太平洋牡蛎组织中阿特拉津的含量/(ng/g);C为净化实验开始时阿特拉津的含量/(ng/g);为时间/d;为消除速率常数/d;为消除半衰期/d。
通过将净化期间计算出的净化速率常数代入一阶生物累积模型,按式(3)计算吸收速率常数():

式中:为海水中阿特拉津的质量浓度/(µg/L);为吸收速率常数/(mL/(g·d))。
BCF按式(4)、(5)计算:

式中:C为时生物组织中化合物的含量/(ng/g);为化合物溶解在水中的质量浓度/(µg/L)。
太平洋牡蛎组织及粪便中阿特拉津含量以湿质量计,海水中阿特拉津含量以体积计。
2 结果与分析
2.1 阿特拉津在太平洋牡蛎体内的分布特征
如图1所示,太平洋牡蛎不同组织对阿特拉津的生物富集具有一定差异。富集实验结束后,10 μg/L暴露质量浓度下太平洋牡蛎各组织中阿特拉津含量峰值排序为鳃>内脏>性腺>外套膜>闭壳肌。其中鳃内阿特拉津的峰值为(44.01f0.89)ng/g,约为暴露质量浓度的4.4 倍,明显高于其他组织;内脏和性腺中阿特拉津的峰值接近,约为暴露浓度的3.5 倍左右;外套膜和闭壳肌中阿特拉津的峰值约为暴露浓度的2.8 倍;鳃、内脏、性腺和外套膜富集达到最大值所需时间接近,在富集2~3 d达到峰值,随后阿特拉津质量浓度持续下降;闭壳肌组织中阿特拉津质量浓度在富集结束后达到最大值。在100 μg/L暴露质量浓度下太平洋牡蛎各组织中阿特拉津含量峰值排序为鳃>内脏>外套膜>性腺>闭壳肌。与10 μg/L暴露质量浓度下结果相同的是鳃中阿特拉津的峰值明显高于其他组织,为(323.24f8.34)ng/g,约为暴露质量浓度的3.2 倍,富集达到最大值所需时间为5 d;闭壳肌中阿特拉津的峰值最低。在不同暴露质量浓度下,太平洋牡蛎的鳃是阿特拉津含量最高的组织,其次是内脏。
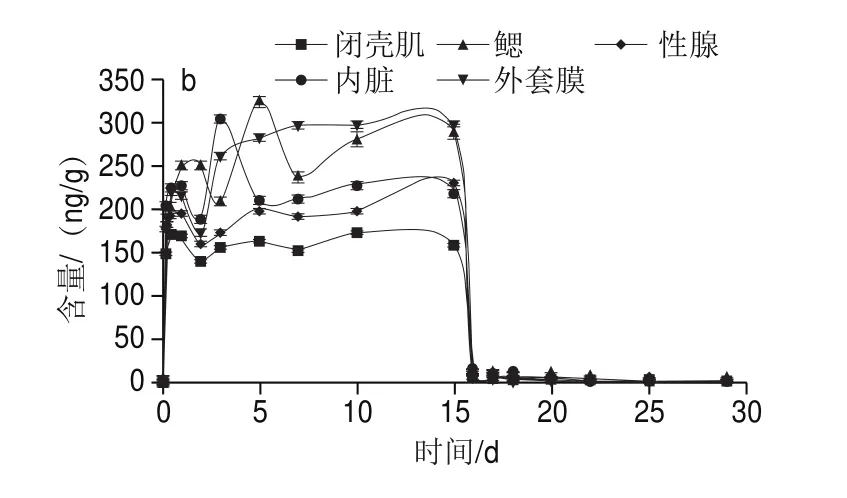
图1 不同暴露质量浓度下太平洋牡蛎各组织中阿特拉津含量变化Fig.1 Changes in atrazine contents in tissues of C.gigas at different exposure concentrations
有研究表明,许多污染物主要由鳃吸收,它们可能是环境中有毒物质的最初迹象。鳃作为环境中污染物的主要入口,因此其富集阿特拉津质量浓度最高。这与Dos Santos等研究结果相似:相对于消化腺,蛤蜊的鳃对阿特拉津的作用更敏感。内脏团由多个结构组成,如消化系统、心包(包围心脏,是穿过心室终肠的一部分)、排泄系统(肾脏有一对导管)、神经系统(由3 对神经节细胞和一对大脑踏板连接物形成)和生殖系统。其中生殖系统由生殖腺组成,具有高浓度的脂质,能够生物浓缩有机污染物。因此,内脏团被认为是通过胃肠道摄取阿特拉津。阿特拉津通过鳃的渗透进入贝类体内,最后在内脏团中存储。因此,阿特拉津在鳃中的生物累积可以在短期内反映污染情况,而在内脏团中的生物累积可能表明阿特拉津接触时间更长。
此外,外套膜和性腺的富集作用强于闭壳肌,阿特拉津在闭壳肌组织中的质量浓度最低。根据这些数据,可以推断闭壳肌组织不是阿特拉津暴露的靶组织,阿特拉津在闭壳肌组织中的毒性较弱。这与多个研究结果吻合:双壳贝类外套膜和性腺对重金属、有机污染物的富集作用强于闭壳肌。
2.2 太平洋牡蛎体内阿特拉津的富集与消除
2.2.1 太平洋牡蛎对阿特拉津的富集和消除规律
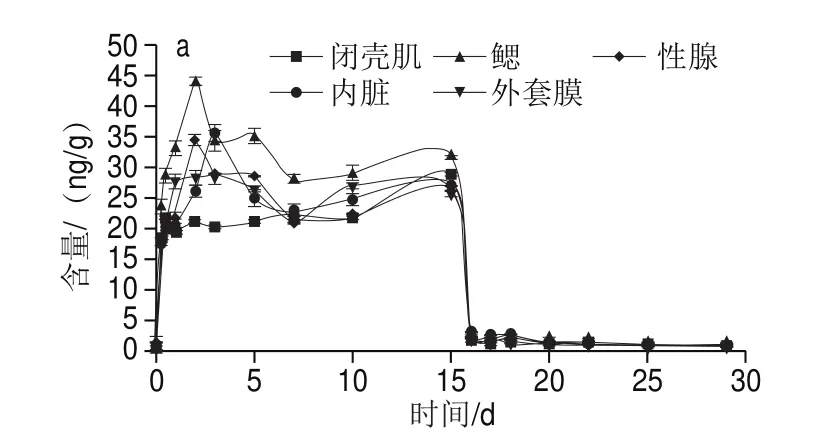
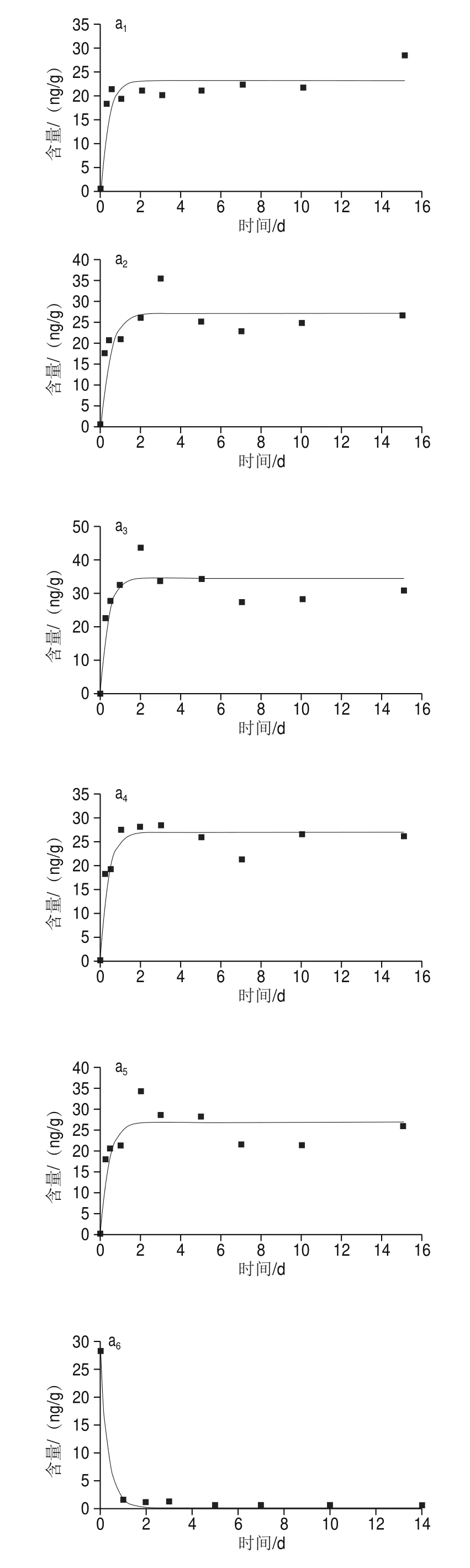
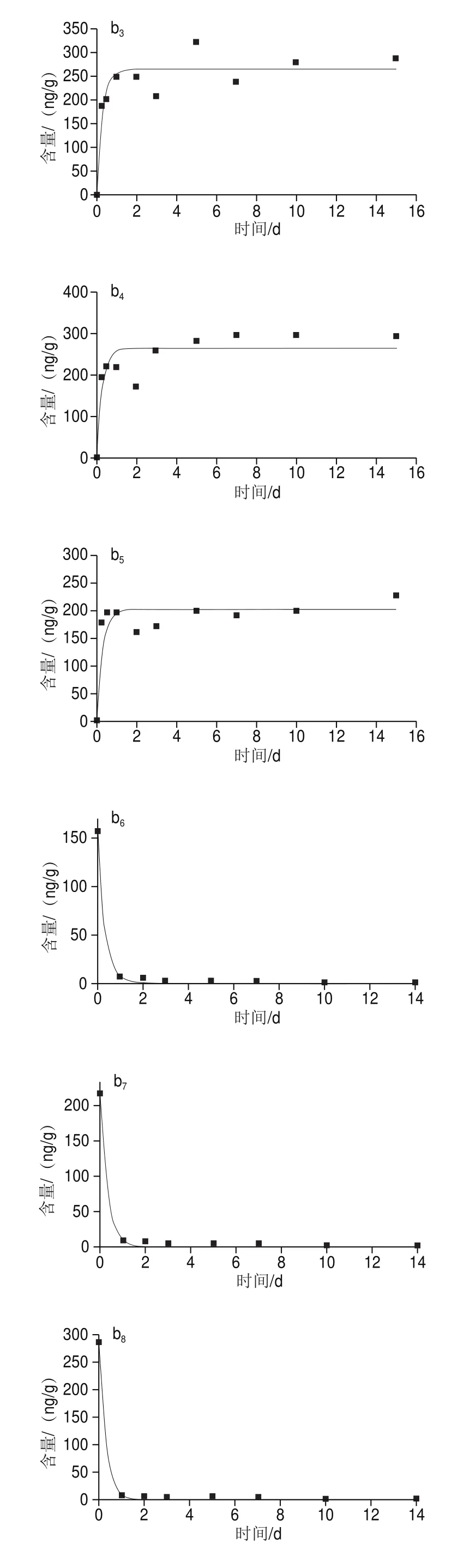
由图2可知,在10 μg/L和100 μg/L两个暴露质量浓度下,太平洋牡蛎对阿特拉津的富集变化趋势相同,均表现为先升高后下降至某一水平上下波动。

图2 阿特拉津在太平洋牡蛎不同组织中的富集与消除过程Fig.2 Accumulation and elimination of atrazine in different tissues of C.gigas
在富集阶段,实验组太平洋牡蛎中阿特拉津的含量极显著高于空白组(<0.01)。如图2所示,太平洋牡蛎各组织中阿特拉津含量均在暴露3~7 d后达到平衡态,中、后期太平洋牡蛎对阿特拉津的吸收逐渐放缓,趋于平衡。在10 µg/L和100 µg/L质量浓度暴露15 d后,闭壳肌中阿特拉津的含量分别为(28.41f0.46)ng/g和(159.13f1.79)ng/g;内脏中阿特拉津的含量分别为(26.48f1.59)ng/g和(218.88f5.97)ng/g;鳃中阿特拉津的含量分别为(31.55f0.78)ng/g和(287.04f7.65)ng/g;外套膜中阿特拉津的含量分别为(26.15f1.11)ng/g和(293.71f5.57)ng/g;性腺中阿特拉津的含量分别为(26.06f1.01)ng/g和(227.49f4.02)ng/g。阿特拉津在太平洋牡蛎体内迅速蓄积,蓄积与暴露质量浓度及组织差异有关。暴露实验结束后鳃中阿特拉津含量最高。
在净化阶段前期,太平洋牡蛎各组织阿特拉津含量急剧下降,呈线性下降方式。10 µg/L和100 µg/L暴露浓度组净化1 d后,太平洋牡蛎各组织净化率分别为90.1%~94.4%和95.4%~97.1%。其中闭壳肌中阿特拉津的含量分别为(1.58f0.18) ng/g和(7.38f1.27) ng/g;内脏中阿特拉津的含量分别为(2.62f0.16)ng/g和(9.98f1.06)ng/g;鳃中阿特拉津的含量分别为(1.98f0.12)ng/g和(9.46f1.17)ng/g;外套膜中阿特拉津的含量分别为(1.93f0.06)ng/g和(8.51f1.16)ng/g;性腺中阿特拉津的含量分别为(2.10f0.08)ng/g和(8.81f1.11)ng/g。显然,暴露质量浓度较高的实验组,净化效果更明显。随着净化时间的延长,太平洋牡蛎体内阿特拉津质量浓度释放速度减慢。净化14 d后,2 组暴露质量浓度下太平洋牡蛎各组织中阿特拉津的含量均趋于空白组水平,说明太平洋牡蛎对阿特拉津的清除率较高。
2.2.2 太平洋牡蛎对阿特拉津的富集和消除参数
太平洋牡蛎不同组织对阿特拉津的吸收和净化符合一阶动力学模型,采用非线性拟合的统计方法分析太平洋牡蛎对阿特拉津的富集和消除参数(图3),各组拟合曲线判定系数范围为0.700~0.999,说明拟合程度良好。通过非线性曲线拟合得到消除速率常数()、吸收速率常数()、半衰期()和BCF如表2所示。数据显示,太平洋牡蛎的值随暴露质量浓度增加而增大,而BCF值随暴露质量浓度的增加而减小,在太平洋牡蛎各组织中都表现出相同的趋势。如Paterson等报道,BCF有2 种计算方式,一种是生物组织中化合物的浓度和溶解在水中的浓度之比(式(5));另一种是生物对化合物的吸收速率常数与生物体内化合物净化速率常数之比(式(4))。通过动力学模型的统计分析能更准确的反映各参数影响,因此本研究采用第2种计算方式:吸收速率常数与净化速率常数计算BCF。BCF是描述化学物质在生物体内累积趋势的重要指标,可以显示环境污染的风险。结果显示,BCF随暴露质量浓度的增加而减小,说明在低质量浓度条件下太平洋牡蛎更容易对阿特拉津产生富集作用,这一现象在无齿蚌及河蚬中均有发现。然而,本研究与徐英江等报道对比发现,相同暴露质量浓度下(10 μg/L)刺参对阿特拉津的最大富集系数为1.46,太平洋牡蛎对阿特拉津的富集系数明显高于刺参,这说明不同水生动物对阿特拉津的富集能力存在着较大区别,这一差异可能与摄食方式有关。太平洋牡蛎为滤食性双壳贝类,通过直接滤食海水中的浮游藻类为食。而浮游藻类的大表面积、特殊胞外组分及细胞形态,使得其对阿特拉津具有很高的富集能力。通过食物链的传递,太平洋牡蛎可快速富集阿特拉津。同时,由于双壳贝类的血液循环是开放的血管系统(相对于鱼类的封闭循环系统),与外来物质的接触较为充分,因此会快速形成峰值。还有报道称,阿特拉津的生物累积潜力还取决于其亲脂性、生命阶段和在生物体内的代谢过程。
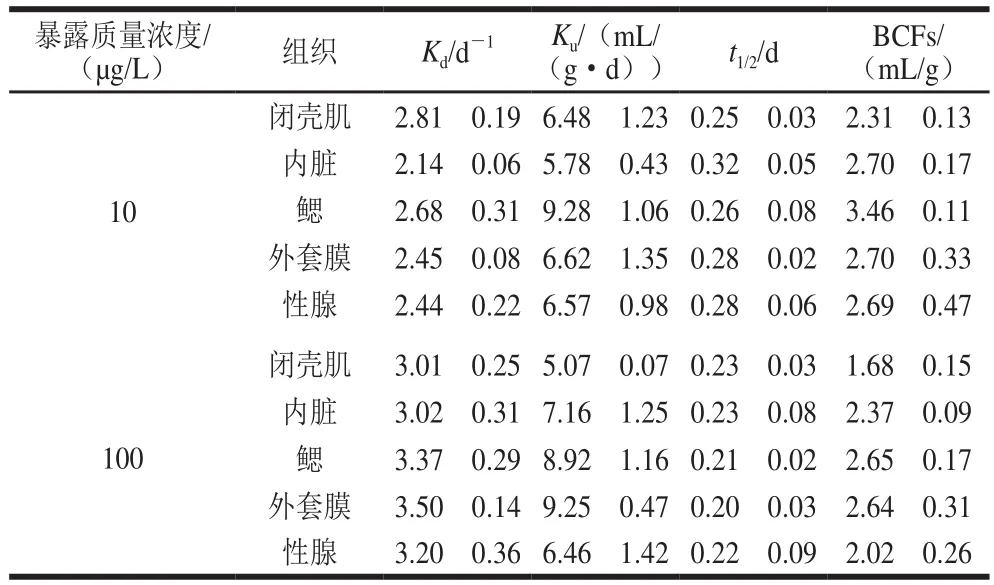
表2 阿特拉津在太平洋牡蛎不同组织中的Ku、Kd、t1/2与BCFs值Table 2 Ku, Kd, t1/2 and BCFs of atrazine in different tissues of C.gigas

图3 太平洋牡蛎在阿特拉津暴露下富集和消除的拟合模型图Fig.3 Fitted curves for atrazine accumulation and elimination in C.gigas at different exposure concentrations
净化实验数据表明,太平洋牡蛎各组织中阿特拉津含量在净化阶段急剧下降,太平洋牡蛎转移到洁净海水中后,对阿特拉津的代谢效率远高于富集效率,导致阿特拉津含量的断崖式下降。及显示,相对于低暴露质量浓度,在高暴露质量浓度下太平洋牡蛎对阿特拉津的消除效率更高,排出速率更快。脱离暴露环境后太平洋牡蛎中阿特拉津的含量迅速降至暴露质量浓度下。消除能力不仅与阿特拉津暴露质量浓度有关,同时因生物因素而异,如双壳贝类物种、健康状况、过滤率和排泄率,以及其他非生物因素,如水温、净化时间等。此外,动力学参数显示,在不同暴露质量浓度下,鳃和外套膜的消除速率常数较高,说明净化过程养殖海水样品中阿特拉津来源途径主要是鳃的滤食与呼吸作用或外套膜与海水的大面积接触。鳃是可渗透的器官,用于吸收或调节离子,吸收溶解氧或释放二氧化碳和氨,并在一定程度上允许其他物质通过。鳃除了是呼吸器官,同时也是重要的排泄器官。

2.3 太平洋牡蛎体内阿特拉津的消除途径
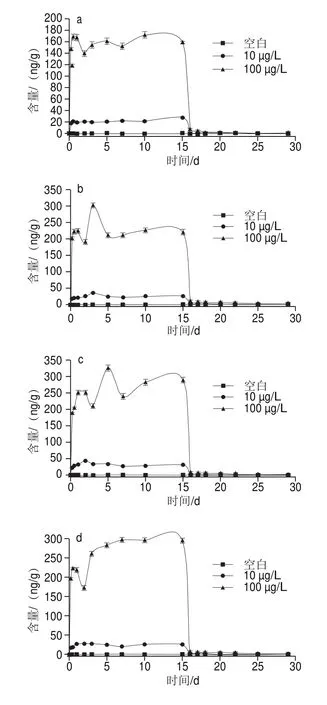
针对实验组S(未养殖太平洋牡蛎的暴露海水组)和实验组2(暴露阿特拉津的太平洋牡蛎组)海水中阿特拉津含量进行比较(图4),0~15 d内含量变化较小,说明海水中暴露的阿特拉津较为稳定,主要以原药形式存在。而太平洋牡蛎在暴露阿特拉津阶段,实验组S的海水中阿特拉津含量均高于实验组2中的含量,推测实验组2海水中部分阿特拉津已被太平洋牡蛎吸收或转化,其阿特拉津含量在5~15 d趋于稳定,与组织中含量稳定的时间段一致,表明5 d后阿特拉津含量在太平洋牡蛎体内已达到平衡。结合图2和图4b发现,净化消除14 d后太平洋牡蛎体内阿特拉津含量低于日本对水产品(鱼)的最高残留限量标准0.01 mg/kg,消除率大于90%,并仍继续通过呼吸、滤食和粪便等排出体外。表明太平洋牡蛎吸收阿特拉津后将有多种转化途径:通过鳃的呼吸和滤食等转移到养殖海水中、蓄积到体内各组织,以及通过粪便排出体外等。而阿特拉津在净化海水中的质量浓度远高于其在粪便中,说明主要消除途径可能为鳃的接触过滤作用。
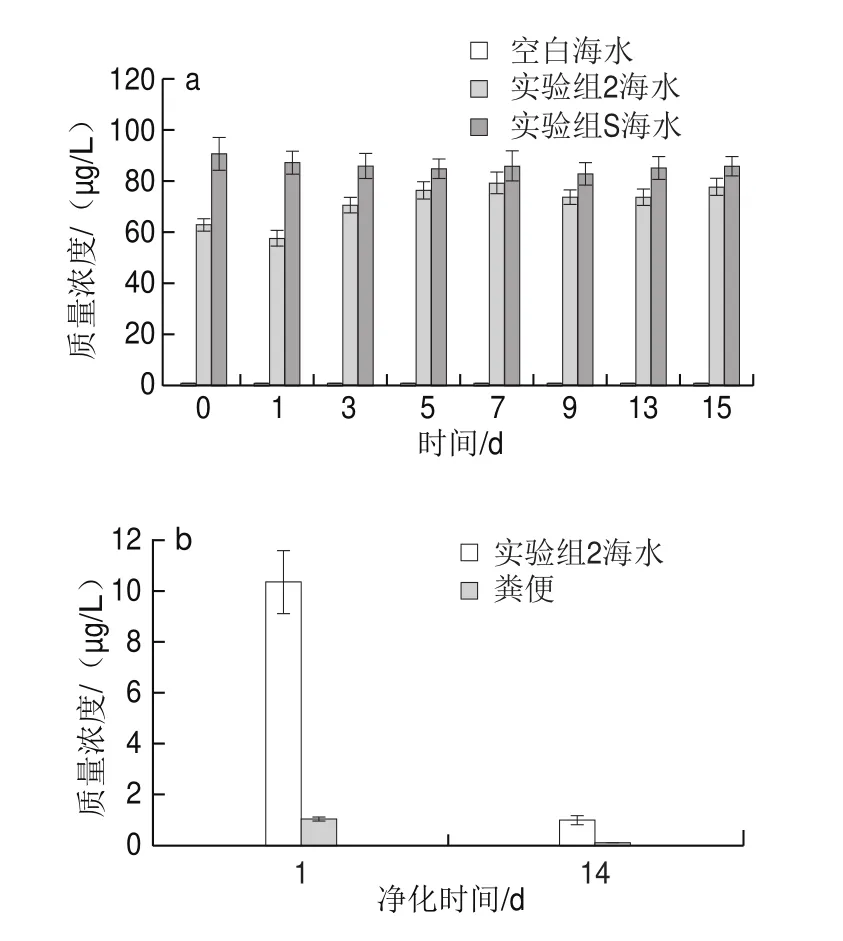
图4 空白水样与暴露水样(a)及太平洋牡蛎粪便(b)中阿特拉津含量的变化比较Fig.4 Comparison of atrazine contents in blank water samples,exposed water samples (a) and feces (b) of C.gigas
3 结 论
研究结果表明,阿特拉津在太平洋牡蛎中的生物富集具有明显的组织差异性,内脏团和鳃的富集能力大于外套膜、性腺和闭壳肌,其中闭壳肌中含量最低,内脏团为其主要的蓄积靶组织。阿特拉津在太平洋牡蛎体内的生物富集能力与环境浓度相关,浓度越低富集能力越强。在净化阶段,太平洋牡蛎中阿特拉津的含量随净化时间呈指数下降,且暴露质量浓度越高,太平洋牡蛎对阿特拉津的排出速率越快,主要消除途径可能为鳃的接触过滤作用。尽管太平洋牡蛎对阿特拉津的消除能力较强,然而各种风险调查显示,环境中持续的阿特拉津污染问题较为严峻,由此产生的生态和食品安全风险仍需引起重视。

