肌肉高温与线粒体生物合成:TRPV1的可能作用及机制
许毅枭 赵永才 李梦影 高炳宏
1 上海体育学院运动健康学院(上海 200438)
2 天津体育学院社会体育与健康科学学院(天津 3016173)
3 上海体育学院竞技运动学院(上海 200438)
热环境对有氧运动能力有明显影响。研究表明,热环境下长时间运动会导致热应激,对有氧运动能力有不利影响[1],热应激是由环境条件(即温度、湿度、太阳辐射)和代谢产热相互作用引起生理压力的增加,表现为核心温度、皮肤温度升高,心血管压力增加,并导致有氧运动能力下降[2]。而长期在热环境下运动能够诱导热适应,改善有氧运动能力。热适应是指反复暴露于热环境下诱导身体发生适应性的变化,减轻生理压力,表现为运动期间更低的核心温度和心率、更高的出汗率、热感知程度的改善等,从而改善有氧运动能力[3]。
每个恒温动物都有一个温度调节范围,称为热中性区[3]。人体在热中性区的产热和散热保持动态平衡[4]。热环境下长时间运动骨骼肌温度可超过40℃,甚至达到42℃[5]。温度会直接或间接影响生物的各种生命活动,而肌肉温度过高会影响线粒体功能[6]。线粒体约占哺乳动物骨骼肌肌纤维体积的10%~15%,也是氧代谢的主要场所,通过氧化磷酸化(oxidative phosphorylation,OXPHOS)产生能量,约占细胞耗氧量的85%~90%[7]。因此骨骼肌线粒体是运动过程中主要供能的细胞器,对于有氧运动能力非常重要。线粒体生物合成是通过原有线粒体的分裂和复制增加线粒体数量,改善线粒体功能[8]。研究表明,轻度热应激能诱导40℃的肌肉高温,并通过AMP 激活的蛋白激酶(AMP-activated protein kinase,AMPK)-NAD 依赖性脱乙酰酶沉默调节蛋白1(NAD-dependent deacetylase sirtuin-1,SIRT1)-过氧化物酶体增殖物激活受体γ共激活因子1α (peroxisome proliferator-activated receptor-γ coactivator-1α,PGC-1α)信号轴诱导线粒体生物合成[9],表明热环境和运动诱导的肌肉高温能够促进线粒体生物合成,进而影响线粒体功能。
瞬时受体电位香草酸亚型1(transient receptor potential vanilloid 1,TRPV1)是六次跨膜的结构蛋白,可以被高温(≥40°C)、辣椒素等激活[10]。TRPV1 已被证明存在于骨骼肌细胞中[11]。Lotteau 等[12]利用45℃的高温激活小鼠骨骼肌细胞TRPV1,发现激活的TRPV1释放Ca2+,使细胞内Ca2+水平提高。而热环境下运动引起肌肉高温能否激活TRPV1,激活的TRPV1 能否调节线粒体生物合成等问题有待进一步研究。
相关研究报道了肌肉高温对TRPV1通道的影响以及TRPV1对线粒体生物合成的影响。热应激对有氧运动能力有不利影响,而长期热环境下训练能扭转有氧运动能力的下降。这种现象可能与热环境下运动诱导的肌肉高温影响线粒体生物合成有关,其中TRPV1 可能是介导肌肉高温影响线粒体生物合成的关键因子。热环境下运动诱导的肌肉高温能否通过激活TRPV1调节线粒体生物合成有待阐明。因此,本文的目的是探讨TRPV1在肌肉高温影响线粒体生物合成中的可能作用及机制,为理解高温与有氧运动能力的关系提供新思路和理论依据。
1 高温与线粒体生物合成
线粒体是产生能量、清除随三磷酸腺苷(adenosine triphosphate,ATP)产生的活性氧(reactive oxygen species,ROS)、缓冲细胞质Ca2+过载和诱导细胞凋亡等具备重要功能的细胞器,在应对运动压力时会通过增加线粒体生物合成以提高能量生产效率,以满足肌肉收缩的需求。线粒体生物合成的增加可以提高线粒体功能。线粒体生物合成需要线粒体DNA 复制和转录,以及蛋白质合成和转运到线粒体中,由于氧化磷酸化系统位于线粒体内膜,线粒体生物合成的生理意义在于氧化磷酸化的增强,最终提高生成ATP的效率[13]。
1.1 肌肉高温促进线粒体生物合成
人体安静状态下的肌肉温度在35°C~36°C 范围内,热环境下长时间运动会导致肌肉温度超过40℃,甚至达到42℃[5]。运动中积累的热量并非仅仅是机体代谢增加的副产品,更代表一种与运动相关的压力,可能激发有益的细胞适应。因此肌肉高温是细胞的一种压力来源,线粒体功能也受到肌肉高温的影响。Zoladz等[14]的研究表明,高温环境下耐力训练能使大鼠骨骼肌温度达到42℃,增强骨骼肌线粒体氧化能力。
反复诱导的肌肉高温能促进骨骼肌线粒体生物合成。Liu 等[9]每天用40℃的高温加热小鼠C2C12 肌管细胞,5天后发现C2C12 肌管细胞的AMPK活性上调,SIRT1表达增加,PGC-1α的表达也增加,从而促进线粒体生物合成。此研究证据也证实,40℃的肌肉高温能通过AMPK-SIRT1-PGC-1α通路诱导骨骼肌线粒体生物合成。另一项研究发现,反复诱导的肌肉高温能提高p38 MAPK 的磷酸化程度,促进线粒体生物合成。Tamura 等[15]将小鼠放置于40℃的热环境中,以25 m/min的速度运动30 min,持续干预3周后发现热环境下运动诱导的肌肉高温增加柠檬酸合成酶活性和p38 MAPK 的磷酸化程度,促进了小鼠骨骼肌线粒体生物合成,从而提高了有氧运动能力。此外,还有以人为研究对象的研究报道了肌肉高温对线粒体生物合成的影响。Hafen 等[16]以20名健康久坐成人(10男、10女)为研究对象,连续6 天、每天2 小时使用脉冲短波对股外侧肌进行加热,结果发现加热结束后肌肉温度升高至40℃,比对照组的肌肉温度高了3.9℃,AMPK的磷酸化程度和PGC-1α的表达增加,热休克蛋白70 和90 分别增加45%和38%,从而促进线粒体生物合成。人体和动物的研究证据表明反复诱导的肌肉高温能够促进骨骼肌线粒体生物合成。
1.2 肌肉高温与线粒体生物合成因子
肌肉高温能够通过调节PGC-1α影响线粒体生物合成相关基因的转录,长期反复诱导的肌肉高温能够促进PGC-1α的表达和线粒体生物合成,而一次急性诱导的肌肉高温可能减弱PGC-1α的表达,不利于线粒体生物合成。线粒体生物合成受转录、翻译和翻译后加工等几个步骤调控[17]。由于线粒体相关基因由细胞核DNA和线粒体DNA共同编码,细胞核和线粒体协调的基因转录对线粒体生物合成非常重要[18]。PGC-1α是线粒体生物合成和氧化代谢的主要调节因子,主要通过激活PGC-1α或增加PGC-1α的含量促进线粒体生物合成的基因转录[19]。激活的PGC-1α从细胞质位移到细胞核和线粒体,然后与转录因子过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma,PPARγ)、核呼吸因子1/2(nuclear respiratory factor 1/2,NRF1/2)、p53 和线粒体转录因子A(mitochondrial transcriptional factor A,TFAM)共同促进线粒体生物合成相关基因的转录。Yamaguchi 等[20]以41℃的高温环境培养人类骨骼肌C2C12 细胞,72 h后发现人类骨骼肌C2C12细胞PGC-1α的表达和PGC-1α mRNA的含量增加,线粒体生物合成增加。该研究表明,41℃的肌细胞环境温度能够通过促进PGC-1α的表达从而诱导线粒体生物合成。类似研究也表明,40°C 的环境连续培养5 天C2C12 细胞能够通过AMPKSIRT1-PGC-1α通路诱导骨骼肌线粒体生物合成[9]。而急性肌肉高温会减弱线粒体生物合成。11名男性运动员在33°C、60%相对湿度的环境下以60%的最大输出功率骑自行车60 min,结果发现PGC-1α和PGC-1α mRNA 的表达减弱,抑制了线粒体生物合成[21]。因此,长期持续诱导肌肉高温能够通过促进PGC-1α的表达提高线粒体生物合成,而急性诱导的肌肉高温可能减弱PGC-1α的表达,抑制线粒体生物合成。
PGC-1α的表达是由各种上游信号分子激活引起的,主要包括AMPK、p38 增殖蛋白激酶(p38 mitogenactivated protein kinase,p38 MAPK)、钙/钙调素依赖性蛋白激酶Ⅱ(Ca2+/calmodulin-dependent protein kinase Ⅱ,CaMKⅡ)、哺乳动物/雷帕霉素复合物1(Mammalian/mechanistic target of rapamycin complex 1,mTORC1)等蛋白分子[22]。Tamura 等[15]研究了急性肌肉高温对AMPK 的影响,单次暴露于40℃的热环境以25 m/min 配速运动30 min 后,发现骨骼肌中AMPK 及其下游的乙酰辅酶 A 羧化酶的磷酸化状态降低,而p38 MAPK的磷酸化水平增加,对CaMKⅡ的磷酸化状态无明显影响。而也有研究发现急性肌肉高温会增强AMPK的活性。分离的大鼠骨骼肌细胞在42°C环境下培养10 min 和30 min,结果发现AMPK 活性增强,但没有影响CaMKⅡ的磷酸化状态[23]。以上研究表明,肌肉高温对AMPK 的影响尚无一致观点。由于AMPK 的活性不仅控制线粒体生物合成,而且还控制葡萄糖代谢、细胞周期和蛋白质代谢[24],了解肌肉高温与AMPK活性的关系也是未来重要的研究方向。
2 肌肉高温与TRPV1
2.1 TRPV1结构与定位
瞬时受体电位(transient receptor potential,TRP)是细胞内广泛感知物理和化学刺激的蛋白传感器,目前已发现哺乳动物有28个TRP通道[25]。所有的TRP通道有6个跨膜片段(S1~S6),其他两个部分N端和C段位于细胞内[26]。TRPV1 是TRP 家族中的1 个蛋白传感器,结构可分为3 个部分,包括位于细胞内的N 端和C端和6 个具有孔环区的跨膜片段(S1~S6),其孔环区域形成于S5 和S6 之间,并且是Ca2+通道[27]。TRPV1 的N端有14到18个锚蛋白重复序列,这些重复序列可能与感知机械刺激有关[28]。TRPV1的N 端包含钙调蛋白(calmodulin,CaM)和三磷酸腺苷(adenosine triphosphate,ATP)结合位点[28,29]。N 端的位点能够被蛋白激酶磷酸化,其中S116 是磷酸化位点,接头部分通过前螺旋段将N 端连接到跨膜区域,并将TPRV1 亚基连接在一起[28]。S116 位点是蛋白激酶 A(protein kinase A,PKA) 使TRPV1 脱 敏 的 磷 酸 化 位 点[30]。TRPV1 的C 端是蛋白激酶C(protein kinase C,PKC)和4,5-二磷酸磷脂酰肌醇(phosphatidylinositol-4,5-bisphosphate,PIP2)的结合位点,参与调节TRPV1 的活性[31]。TRPV1 的C 端作为Ca2+-CaM 结合位点参与TRPV1 脱敏[32]。此外,感知温度的区域也位于C 端[33]。TRPV1的S1~S6是每个TRPV1 亚基的6 个跨膜螺旋片段,其中S1~S4 是电压感应区域,S5~S6 是形成孔环区域[31]。S1~S4 连接到S5~S6,并作为连接段移动的基础有助于TRPV1 激活,跨膜区还包含辣椒素等配体的结合位点[28]。
TPRV1 于1997年通过在人胚胎肾细胞中克隆背根神经节表达的基因而被发现,对Ca2+具有高度渗透性[34]。TRPV1在中枢组织的脑干、中脑、下丘脑和边缘系统中高表达,在外周组织的心脏、脂肪和骨骼肌中广泛表达[35]。TRPV1 在不同组织之间的细胞内定位不同。TRPV1 定位在心肌细胞的肌浆网和线粒体外膜中[27,36]。Lotteau 等[12]用免疫荧光共定位的方法确定了TRPV1在小鼠骨骼肌细胞中的定位,发现TRPV1 定位在肌浆网而非肌膜,因此TRPV1 被激活后使Ca2+从肌浆网中释放至胞质中。骨骼肌的肌纤维通常分为糖酵解Ⅱ型(快肌纤维)和氧化Ⅰ型(慢肌纤维),慢肌纤维中TRPV1的含量比快肌纤维更多[37]。
2.2 肌肉高温激活TRPV1
TRPV1 对它所在的细胞环境温度非常敏感,有研究在小鼠骨骼肌中发现TRPV1 的激活阈值为≥40℃[38]。Ikegami 等[39]以雄性野生大鼠为研究对象,通过玻璃板将其肌肉温度加热至40℃,并结合电刺激诱导30秒/次的等长肌肉收缩,结果发现40℃的肌肉高温能够激活TRPV1,使细胞内Ca2+浓度升高,但随后的等长收缩又通过抑制TRPV1磷酸化水平降低了细胞内Ca2+浓度。此外,Lotteau 等[12]还从野生型雄性小鼠的趾短屈肌中分离出骨骼肌细胞,通过45℃的高温激活分离骨骼肌细胞中的TRPV1,发现胞质中Ca2+浓度增加。随后又用兰尼碱受体阻断剂来抑制兰尼碱受体(ryanodine receptor,RyR)释放Ca2+,发现激活的TRPV1能影响RyR Ca2+释放通道,进一步提高胞质中Ca2+浓度。该研究表明,肌肉高温激活TRPV1从肌浆网中释放Ca2+,TRPV1释放的Ca2+还有可能是激活RyR1的关键信号,从而进一步提高胞质中Ca2+水平。因此,40℃~45℃的肌肉高温能激活TRPV1,肌肉收缩类型会影响TRPV1的激活程度,等长收缩会抑制TRPV1磷酸化水平。
TRPV1 参与细胞环境温度检测,在体温调节中发挥重要作用[40]。研究证实TRPV1 的C 端及N 端的近端结构域是感知高温的重要组成部分[41,42]。Yonghak等[43]研究发现TRPV1 基因敲除小鼠的体温过高。而TRPV1 拮抗剂在全身给药后约1 小时内引起体温升高[44]。TRPV1 激动剂能够降低体温,可能导致体温过低,而TRPV1 拮抗剂可以导致体温过高[45]。因此,TRPV1能够调节体温,防止体温过度升高。
3 TRPV1与线粒体生物合成
TRPV1 被长期激活可能促进线粒体生物合成,而TRPV1 被急性激活可能抑制线粒体生物合成。Luo 等[37]以C57BL/6J 小鼠为研究对象,连续4 个月喂养0.01%辣椒素,结果发现辣椒素激活骨骼肌TRPV1 使Ca2+从肌浆网释放至胞质,上调PGC-1α表达来促进线粒体生物合成,提高有氧运动能力。该研究表明,骨骼肌细胞中TRPV1被长期激活后通过介导Ca2+浓度增加上调PGC-1α表达,促进线粒体生物合成,改善能量代谢和有氧运动能力。而另一项研究发现,TRPV1 激活抑制线粒体生物合成。Sun 等[46]以大鼠心脏组织来源的H9C2 心脏成肌细胞系为研究对象,使用辣椒素急性激活TRPV1后观察到ATP 合酶β的表达被抑制,线粒体膜电位去极化和ROS 过量产生,表明TRPV1被一次急性激活会抑制线粒体生物合成。
3.1 TRPV1被急性激活会抑制线粒体生物合成
TRPV1 被急性激活诱导细胞内Ca2+水平升高可导致线粒体Ca2+过载,产生过量的活性氧不利于线粒体生物合成。辣椒素急性激活TRPV1 抑制了ATP 合酶β的表达,并导致线粒体膜电位去极化和过量活性氧产生[46],表明TRPV1 被一次急性激活会抑制线粒体生物合成。TRPV1被急性激活会释放Ca2+,导致细胞内Ca2+浓度增加。细胞内Ca2+浓度升高会刺激ROS 的产生,且运动过程中ROS主要由骨骼肌线粒体产生[47]。骨骼肌线粒体产生过量的ROS 可导致线粒体蛋白、膜和DNA 氧化损伤,损害线粒体合成ATP 和调节代谢的能力[48]。骨骼肌线粒体内ROS产生的主要位点是电子传递链的复合物Ⅰ和Ⅲ,由于线粒体电子传递链复合物Ⅰ和Ⅲ的低效率导致电子泄露,从而产生ROS[49]。ROS是氧代谢的副产物,主要特征是最外层电子层包含未配对电子,具备非常高的活性[50],主要包括超氧阴离子(O2-)、过氧化氢(H2O2)和羟基自由基(-OH)等[51]。此外,线粒体Ca2+浓度的增加刺激线粒体一氧化氮合酶(nitric oxide synthase,NOS)产生更多的一氧化氮(nitric oxide,NO)。NO 可以与O2竞争细胞色素c 氧化酶上的结合位点,这会阻碍电子流动并减少线粒体O2消耗[52]。电子流动的障碍和局部O2的增加也会促进ROS的产生。另一方面,NO容易与超氧化物反应并生成过氧亚硝酸盐。过氧亚硝酸盐是一种活性强的ROS,可导致细胞色素c 释放、脂质过氧化等氧化损伤[53]。因此,TRPV1 被急性激活后释放Ca2+,使细胞内Ca2+浓度过载,不利于线粒体生物合成。
3.2 TRPV1被长期激活会促进线粒体生物合成
Ca2+是细胞内通用的信使,在细胞多种生理生化反应中起到重要调控作用[54]。研究表明,小鼠喂养4个月的辣椒素后,骨骼肌TRPV1 表达的增加使细胞内Ca2+浓度和PGC-1α的表达增加,从而促进线粒体生物合成,以改善有氧运动能力[37]。Ito 等[55]连续13 天给小鼠肌肉注射10 µM的辣椒素,结果发现TRPV1被激活后Ca2+从肌浆网释放至胞质,能够诱导骨骼肌线粒体生物合成。细胞内Ca2+浓度对线粒体生物合成非常重要,TRPV1通过调节细胞内Ca2+浓度促进线粒体生物合成。
TRPV1 被长期激活可能通过Ca2+-CaMKII-p38 MAPK-PGC-1α信号通路促进线粒体生物合成(图1)。Wei 等[56]用0.01% 辣椒素喂养小鼠16 周,激活的TRPV1上调了小鼠肾脏细胞PGC-1α的表达,促进线粒体生物合成,改善了肾小球线粒体功能。此项研究还表明,TRPV1 激活能提高AMPK 的活性。Luo 等[37]以C57BL/6J 野生型小鼠和TRPV1 敲除小鼠为研究对象,连续4 个月喂养0.01%辣椒素,结果发现骨骼肌中TRPV1 表达增加,肌浆中Ca2+浓度增加,从而促进PGC-1α的表达和骨骼肌线粒体生物合成增加。而在TRPV1 基因敲除小鼠中未观察到PGC-1α的表达和骨骼肌线粒体生物合成增加。因此骨骼肌细胞TRPV1被长期激活能调节肌细胞内Ca2+浓度,促进PGC-1α表达和线粒体生物合成,提高能量代谢效率和有氧运动能力。还有研究通过抑制TRPV1 的活性观察TRPV1 对线粒体生物合成的影响。Zhu 等[57]用30 mg/kg TRPA1 拮抗剂A-967079 抑制败血症小鼠TRPV1 的表达,1 周后发现TRPV1 拮抗剂使小鼠肾细胞PGC-1α和TFAM 蛋白水平分别降低了68.3% 和53.15%,表明抑制TRPV1 不利于线粒体生物合成。肌肉中的PGC-1α是线粒体生物合成的必需调节因子,研究表明肌肉中PGC-1α和PGC-1β的缺失会导致线粒体呼吸、electron transport chain(ETC)/OXPHOS 基因表达和有氧运动表现明显下降[58]。转基因小鼠肌肉中PGC-1α的高度表达促进线粒体生物合成[59]。因此,TRPV1被长期激活可通过上调PGC-1α表达促进线粒体生物合成。TRPV1 被长期激活后还存在TRPV1-Ca2+-CaMKⅡ的信号轴。小鼠持续16周被喂养0.01% 辣椒素,结果显示其肾细胞的TRPV1 表达明显上调,且CaMKⅡ和AMPK 磷酸化水平明显升高,通过抑制CaMKⅡ发现辣椒素激活的TRPV1 对AMPK 的影响被消除,而抑制AMPK不影响TRPV1促进CaMKⅡ的磷酸化[56]。此外,Ca2+能够激活CaMKⅡ,CaMKⅡ激活使p38 MAPK 磷酸化水平增强,p38 MAPK能启动PGC-1 α转录[60],从而促进线粒体生物合成。因此,TRPV1被长期激活可能通过Ca2+-CaMKⅡ-p38 MAPK-PGC-1α信号通路促进线粒体生物合成。
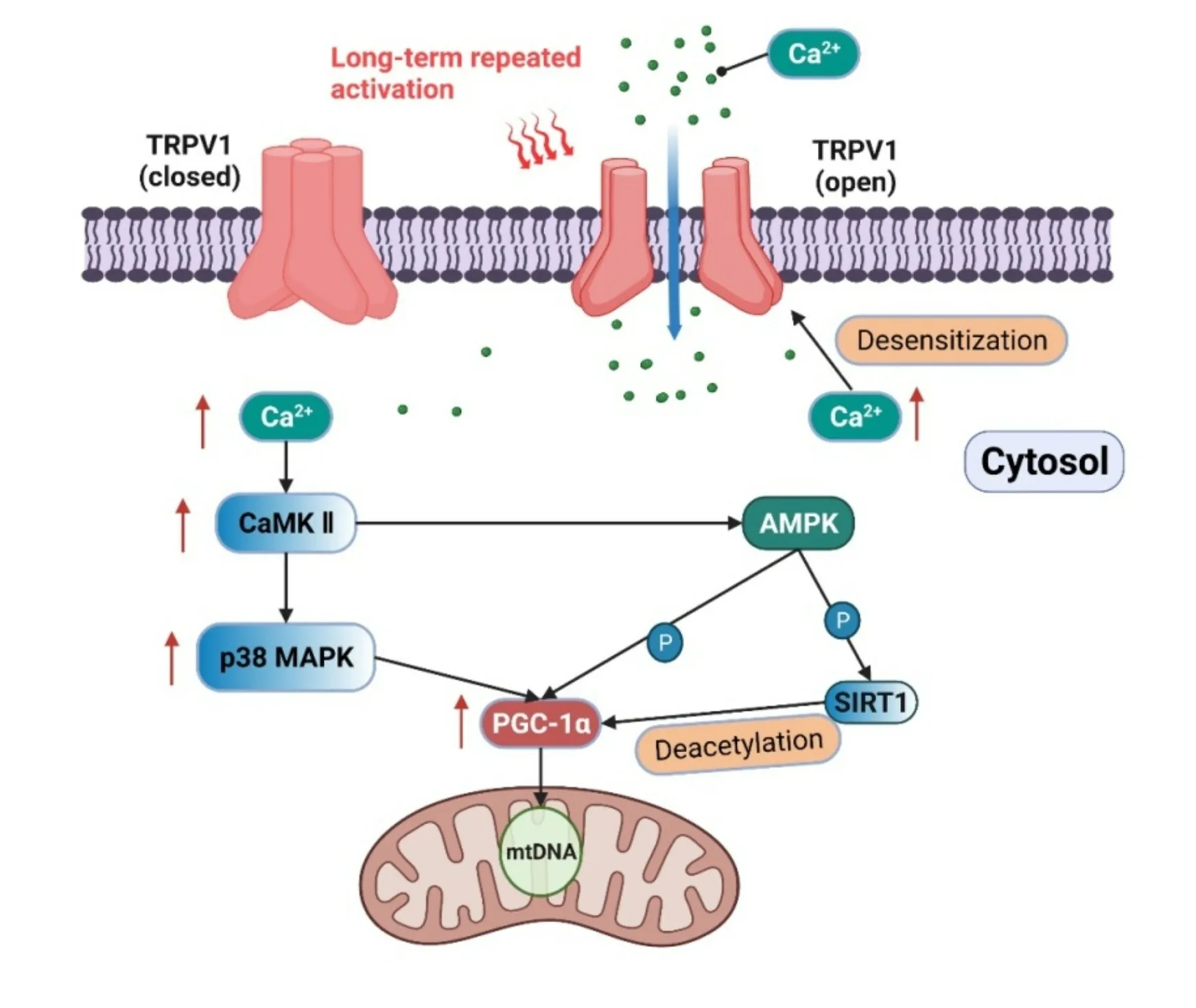
图1 TRPV1被长期激活后促进线粒体生物合成的信号通路
TRPV1 能否能激活AMPK 尚无统一观点。AMPK是PGC-1α重要的调节信号蛋白,其激活促进线粒体生物合成[61]。AMPK可以磷酸化PGC-1α直接提高线粒体生物合成,也可以通过组蛋白去乙酰化提高PGC-1α的转录,促进线粒体生物合成[60]。运动后ATP 水平的消耗会激活AMPK,AMPK 被证明通过SIRT1 激活PGC-1α诱导线粒体生物合成[62]。40℃的肌肉高温通过AMPK-SIRT1-PGC-1α通路诱导线粒体生物合成[9]。一些研究也报道了TRPV1 与AMPK 的关系。Wei 等[63]以1%O2低氧环境培养C57小鼠分离的原代心肌细胞,发现缺氧激活心肌细胞TRPV1,提高了AMPK的活性,从而诱导心肌细胞自噬以减轻缺氧的损伤。Lu等[64]通过4 周4℃的低温暴露发现小鼠心肌细胞TRPV1 和AMPK 磷酸化水平上调,而TRPV1 拮抗剂SB366791 组的小鼠冷暴露后心肌细胞TRPV1 活性下降,从而导致AMPK 磷酸化水平被明显削弱,表明TRPV1 激活后能够提高AMPK 的磷酸化程度,提高AMPK 的活性。而也有研究报道激活的TRPV1可能不会提高AMPK的活性。Tedesco等[65]用内源性大麻素酰胺喂养4周肥胖小鼠,结果发现小鼠白色脂肪TRPV1 和AMPK 的活性增加,而TRPV1 被敲除后内源性大麻素酰胺对AMPK 和线粒体生物合成的影响未受到影响,表明内源性大麻素酰胺可能不通过激活TRPV1来激活AMPK。
脱敏是TRPV1 的特征之一,细胞内Ca2+浓度是TRPV1脱敏的关键调节因子。细胞内Ca2+可以通过结合N 端和C 端调节TRPV1 的活性[66]。细胞内Ca2+浓度较低时会增强TRPV1 活性,而细胞内Ca2+浓度高时会通过负反馈方式抑制TRPV1 活性,动态调节细胞内Ca2+浓度[67]。TRPV1 还包含多个磷酸化位点,其中PKA、PKC、CaM 可以通过这些磷酸化位点调节TRPV1的活性[68]。PKA 和PKC 可以增加TRPV1 磷酸化程度[69]。此外,Ca2+依赖性机制也抑制TRPV1的活性,细胞内Ca2+结合CaM 激活CaM,CaM 去磷酸化TRPV1 使TRPV1 活性降低[70]。CaM 去磷酸化位点是TRPV1 的N末端,PKA和PKC磷酸化TRPV1的位点也是N末端[71],因此TRPV1 的敏化剂和脱敏剂通过竞争共同调节TRPV1 的活性。TRPV1 脱敏的特征可能解释TRPV1被急性激活后抑制线粒体生物合成,而TRPV1 被长期激活会促进线粒体生物合成的现象。
TRPV1 在线粒体生物合成中有重要作用,TRPV1与Ca2+、p38 MAKP 和PGC-1α等线粒体生物合成的关键调控因子关系密切。急性激活TRPV1诱导的Ca2+水平升高可能导致线粒体Ca2+过载,产生过量ROS 不利于线粒体生物合成。TRPV1 被长期激活可能通过Ca2+-CaMKII-p38 MAPK-PGC-1α信号通路促进线粒体生物合成。
4 总结
长期诱导肌肉高温能够促进线粒体生物合成,而一次急性诱导的肌肉高温会抑制线粒体生物合成,其可能机制与TRPV1、Ca2+、p38 MAKP和PGC-1α等关键因子有关。TRPV1 对其所在的细胞环境温度非常敏感,40℃~45℃的高温能够激活TRPV1 通道。TRPV1被急性激活后诱导的Ca2+水平升高可导致线粒体Ca2+过载,产生过量ROS 不利于线粒体生物合成。TRPV1被长期激活可能通过Ca2+-CaMKⅡ-p38 MAPK-PGC-1α信号通路促进线粒体生物合成。TRPV1 能否影响AMPK 的活性尚无统一观点。目前仍缺乏直接证据证明热环境下运动诱导的肌肉高温通过激活TRPV1调节下游信号分子促进线粒体生物合成,肌肉高温激活TRPV1调控线粒体生物合成还有待深入研究。

