抗阻运动促进大鼠导管相关性血栓溶解再通的研究
韦佳妮 赵慧函 蒋庆娟 文萃 黄欣欣 凌瑛 应燕萍
广西医科大学第一附属医院(南宁 530021)
中心静脉导管(central venous catheter,CVC)是经外周静脉置入颈内静脉、锁骨下静脉或股静脉等大中心静脉且末端腔位于右心房内、上腔静脉及下腔静脉的血管留置装置[1]。CVC 在全世界医疗卫生机构的普遍使用导致许多导管相关并发症出现,其中导管相关性血栓(catheter related thrombosis,CRT)是最常见且最严重的并发症之一[2]。CRT 的发生可能会危及患者生命安全,导致患者就医费用增加,加重社会医疗卫生系统负担。目前治疗CRT 的方法主要包括抗凝、溶栓治疗和导管处理。抗凝治疗仅能防止血栓扩展,并不能加速其溶解,血凝块仍需靠机体自身缓慢溶解;而溶栓治疗的疗效和安全性目前仍然存在争议[3,4]。静脉血栓的最终吸收和溶解主要依赖机体自身慢性自然溶解机制,因此,增加血栓的机化和血管新生有助于血栓的溶解吸收。此外,目前的指南均不推荐在发生血栓后常规拔除导管,并且如果患者治疗仍需使用导管,拔管后另选部位重新置管后出现新发CRT的风险高达86%[5]。循证指南中指出置管侧早期有效的上肢运动可以促进血液循环,降低CRT的发生率[6]。近些年有研究发现,运动可通过提高血红素氧合酶-1(heme oxygenase-1,HO-1)表达及其活性水平来提高抗氧化能力[7]。而HO-1是血管内皮重要保护因子,通过介导复杂的炎症反应及炎症依赖性,在血管新生过程发挥重要作用[8]。此外,前期研究已表明运动预防CRT 形成[9,10],但关于运动促进CRT 溶解再通的研究较少。因此,本研究通过建立大鼠CRT 模型,通过抗阻运动、注射HO-1激动剂钴原卟啉(cobalt protoporphyrin,COPP)及抑制剂锡原卟啉(tin protoporphyrin IX,SnPP)干预,并进行相关指标检测,为抗阻运动辅助治疗CRT 提供理论依据。
1 材料与方法
1.1 研究对象
7~8 周龄SPF 级雄性SD 大鼠144 只,体重200~220g,购于广西医科大学动物实验中心,饲养于广西医科大学动物实验中心SPF 级动物房(SYXK 桂2020-0004)。饲养环境室温20℃~25℃,湿度60%~70%,12 h 光/暗周期循环,通风、光线良好,大鼠自由进食、饮水。本实验严格遵循实验动物3R原则,并通过广西医科大学实验动物伦理委员会审查(审批号:202008006)。
1.2 构建大鼠CRT模型
前期研究发现,置管7天后血栓高发,10天后血栓形成稳定[11]。因此,本研究选用置管10 天后经B 超确诊血栓形成的大鼠CRT 模型,采用动物随机分组软件将大鼠随机分为CRT 对照组(n=36)、CRT 抗阻运动组(n=36)、CRT+COPP 组(n=36)、CRT+SnPP 组(n=36)。大鼠CRT模型参照课题组前期实验方法[12],采用3%戊巴比妥钠(50 mg/kg)腹腔注射麻醉,待麻醉满意后,右侧颈部备皮,常规消毒、铺巾,沿气管右侧0.5 cm 处纵切1~2 cm,逐层钝性分离并游离右颈外静脉,在结扎点下将静脉剪一斜形切口,将导管送入至右心房上部,使用加入0.9%生理盐水的注射器回抽血液,见回血后确认导管在静脉血管中,并且血流通畅。用配套堵头封闭导管末端,缝合伤口,常规消毒。大鼠麻醉复苏后放回鼠笼,正常进食饮水。
1.3 干预方法
CRT+COPP 组和CRT+SnPP 组在置管10天后分别腹腔注射CoPP(c1900;Sigma)及SnPP(sentacruzBiotechnology)5mg/kg 进行干预,CRT 对照组不做干预。CRT+抗阻运动组运动方案参考前期研究方法[10]。所有大鼠术前1 周进行适应性训练无负重预爬,每天能完成6次预爬的大鼠纳入实验,否则予剔除[13]。大鼠置管10 天后采用鼠尾捆绑负重砝码的方式进行抗阻运动,爬梯高度1.1 m,阶梯间隔2.0 cm,倾斜度为85°。大鼠从梯子底部开始往上爬到顶端,每周训练6天,休息1天,1组/天,6次/组,2 min/次,每次到达梯子顶端休息20 秒,15 min 完成一次抗阻运动训练,必要时刺激大鼠尾部促使其运动,总共训练4 周。抗阻运动过程中,砝码的重量根据大鼠每周的体重调节,砝码为标准砝码,以达到负重准确量化。第1 周负重为大鼠自身体重的10%,第2周为30%,第3周为50%,至第4周负荷增加至体重的70%。
1.4 样本采集
各组干预后的1、4、7、10、14、28 天,每个时间点随机取6 只大鼠,待大鼠麻醉满意后,进行腹主动脉采血,离心收集血清后放置于-80°冰箱,用于ELISA检测血清HO-1、白介素(interleukin,IL)-6、IL-10 浓度。剪开大鼠置管侧皮肤,逐层钝性分离,取穿刺点至右心房上段约5 cm 静脉血管,一部分用于病理切片HE 染色;另一部分用于qPCR 检测。干预后的1、7、14、28天,取各组大鼠穿刺处至右心房约5 cm 静脉血管,用于免疫组化CD31染色。
1.5 评价指标
1.5.1 血栓溶解再通情况
血管组织经脱水包埋、切片,行苏木精伊红(H&E)染色,染色切片由数字病理切片扫描仪(NanoZoomer S60)采集图像,应用Image-ProPlus图像分析软件进行分析,使用以下公式计算各组血栓溶解率:血栓溶解率=[(静脉管腔面积-血栓面积)/静脉管腔面积]×100%[14]。
1.5.2 ELISA检测
大鼠腹主动脉采血后,室温放置30 min,离心10 min,得到血清。使用ELISA 试剂盒检测HO-1(ml003108)、IL-6(ml064292)、IL-10(ml002813)浓度,试剂盒均购自上海酶联生物科技有限公司。严格按照试剂盒说明书进行操作,使用酶标仪(Synergy H1)检测吸光度值,绘制标准曲线。
1.5.3 荧光定量PCR检测
使用Trizol(Invitrogen,CA,USA)提取总RNA,逆转录为cDNA 后,用SYBR Green 法进行PCR 扩增,设置复孔,实验结果重复3 次,使用2-△△Ct 法对qPCR 结果进行分析。以大鼠RPLP1 为内参,引物均由上海生物工程有限公司合成,引物序列为:
HO-1-F:5’-TCTGCAGGGGAGAATCTTGC-3’;
HO-1-R:5’-TTGGTGAGGGAAATGTGCCA-3;
RPLP1-F:5’-AAAGCAGCTGGTGTCAATGTT-3’;
RPLP1-R:5’-GCAGATGAGGCTTCCAATGT-3。
1.5.4 CD31免疫组化染色
血管组织石蜡包埋切片,使用0.1%柠檬酸钠进行热修复,自然恢复室温后加入anti-CD31(AF6191,Affinity Biosciences),4°孵育过夜。使用通用二步法试剂盒(PV-9000,北京中杉金桥生物技术有限公司)滴加反应增强液、封闭、孵育二抗,DAB显色试剂盒(北京中杉金桥生物技术有限公司)显色,苏木素复染。使用数字病理切片扫描仪采集图像,应用Image pro plus图像分析软件分析,计算平均光密度值,分析血管新生情况。
1.6 统计学分析
采用SPSS 24.0 软件进行数据处理。结果以均数± 标准差(±s)表示。不同组别之间采用方差分析比较,若方差齐,则使用LSD 法进行两两比较;若方差不齐,则使用Tamhane T2检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 大鼠基本情况及CRT病理形态
大鼠置管后存活率为100%,置管成功率为100%,导管留置期间无导管脱出,无出血、感染、肺栓塞等并发症。干预1 天后可观察到各组CRT 形成趋于稳定,血栓胶原蛋白成分增多,并可见新生的肉芽组织由血管壁向血栓内生长,将纤维蛋白等血栓成分逐渐溶解、吸收,血栓开始机化。随着时间推移,可见血栓体内部裂隙扩大,新生管腔样结构形成,恢复部分再通。至28天后,CRT 对照组血栓内部形成新的血管相互吻合再通,被阻塞的血管部分重建血流,其中CRT+COPP组及CRT+抗阻运动组接近完全再通,CRT+SnPP 组中管腔内仍有红细胞形成,仅部分再通(图1)。

图1 各组大鼠干预后不同时间点血管HE染色(n=6,50×)
2.2 各组大鼠不同时间点血栓溶解率比较
各组血栓溶解率随时间延长而增加(表1)。其中,CRT+COPP组各时间点血栓溶解率均高于CRT对照组(P<0.01),而CRT+SnPP组均低于CRT对照组(P<0.05,P<0.01)。CRT+抗阻运动组干预第28天血栓溶解率高于CRT对照组(P<0.01),与CRT+COPP组相比,差异无统计学意义(P>0.05)。
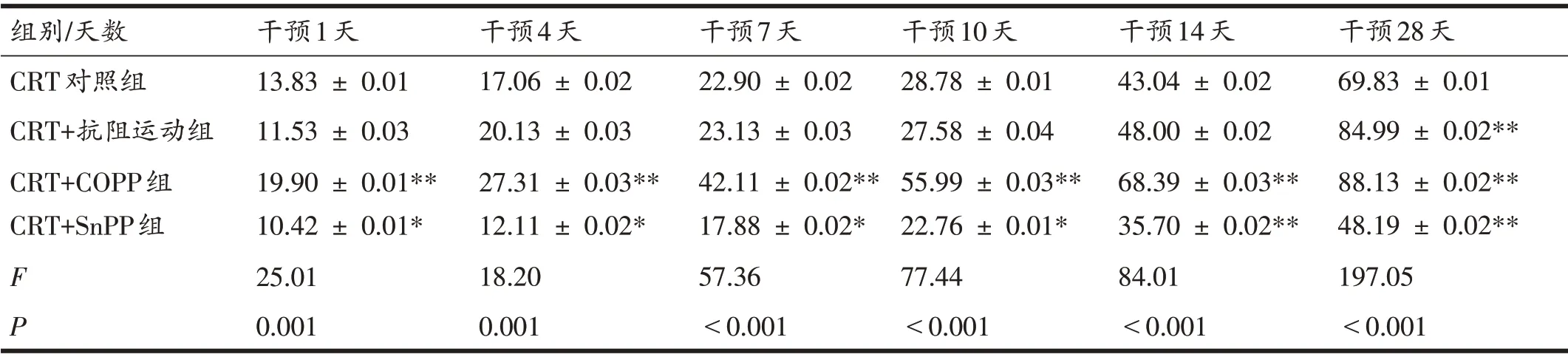
表1 各组大鼠干预后不同时间点血栓溶解率比较(n=6,%)
2.3 各组大鼠不同时间点血清HO-1、IL-6、IL-10 浓度比较
与CRT 对照组相比,CRT+COPP 组各时间点血清HO-1及IL-10含量上升、IL-6含量降低,CRT+SnPP组血清HO-1 及IL-10 含量降低、IL-6 含量上升,差异均有统计学意义(P<0.05,P<0.01);CRT+抗阻运动组第28天血清HO-1及IL-10升高,IL-6降低至与CRT对照组差异有统计学意义(P<0.01),而与CRT+COPP 组相比差异无统计学意义(P>0.05)(图2)。

图2 各组大鼠不同时间点血清HO-1(A)、IL-6(B)、IL-10(C)浓度比较(n=6)
2.4 各组大鼠不同时间点HO-1 mRNA表达比较
与CRT 对照组相比,CRT+COPP 组各时间点HO-1mRNA 表达均显著增加(P<0.01);CRT+SnPP 组各时间点HO-1 mRNA 表达降低(P<0.05);CRT+抗阻运动组第28天HO-1表达量升高至与CRT对照组比较差异有统计学意义(P<0.01),而与CRT+COPP 组相比差异无统计学意义(P>0.05)(图3)。

图3 各组大鼠不同时间点HO-1 mRNA表达情况(n=6)
2.5 各组大鼠不同时间点CD31表达比较
免疫组化结果显示,CD31 表达于血管内皮间隙。与CRT对照组比较,CRT+COPP组各时间点CD31表达显著增加(P<0.01);CRT+SnPP 组中CD31 表达显著减少(P<0.01)。CRT+抗阻运动组第28天CD31表达显著高于CRT 对照组(P<0.01),与CRT+COPP 组相比差异无统计学意义(P>0.05)(图4)。
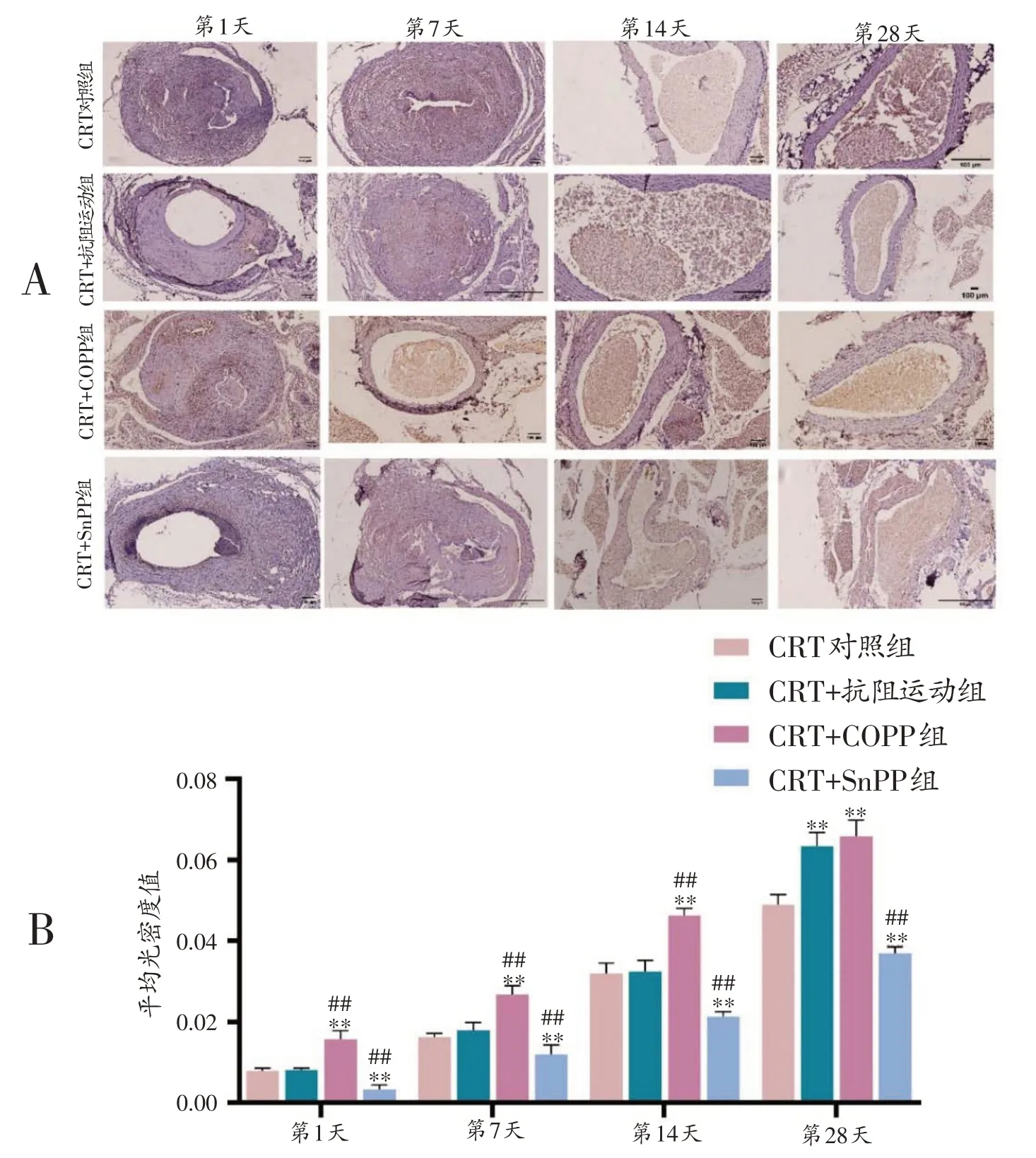
图4 各组大鼠干预后不同时间点免疫组化CD31染色(100×)(A)和各组大鼠干预后不同时间点平均光密度值(B)(n=6)
3 讨论
正常情况下,HO-1在大多数细胞组织内呈低水平表达,但在多种氧化应激和炎症信号诱导下高表达,并发挥抗炎和抗氧化作用[15]。IL-6 是一种炎症反应因子,能够促进炎症反应;而IL-10作为一种抗炎因子,能够抑制炎症反应和促炎因子的释放[16]。HO-1 被IL-6高度诱导,而HO-1 负调控IL-6,这表明HO-1 和IL-6之间存在负反馈循环;而IL-10 和HO-1 通过正反馈环相互联系,IL-10 诱导可促进HO-1 高表达,从而可发挥其抗炎作用[17,18]。HO-1 具有保护血管的功能,可抑制血管中炎症反应,保护血管内皮细胞使其免受氧化应激损伤[19]。有研究证实HO-1 在血栓溶解再通过程中扮演着重要角色,与未敲除HO-1基因小鼠相比,敲除HO-1 基因小鼠血栓机化再通过程明显受到抑制[20]。Gabre 等[21]发现深静脉血栓(deep venous thrombosis,DVT)形成小鼠,注射活化蛋白C 可通过HO-1 依赖的机制显著加速血栓溶解。此外,HO-1 还可以诱导血管内皮生长因子(vascular endothelial growth factor,VEGF)和基质细胞衍生因子-1(stromal cell derived factor-1,SDF-1)高表达,从而促进DVT溶解再通[22]。本研究显示,COPP 和SnPP 能明显影响HO-1 mRNA 的表达,同时,与CRT 对照组自然溶解过程相比,HO-1高表达的CRT+COPP组血栓溶解再通明显加快,而抑制HO-1后,其血栓溶解再通速度明显减慢,说明抗阻运动28 天后血栓溶解再通能起到与激动剂一样的效果,由此证明抗阻运动28 天可上调HO-1 表达并促进CRT溶解再通。
运动应激通过自身调节及HO-1 代谢产物对HO-1系统产生影响,研究显示运动诱导与HO-1的表达密切相关[23]。我们前期发现导管置入后改变血流的方向及速度,引起CRT 的发生,增加促炎细胞因子表达,导致HO-1 含量降低[24]。而抗阻运动可以改变血流切应力,发挥抗氧化保护作用,抑制炎症反应,从而改善血管内皮的功能,减少CRT 形成[25]。前期研究发现CRT大鼠进行8 周抗阻运动后,HO-1 表达增加,修复氧化应激,从而改善血管内皮功能,在一定程度上预防CRT形成[10]。据报道,在健康志愿者中,HO 活性随着运动的增加而增加,循环血液中的HO-1mRNA和蛋白表达升高[26]。动物研究同样表明,运动可以增强心脏和血管平滑肌细胞中HO-1mRNA 的表达[27]。还有研究发现,FeCl3化学诱导小鼠动脉损伤后,运动通过促进内皮细胞生长、基质重塑和减少血管壁炎症以及通过增加细胞外基质金属蛋白酶活性来促进血栓消退和血管壁重塑[28]。本研究显示,抗阻运动干预28天可上调HO-1并降低IL-6 水平,提高IL-10 水平,从而抑制炎症反应,加速CRT 溶解再通。同时,CRT+抗阻运动组大鼠运动28 天后CRT 溶解率与对照组相比增加18.30%。由此推测,运动可上调HO-1表达,发挥抗炎作用,在一定程度上影响血栓溶解再通。
血栓溶解是一个复杂的过程,其过程与正常的伤口愈合过程大致相同,均伴随炎症细胞的浸润及新生毛细血管的形成[29]。目前已证实新生血管对血栓溶解再通产生显著影响,促进血管新生可以加速血栓的溶解再通。血栓机化初期,血栓从血管壁回缩,血栓主体和静脉壁内膜之间形成内皮细胞内衬的口袋样及裂缝结构,形成新的血管腔相互融合并扩大形成管道,逐渐恢复成血栓前状态,使堵塞静脉重新恢复血流[30]。如机体对血栓的吸收和溶解彻底,血管可完全再通,否则将出现血管狭窄或闭塞,引起血栓后综合征(postthrombotic syndrome,PTS)的发生[31]。因此,促进血栓的早期溶解和吸收有助于血栓的治疗,减少PTS 的发生。作为新生血管标志物,CD31存在于早期内皮细胞的边缘,在血管内皮细胞的抗血栓/抗炎表型中起重要作用[32]。本研究通过免疫组织化学CD31染色发现,抗阻运动28 天诱导HO-1 表达可促进CRT 溶解再通,其机制可能与其促进新生血管形成有关。一项研究表明,HO-1 可促进内皮祖细胞增殖动员及迁移,并聚集至损伤区域向新生内皮细胞分化,从而促进血管修复及抗氧化应激损伤能力,这可能是HO-1促进血管新生的关键机制[33]。
综上所述,抗阻运动、HO-1、抗炎、促血管新生、血栓溶解再通均存在相互关系。抗阻运动作为一种生理刺激,可调节许多分子、信号通路,能明显改善血管内皮功能,修复血管内皮损伤,减少血管炎症。运动可能经血流动力学刺激介导HO-1生物学活性,从而发挥血管保护作用。而HO-1 作为机体内源性保护因子能增强内皮细胞血管生成活性,促进新生血管形成,对多种血管源性损伤发挥保护作用。因此,本研究通过聚焦运动上调HO-1表达,从动物实验层面表明抗阻运动加速CRT 溶解再通的安全性及有效性,并为临床抗阻运动辅助治疗CRT的实施提供有力证据及经济、科学、有效的辅助治疗方案。
本研究也存在一定局限性,如未能运用B 超对大鼠CRT溶解再通过程进行监测及从其他分子信号通路验证血栓溶解再通机制,这些有待进一步深入研究。
4 总结
抗阻运动28天可诱导HO-1表达,发挥抗炎、促血管新生作用,最终加速CRT溶解再通。

