针康法调控细胞自噬改善脑缺血再灌注大鼠神经损伤的机制研究
孔 妍,刘双岭,关睿骞,崔乃松,陈 奥
(黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001)
缺血性脑卒中是一种由于脑血流中断、脑局部供血不足引发的神经功能障碍性疾病,具有高发病率、高伤残率和高死亡率等特点,严重危害了人类的生命健康和生活质量[1-2]。调查研究显示,我国老年患者每年新发缺血性脑卒中人数约为120~150万,其中死亡人数高达80~100万。在幸存患者中,又有半数以上伴有不同程度的神经功能缺损症状,如肢体麻木、痉挛性偏瘫等[3]。因此,在脑组织缺血缺氧早期给予及时有效的干预治疗,对于减轻神经细胞结构和功能受损、预防神经功能障碍具有重要的意义。目前临床上针对缺血性脑卒中的治疗主要采用溶栓、扩血管和抗血小板聚集等药物治疗[4],但由于作用靶点单一、治疗时间窗窄等问题使得上述药物的治疗具有一定的局限性[5]。基于此,亟需通过对缺血性脑卒中病理生理学机制的深入研究,寻找抗缺血性脑卒中的新的更有效的作用靶点和治疗方法。针康法是将中医学中头穴丛刺法与现代康复技术相结合的一种治疗方法,近年来已被广泛运用于临床脑卒中的治疗,并发挥出较佳的治疗效果[6-7]。为进一步验证该方法对缺血性脑卒中发生发展期的干预效果并探究其可能的作用机制,本研究拟采用Longa改良线栓法建立大鼠局灶性脑缺血再灌注模型(MCAO),配合给予针康法干预治疗,以探讨针康法对MCAO大鼠神经功能损伤的保护作用及与细胞自噬的相关性,具体报告如下。
1 材料
1.1 实验动物
选用清洁级雄性健康Sprague-Dawley(SD)大鼠,雌雄各半,体质量(250±30)g,8周龄,由黑龙江中医药大学GLP动物实验中心提供,许可证号:SCXK(吉)-2020-0004。动物房保持12 h/12 h昼夜交替循环,每8 h自动通风换气,温度(25±2)℃,湿度40%~70 %,自由饮水、进食,在此条件下适应性饲养1周后进行实验。
1.2 实验仪器
PT型电动跑台(鼠用)五跑道(上海康为医疗科技发展有限公司);Stuart SHM2组织匀浆器(英国Bibby-Stuart公司);IX73倒置荧光显微镜(日本OLYMPUS公司);UV5紫外可见分光光度计(METTLER TOLEDO公司);SDS-PAGE凝胶电泳仪(美国Bio-rad公司);Invitrogen iBright凝胶成像分析系统(Thermo Fisher公司);FYL-YS-310L实验室大鼠恒温箱(FU.YI.LIAN公司)。
1.3 实验试剂
TTC染色液、辣根过氧化物酶(Sigma-Aldrich公司);山羊血清封闭液、TBST溶液和苏木素染液(国药集团化学试剂有限公司);DAB显色试剂盒(南京建成生物工程研究所,批号:W02612);Beclin1、LC3-Ⅱ抗体(美国 Cell Signaling Technology公司,批号:019032,021036);山羊抗兔IgG 二抗、BCA 蛋白含量检测试剂盒(Abcam公司,批号:ab49367,ab2593);Trizol RNA提取试剂盒、逆转录试剂盒(Thermo Fisher公司,批号:868342,4366596)。
2 方法
2.1 动物分组与造模
将90只大鼠随机分为5组:假手术组、模型组、针刺组、康复组和针康组,每组各18只,剔除麻醉和手术意外死亡的以及未达入模标准的大鼠。参照Longa改良线栓法建立大鼠局灶性脑缺血再灌注模型(MCAO)[8],步骤如下:大鼠称重,10 %水合氯醛(300 mg/kg)腹腔注射麻醉后,仰卧位固定于操作台上,取颈正中切口,切开皮肤,钝性分离皮下各层组织及肌肉,暴露出颈总动脉,小心分离右侧颈总动脉(Common carotid artery,CCA)和颈外动脉(External carotid artery,ECA),在CCA近心端和ECA处进行结扎,在ECA近分叉处做一直径约0.20 mm的V型切口,将线栓自切口处轻轻导入,经颈内动脉送入颅内,插入深度约(18.50±0.50)mm,至有明显阻力时停止,以阻断大脑中动脉血流,在缺血 90 min 后取出线栓进行再灌注,止血消毒后缝合切口,单笼饲养。于术后6 h采用改良的Bederson’s标准进行神经功能评分,选择评分为1~3分的MCAO大鼠纳入本实验。假手术组只进行麻醉和血管分离术,不结扎血管及导入线栓。
2.2 干预方法
2.2.1 针刺组 于造模后24 h给予头穴丛刺法,按照“大鼠穴位图谱”所示[9],在相应的刺激区,以华佗牌针灸针(0.25 mm×25 mm)取百会穴及百会左、右侧各旁开2 mm处(顶区)向前平刺至顶前区,深度15 mm,以200 r/min频率快速捻转后留针6 h,留针期间每1 h捻转1次,每次5 min,每日1次。
2.2.2 康复组 各组大鼠均在术前给予适应性跑台训练3 d,每天30 min。康复组于造模后24 h给予跑台训练,每天30 min,1次/d。采用五跑道电动跑台,将大鼠置于不断向后传输的履带上,为避免履带尾部电栅栏的电击,大鼠不断地在电动履带上主动向前奔跑,设置跑台斜度0 °,履带传输速度:术前3 d为12 m/min,术后第1天为5 m/min,术后第2天为8 m/min,第3天及以后为12 m/min。
2.2.3 针康组 于造模后24 h给予针刺结合运动跑台康复训练。
2.2.4 假手术组、模型组 术后不给予任何干预,放回笼中安静饲养。
2.3 指标检测
2.3.1 神经功能评分 各组大鼠均于治疗第6 h、3天、7天、14天分别进行神经行为学评估,采用改良的Bederson’s神经功能评分标准[10]:0分,无神经功能缺失体征;1分,提尾时可见病灶对侧前肢屈曲;2分,行走时向病灶对侧转圈;3分,行走时向病灶对侧倾倒;4分,意识障碍,无法自发性走,分值越高表示神经功能损伤越严重。
2.3.2 TTC染色观察脑梗死灶面积 于干预结束后断头处死大鼠,2 min内取出大脑,0 ℃生理盐水冲洗后滤纸吸干表面水分,-20 ℃冰箱冷冻 20 min后取出,去除嗅球、脑干及小脑,以大鼠脑组织切片机自前脑额极起,连续切出5片冠状切片,片厚2 mm,将脑片置入1 %TTC染色液中,37 ℃避光孵育30 min,在15 min时翻面1次使染色均匀。TTC染色完成后将脑片置于4 %多聚甲醛溶液中固定保存,数码相机拍照,扫描,采用Image-Pro Plus 6图像分析软件进行脑梗死灶轮廓勾画,测量缺血组织截面积(A1、A2)和同侧半脑截面积(B1、B2),用梗死百分比(%)=[(A1+A2)÷(B1+B2)]×100 %的公式计算半脑梗死百分比(%)。
2.3.3 免疫组化检测脑组织Beclin1、LC3-Ⅱ阳性表达 大鼠行神经功能评分后,采用0.9 %生理盐水心脏灌注处死后取出脑组织,置入4 %多聚甲醛缓冲液中固定,石蜡包埋切片,脱蜡至水化,3 %过氧化氢室温孵育10 min,抗原修复,滴加山羊血清室温封闭30 min,吸净封闭液,滴加稀释的一抗后4 ℃保存过夜,PBS冲洗3次×5 min,次日滴加稀释的二抗后37 ℃孵育30 min,PBS冲洗3次×5 min,辣根酶标记、DAB显色后苏木素复染,脱水、透明和封片,显微镜下观察,40×光镜下随机选取5个视野,使用Image J图像分析软件对图像进行处理,统计视野内Beclin1、LC3-Ⅱ阳性细胞计数。
2.3.4 荧光实时定量PCR检测脑组织Beclin1、LC3-ⅡmRNA表达 大鼠神经功能评分后,采用0.9%生理盐水心脏灌注处死后取出脑组织,-80 ℃冰箱保存备用。Trizol法提取脑组织总RNA,紫外分光光度计检测RNA浓度及纯度,符合要求后进行后续实验。按照逆转录试剂盒说明合成 cDNA,以SYBR Green 为荧光标记物,进行逆转录扩增,反应程序为:95 ℃ 预变性30 s,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。采用Invitrogen iBright凝胶成像分析系统采集、分析电泳图像,以GAPDH为内参,采用2-△△Ct值计算Beclin1、LC3-ⅡmRNA 的相对表达量。PCR扩增引物序列设计如下:Beclin1 (上游:5′-CTAAGATGGGTCTGAATTGGCTA-3′,下游:5′-CACTCCAGATACGAGTGTGTCATG-3′);LC3-Ⅱ(上游:5′-CAAGCCTTCTTCCTGATGCTAAC-3′,下游:5′-CTATCTCTCGCTCTGCGTCTTC-3′);GAPDH(上游:5′-CAAGGCTGAGACTGGGCACAGT -3′,下游:5′-CTGAAGACGCCAGTAACGGTG-3′)。
2.3.5 Western blot检测脑组织Beclin1、LC3-Ⅱ蛋白表达 大鼠神经功能评分后,采用0.9 %生理盐水心脏灌注处死后取出脑组织,PBS溶液清洗、剪碎后置入匀浆器中,加足量组织裂解液,4 ℃下匀浆30 min,5000 r/min离心15 min,取上清液,BCA 法测定蛋白浓度。加适量的蛋白缓冲液混匀、离心和变性,每孔上样50 μg,SDS-PAGE凝胶电泳分离蛋白,PVDF转膜,脱脂牛奶室温封闭孵育2 h。滴加稀释的Beclin1、LC3-Ⅱ一抗(1∶500),4 ℃孵育过夜。TBST漂洗3次×10 min,滴加相应二抗,室温孵育2 h,TBST漂洗3次×10 min,DAB显色、曝光,采用Image J凝胶成像分析系统采集、分析电泳图像,以各目的蛋白与GAPDH条带的光密度比值表示Beclin1、LC3-Ⅱ蛋白的相对表达量。
2.4 统计学处理

3 结果
3.1 各组大鼠不同时间点Bederson’s神经功能评分比较
与假手术组比较,不同时间点模型组、针刺组、康复组和针康组大鼠的Bederson’s神经功能评分均可见明显升高,差异具有统计学意义(P<0.05);与模型组比较,相同时间点针刺组、康复组和针康组大鼠的Bederson’s神经功能评分均可见降低,并在第3天、7天和14天时呈现显著性差异,差异具有统计学意义(P<0.05),且随时间呈现下降趋势。见图1、表1。
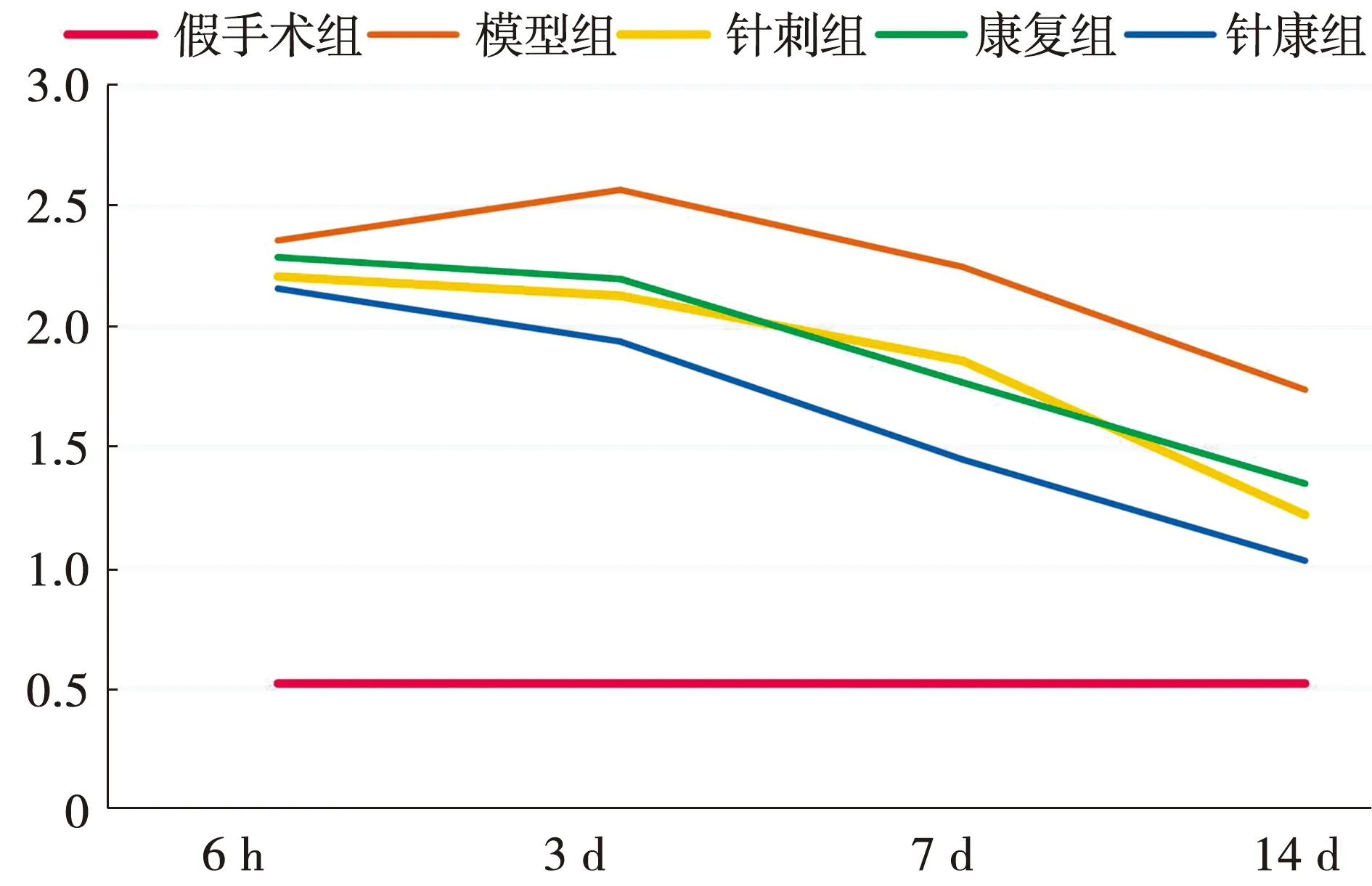
图1 各组大鼠不同时间点Bederson’s神经功能评分比较

表1 各组大鼠不同时间点Bederson’s神经功能评分比较
3.2 各组大鼠脑梗死灶面积比较
TTC染色观察脑梗死灶面积,模型组、针刺组、康复组和针康组均可见明显苍白色梗死灶,假手术组无肉眼可见梗死灶;与假手术组比较,模型组、针刺组、康复组和针康组大鼠的脑梗死百分比均显著增加,差异具有统计学意义(P<0.05);与模型组比较,针刺组、康复组和针康组大鼠的脑梗死面积均可见明显缩小,脑梗死百分比显著降低,差异具有统计学意义(P<0.05),其中,以针康组的脑梗死百分比为最低。见图2、表2。

表2 各组大鼠脑梗死灶面积的比较

注:1-假手术组;2-模型组;3-针刺组;4-康复组;5-针康组。
3.3 各组大鼠脑组织Beclin1、LC3-Ⅱ阳性表达比较
与假手术组比较,模型组、针刺组、康复组和针康组大鼠的Beclin1、LC3-Ⅱ阳性细胞计数均可见明显增多,差异具有统计学意义(P<0.05);与模型组比较,针刺组、康复组和针康组大鼠的Beclin1、LC3-Ⅱ阳性细胞计数均可见明显减少,差异具有统计学意义(P<0.05),其中,以针康组的阳性细胞计数最低。见图3、表3。

表3 各组大鼠脑组织Beclin1、LC3-Ⅱ阳性细胞计数比较

图3 各组大鼠脑组织Beclin1、LC3-Ⅱ阳性细胞分布(40×)
3.4 各组大鼠脑组织Beclin1、LC3-ⅡmRNA表达比较
由图4可见,各目的基因的溶解曲线仅有1个峰,表明其扩增具有特异性。荧光实时定量PCR结果显示,与假手术组比较,模型组、针刺组、康复组和针康组大鼠的Beclin1、LC3-ⅡmRNA表达均可见明显升高,差异具有统计学意义(P<0.05);与模型组比较,针刺组、康复组和针康组大鼠的Beclin1、LC3-ⅡmRNA表达均可见明显降低,差异具有统计学意义(P<0.05),其中,以针康组大鼠的Beclin1、LC3-ⅡmRNA表达为最低。见图4、表4。
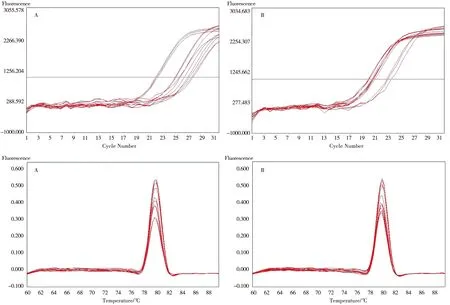
注:A.Beclin1;B.LC3-Ⅱ。

表4 各组大鼠脑组织Beclin1、LC3-Ⅱ mRNA表达比较
3.5 各组大鼠脑组织Beclin1、LC3-Ⅱ蛋白表达比较
与假手术组比较,模型组、针刺组、康复组和针康组大鼠的Beclin1、LC3-Ⅱ蛋白表达均可见明显升高,差异具有统计学意义(P<0.05);与模型组比较,针刺组、康复组和针康组大鼠的Beclin1、LC3-Ⅱ蛋白表达均可见明显降低,差异具有统计学意义(P<0.05),其中,以针康组大鼠的Beclin1、LC3-Ⅱ蛋白表达为最低。见图5、表5。
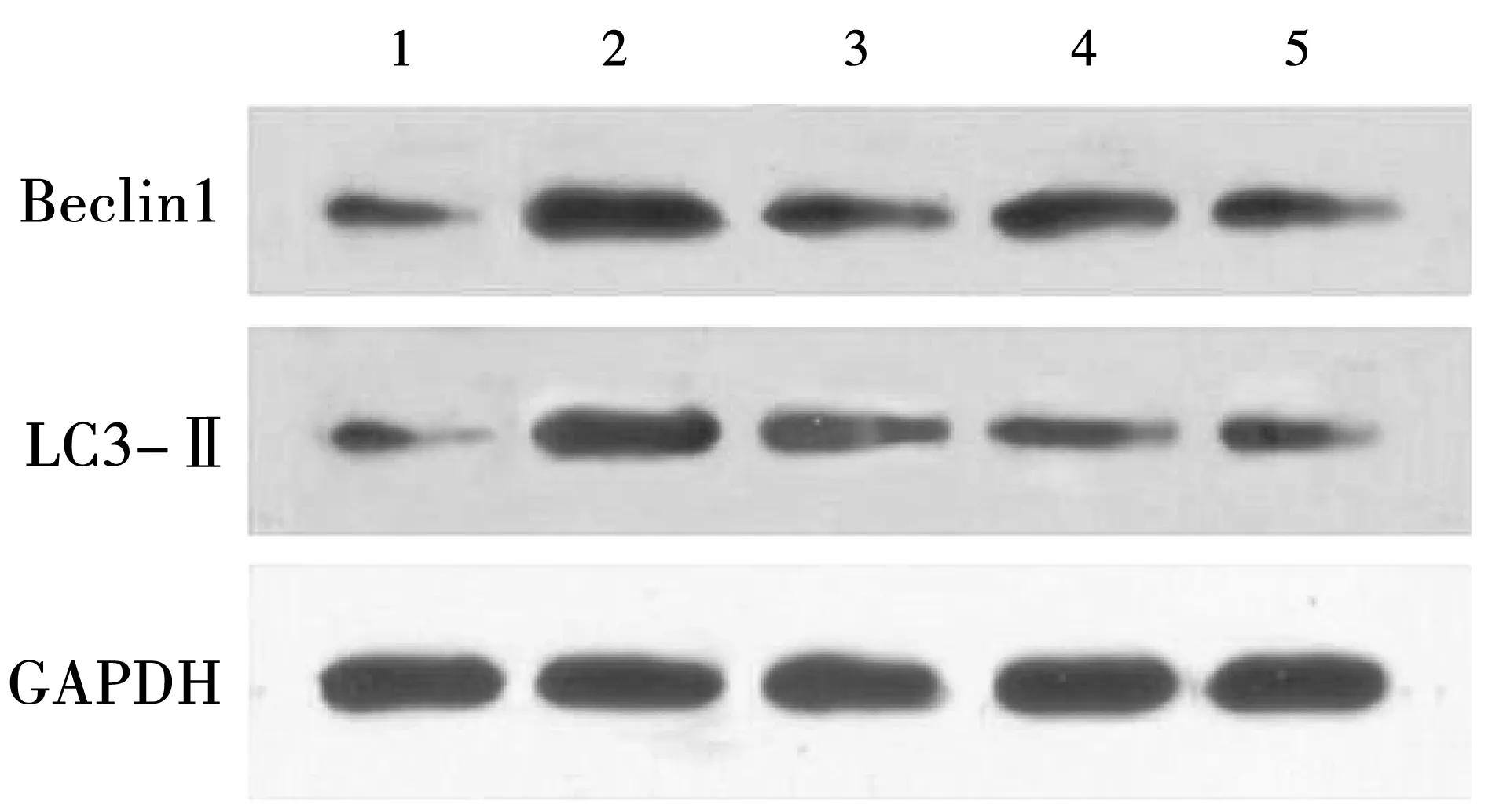
注:1-假手术组;2-模型组;3-针刺组;4-康复组;5-针康组。

表5 各组大鼠脑组织Beclin1、LC3-Ⅱ蛋白表达比较
4 讨论
缺血性脑卒中在中医理论中归属于“中风”“卒中”范畴。中医对中风的认识由来已久,如《景岳全书》记载:“中风麻木不仁等证,因其血气不至,所以不知痛痒,盖气虚则麻,血虚则木,麻木不已,偏枯痿废,渐至日增”[11]。中风是以猝然昏仆、半身不遂、言语不利和口眼歪斜等为主症的病症,取其“风性善行而数变”的特征命名为中风,又因其发病突然、起病急骤,故又称为“卒中”。中医学认为,中风病的病位在脑之脉络,其基本病因为气虚血瘀、升降逆乱和痰瘀互阻等[12]。近年来,中医关于中风病的治法呈现出多元化的趋势,包括针法、方药、中医运动康复及中西医结合的综合治疗方案等。唐强教授在对不同针法与现代康复技术联合治疗脑卒中的联合时机、联合点等进行系统研究后,提出了“针康同步、动态治疗、整体康复”的中西医整合康复理念,创立了针康法治疗技术,使头穴丛刺法与现代康复技术有机结合,以实现疗效最大化[13-14]。
近年来,针康法用于临床上脑卒中的治疗已体现出极佳的治疗作用,能够明显改善脑卒中后遗症的各种功能障碍,提高患者的生活质量,关于针康法干预治疗脑缺血再灌注损伤的机制亦进行了不断的深入研究,如针康法可通过促进脑细胞中Akt、14-3-3、Cyt C及Bcl-2等蛋白表达抑制细胞凋亡,从而改善缺血缺氧脑损伤大鼠神经损伤症状[15-16];针康法能够降低大鼠体内炎性因子TNF-α、IL-1β水平,改善慢性低灌注大鼠脑组织损伤和认知功能[17];可通过优化肠道菌群结构,降低脑缺血大鼠血清LPS、DAO含量,修复受损神经元和肠黏膜损伤,促进神经功能恢复等[18]。研究发现,细胞自噬参与了脑缺血再灌注损伤发生发展的整个过程[19-20],然而,关于针康法是否通过调控细胞自噬改善脑缺血再灌注损伤的机制研究目前尚未见报道。基于此,本研究采用Longa改良线栓法建立大鼠局灶性脑缺血再灌注模型(MCAO),以探讨针康法对MCAO大鼠神经功能损伤的保护作用及对细胞自噬的影响,为临床探寻抗缺血性脑卒中的新作用靶点和治疗方案提供依据。
细胞自噬是由溶酶体介导的细胞内成分自我降解的途径,在细胞增值、分化与衰老的诸多生理过程中均扮演着重要的角色,在脑血管疾病、神经退行性疾病、糖尿病和癌症等病理条件下也发挥着重要的作用[21]。在病理条件下,细胞内受损细胞器增多、细胞缺乏营养,在机体自噬相关基因(ATG)的调控下,细胞内容物可被胞内膜结构包裹形成自噬体[22],再与溶酶体融合形成自噬溶酶体,降解无用的蛋白以为受损细胞提供氨基酸、脂肪酸等营养物质[23]。Beclin1 是最早被发现的参与自噬途径的关键因子,能够诱导自噬相关蛋白定位于自噬体膜上,调控自噬体的形成与成熟[24]。微管相关蛋白质轻链3(LC3)是酵母菌 ATG8 在哺乳动物中的同源基因,在自噬相关蛋白 ATG4 的作用下,可脱去羟基生成游离 LC3-Ⅰ,LC3-Ⅰ又在ATG7及ATG3的共同作用下进一步与PE结合酯化形成 LC3-Ⅱ定位于自噬体膜上,可见,LC3-Ⅱ是自噬体形成的重要生物学标志[25]。Nitatori T[26]等在1995年首次采用透射电子显微镜证实了脑缺血后神经细胞中自噬现象的发生。近年来,越来越多的证据表明,脑缺血再灌注损伤与细胞自噬密切相关。在脑缺血再灌注时,细胞自噬可被迅速激活并参与神经细胞死亡和疾病进展的过程。Carloni S等[27]研究发现,应用自噬抑制剂雷帕霉素能够有效抑制自噬活性,降低自噬相关蛋白Beclin1、LC3-Ⅱ表达,减轻缺血缺氧新生大鼠的神经细胞损伤。王燕等[28]以不同剂量马赛替尼用于脑缺血再灌注损伤大鼠的干预治疗,均能不同程度地下调LC3Ⅱ/I、Beclin-1、Bax等自噬和凋亡蛋白的表达,抑制细胞自噬和凋亡通路,改善大鼠神经功能缺损症状。陈维达等[29]对脑缺血再灌注损伤模型(MCAO)大鼠给予加味涤痰汤干预,能够有效改善MCAO大鼠脑组织损伤,减轻炎症反应,该作用可能与下调 LC3-Ⅱ、Beclin1表达、上调p62表达和抑制自噬活性相关。以上研究均证实,细胞自噬在脑缺血再灌注损伤中发挥了重要的神经保护作用。
本研究结果显示,在脑缺血再灌注发生后,模型组大鼠的Bederson’s神经功能评分和脑梗死灶面积均明显高于假手术组和其他治疗组,Beclin1、LC3-Ⅱ蛋白及mRNA表达均可见明显升高,提示脑缺血再灌注后细胞自噬途径被激活。给予针刺、康复及针康组干预治疗后,可见Bederson’s神经功能评分和脑梗死灶面积均显著下降,Beclin1、LC3-Ⅱ蛋白及mRNA表达均明显降低,且与模型组比较差异有统计学意义(P<0.05),其中,以针康组降低效果最为明显,表明针康法相比于单纯头穴丛刺法或现代康复方法,能够更有效地抑制细胞自噬的发生,进而改善MCAO大鼠神经功能损伤,实现最大化的脑缺血再灌注后神经保护作用,恰符合唐强教授的中西医整合康复理念。
综上所述,针康法能够有效改善脑缺血再灌注大鼠神经损伤,其治疗作用可能是通过降低脑组织Beclin1、LC3-Ⅱ蛋白及mRNA表达和抑制细胞自噬实现的。

