基因治疗发展现状及展望
史 彤,李积宗 (上海市生物医药科技发展中心,上海 201203)
基因治疗是指通过修饰或操纵基因的表达从而改变活细胞的生物学特性以达到治疗目的的一种治疗手段。1990 年,美国批准开展了首例基因治疗临床试验,利用逆转录病毒将正确编码的腺苷脱氨酶ADA 基因导入患者体内,有效恢复了患者体内ADA 合成,开创了基因治疗成功的先例[1]。实际上,1991 年,我国对B 型血友病患者展开了国际上第2 次基因治疗临床试验[2],并在2003 年,我国批准了世界首例基因治疗产品(Gendicine,商品名:今又生)[3]。首个基因编辑临床试验也在我国开展[4]。虽然对基因治疗的认识经历了从乐观到怀疑,再到理性认识的过程[5],但基因治疗对于遗传性疾病和肿瘤的治疗确实表现出惊人的功效,并展现出巨大的市场空间。近年来,随着基因编辑、载体递送等技术的快速发展,基因治疗已经从实验室进一步走向产业,各大药企争相布局基因治疗,同时涌现出大量创新型公司,加入到基因治疗研发的行列。本文从基因治疗关键技术研究进展、产业发展、监管政策体系及未来展望等方面进行探讨。
1 基因治疗关键技术研究进展
随着人们对疾病发病机制的研究逐渐深入,科学家们发现,许多疾病是由于遗传物质改变,例如某个基因的缺失或变异等,而导致功能蛋白表达异常,从而引起病变。基因治疗则可通过修复致病基因,达到缓解和治愈疾病的目的。基因治疗不仅能对血友病等遗传性疾病发挥作用,在一些获得性疾病,如肿瘤等疾病中也同样有效[6-7]。
1.1 基因治疗作用机制
基因治疗机制包括:①用正常的基因补偿突变的基因[8],例如用正常的凝血因子VIII 或IX 基因分别替代变异的基因来治疗血友病;②修复体内突变的基因[9-10],例如I 型酪氨酸血症、镰状细胞病、杜氏肌营养不良症等单碱基突变的遗传病的治疗;③使功能异常的致病基因失活/激活[11-13],例如家族性高胆固醇血症、遗传性耳聋等疾病的治疗;④将新的基因或修饰后的基因导入人体进行疾病治疗[14],例如用嵌合抗原受体T 细胞疗法治疗肿瘤。
1.2 操纵改造基因的方法——基因编辑技术
基因编辑技术是指通过在DNA 中产生靶向双链断裂,然后激活细胞DNA 修复通路,进而实现对目的基因的定点突变、插入或敲除[15]。目前应用最多的是第3 代基因编辑工具“规律间隔成簇短回文重复序列”(CRISPR)[16]。传统的CRISPR 系统为CRISPR/Cas9,通过与目标序列互补的单链引导RNA(sgRNA)将Cas 蛋白引导到特定核酸序列上,Cas蛋白负责剪切核酸。该系统虽然功能多样、高效且易于使用,但易出现脱靶效应等情况,而且需要通过DNA 双链断裂激活修复通路,这可能会对细胞产生不良影响。一些新型的衍生编辑技术,包括碱基编辑器(BE)、先导编辑(PE)和Cas13[17]被相继开发出来,使基因编辑不依赖传统的DNA 双链断裂,直接实现单碱基的定向修改和替换。
CRISPR/Cas 及其衍生编辑技术已成为生物学领域最热门的技术,在基因治疗领域的应用也从单基因遗传病拓展到肿瘤、感染性疾病、心血管疾病、自身免疫性疾病以及代谢性疾病等。
1.3 基因治疗技术实现路径
按照导入形式分为体外基因导入(ex vivo)和体内基因导入(in vivo)两种[6]。①体外途径中,分离患者自体细胞后,将目的基因转导入细胞,在体外对细胞基因修饰后,将修饰后的细胞重新输回患者体内,以达到治疗的目的。例如,嵌合抗原受体T 细胞疗法(CAR-T),分离患者自身T 细胞,体外修饰后重新回输患者体内,高效识别肿瘤细胞并杀灭,达到治疗效果。②体内途径则是将基因通过适当载体系统直接导入人体,对人体细胞进行修饰,以达到治疗的目的。体内途径主要有基于载体系统的DNA/mRNA 导入疗法等。
按照基因治疗的材料、转基因方法和临床应用,可以将基因治疗做以下分类,见图1。

图1 基因治疗技术实现路径
1.3.1 基因治疗载体
安全有效的载体递送系统是基因治疗成功的关键,也是目前基因治疗所面临的瓶颈[5]。基因治疗的载体包括病毒载体和非病毒载体两种。病毒载体包括逆转录病毒、腺相关病毒(AAV)、腺病毒以及慢病毒(LV)等。非病毒载体主要包括阳离子多聚物载体、脂质体载体、纳米颗粒载体等。采用病毒作为载体的基因治疗方案约占70%,但需进行改造,成为无毒、高效、低免疫原性的递送载体[18-19],如腺相关病毒。迄今为止,以腺相关病毒为载体的基因治疗药物已经有3 种获批上市,分别为诺华旗下的AveXis 公司开发的用于治疗脊髓性肌萎缩症的Zolgensma(用于治疗2 岁以下脊髓性肌萎缩症患者)、荷兰UniQure 公司开发的用于治疗脂蛋白酯酶缺乏症的Glybera,以及Spark Therapeutics 公司用于治疗RPE65 突变相关视网膜营养性萎缩的Luxturna。Luxturna 也是美国批准的首个真正意义上的基因疗法。
1.3.2 溶瘤病毒
溶瘤病毒(OV)是一种新型肿瘤免疫疗法,能选择性感染和杀伤肿瘤细胞。溶瘤病毒可通过直接裂解肿瘤细胞、激发机体抗肿瘤免疫反应等多种调控机制破坏肿瘤细胞,而不影响正常细胞的生长[20]。常用的溶瘤病毒包括腺病毒、痘病毒、疱疹病毒、呼肠孤病毒和柯萨奇病毒等[21]。
早期的溶瘤病毒疗法,主要是利用天然的野生型病毒,能引发强烈免疫反应和并发症。随着基因工程技术的不断发展,经过基因改造的溶瘤病毒,由于疗效、特异性和安全性大大提高,而被广泛应用于抗肿瘤疗法。重组人5 型腺病毒(安科瑞,H101)是经基因改造的溶瘤腺病毒,于2005 年由国家食品药品监督管理局批准上市,用于联合化疗治疗鼻咽癌。该药是世界上最早的一种溶瘤病毒,也是目前最常用的一种溶瘤病毒疗法。2015 年美国FDA和欧盟批准的溶瘤病毒T-Vec 上市,目前也被广泛用于复发黑色素瘤治疗。
虽然溶瘤病毒疗法取得了一定进展,但仍需深入研究溶瘤病毒与肿瘤细胞、机体免疫系统等之间的相互作用,探索更具个体化的,多种方式联合的肿瘤治疗方法。
1.3.3 mRNA 药物
mRNA 即信使RNA,由DNA 转录生成,在细胞中可翻译成为蛋白质,发挥相应的功能。新冠疫情的爆发使mRNA 技术成为业界关注的热点。从原理上讲,mRNA 可以用于预防及治疗领域,应用方向上可以包括针对感染性疾病的预防性疫苗、针对肿瘤的治疗性疫苗以及主要针对罕见病的全身分泌性蛋白疗法[22],因而具有巨大的市场前景。目前,国际上mRNA 疗法的三大巨头分别为美国Moderna、 德国BioNTech 和德国 CureVac 公司。三大巨头在感染性疾病、肿瘤和罕见病等领域都布局了相应的研发管线。我国mRNA 疗法起步较晚,但近年来发展迅速,涌现出上海斯微生物、苏州艾博生物、深圳深信生物以及上海蓝鹊生物等一批致力于mRNA 疗法的创新生物技术公司。
目前,mRNA 疗法中仅有Moderna、辉瑞等公司研发的新冠mRNA 疫苗上市,其他感染性疾病疫苗、肿瘤疫苗以及治疗性药物尚在研发中。
mRNA 疗法的优势在于开发时间短、易于合成,但mRNA 具有不稳定、在组织内易被降解等缺点,尤其是mRNA 在体内的有效靶向递送,是目前mRNA 疗法的主要难点之一,先进制剂和递送方案也成为mRNA 药物的核心技术与门槛之一。众多科学家投入到mRNA 载体研究中,已开发出包括脂质体纳米颗粒(LNP)、阳离子脂质体复合物(LP)、脂质体聚合物(LPR)、阳离子纳米孔(CNE)等在内的多种载体,推动mRNA 疗法快速发展。
2 基因治疗产业发展概况
近年来,随着基因治疗技术的快速发展,对生命科学产生了革命性影响,尤其是2020 年获得诺贝尔化学奖的基因编辑技术的诞生,基因治疗技术为多种难治性疾病提供了新的治疗手段。目前,国际上已有30 多种基因治疗产品批准上市(表1)。
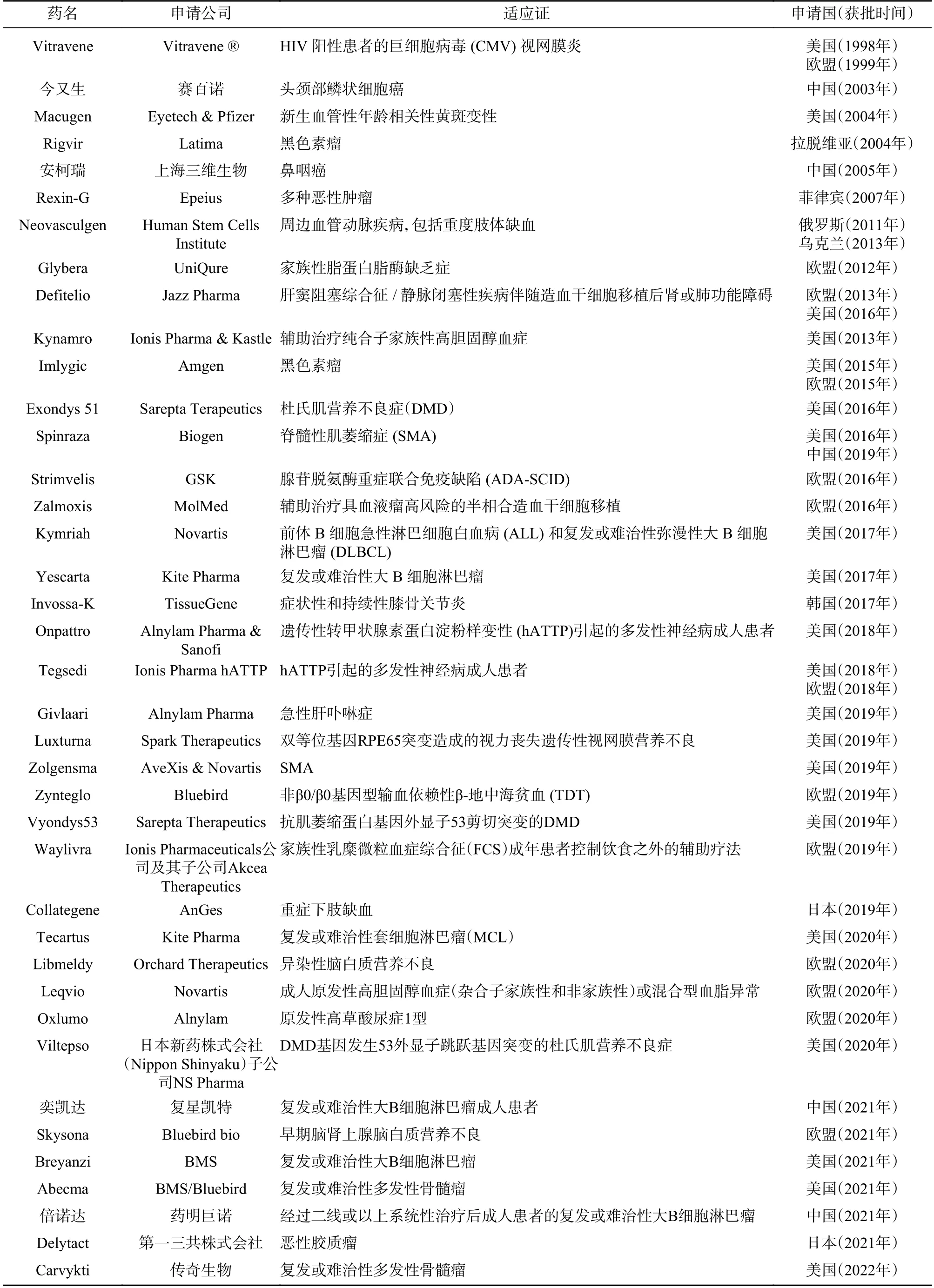
表1 全球上市的基因治疗药物
我国基因治疗产业目前多集中在中游药物研发创新领域,上游产业链核心环节卡脖子现象依然严重,亟待突破,但目前也有针对不同适应证的多种基因治疗产品进入临床研究阶段,并有5 款获批上市,成为仅次于美国的第二研究大国。
上海已将细胞和基因治疗作为生物医药领域重点支持和发展的方向,2019 年6 月,上海市科学技术委员会正式批复成立张江细胞产业园,并于2021 年10 月升级为张江细胞和基因产业园。目前园区已有80 多家细胞和基因相关机构入驻,其中包括细胞存储、研发、制备、检测、临床应用等多个领域,逐步形成了细胞和基因治疗的创新链和产业链雏形(表2)。截至2020 年9 月,张江细胞产业园共有15 项细胞药物获批临床试验,占全国总获批数(46 项)的近1/3。2021 年上海复星凯特和药明巨诺的两个CAR-T 治疗药物分别获批上市。上海已成为细胞和基因治疗领域的领头羊。

表2 上海张江细胞和基因产业园细胞治疗产业链布局
3 基因治疗监管政策体系建设情况
早在1976 年,重组DNA 技术诞生之后,美国国家卫生研究院重组DNA 咨询委员会发布了《重组DNA 分子实验室准则》,这是世界上首个实验室基因工程的管理法规,开启了生物技术立法的先河。1985 年,美国国立卫生研究院颁布的《人类体细胞基因治疗的设计和呈批考虑要点》,涵盖了开展基因治疗临床研究的基本要求,是基因治疗领域第一个系统的法规。1997 年,美国正式将基因治疗纳入到药品管理的法规体系内,以FDA 作为主管机构,并采用了法律管制和咨询机构或委员会相结合的双重管理模式[6]。
从1993 年起,我国首个基因治疗法规《人的体细胞治疗及基因治疗临床研究质控要点》发布,经过近30 年的发展,特别是在近年来以上海为代表的细胞基因治疗产业快速发展的背景下,我国对于基因治疗的监管逐步走上了规范化道路(表3)。2017 年,《细胞治疗产品研究与评价技术指导原则(试行)》发布,明确了细胞疗法的技术要求,迈出了规范化监管的第一步。2019 年以来,国家陆续颁布了一系列相关政策法规。随着我国在基因治疗领域监管体系的不断完善,基因治疗产业进入了健康有序发展的快车道,但也暴露出一些问题,如基础研究仍待加强,应用转化和产业化存在瓶颈等。因此,未来我国仍需进一步强化政策支持与科学监管。一方面在相关基础研究、关键技术和资源平台方面需继续给予政策面大力支持。另一方面,可以借鉴美国FDA 对于新疗法新药物采取加速审批配合上市后严格监管、小机构联合临床试验等系列监管政策,制定适宜的政策法规,推动细胞和基因治疗产品的上市以及上市后再评价,既能尽早进入临床以解决患者需求,又能最大限度保障治疗手段的有效性和安全性。

表3 我国发布的基因治疗相关政策法规或指南文件
4 未来展望
4.1 完善政府引导的基因治疗创新服务体系
“十三五”以来,基因治疗就一直是国家和上海在医药领域重点支持的方向。从地方政府和科研机构共同合作成立的昆山小核酸产业基地,到2019年上海张江细胞产业园的成立,再到2021 年9 月京津冀特色细胞谷试验区的正式挂牌,都体现出国家地方政策层面对基因治疗的大力支持。随着各地政府不断布局基因治疗产业,并在相应环节进行产业平台建设,基因治疗领域创新服务体系与产业生态正在逐步形成,我国基因治疗产业必将步入良性发展的快车道。
4.2 继续规范监管体系
与传统药物相比,基因治疗属新兴治疗技术,技术更迭速度快,涉及伦理法律等问题多,尤其存在安全风险,因此,监管难度较大,基因治疗产业的发展仍需继续完善监管体系。尤其在质量控制等方面,应加快建立成熟的第三方检测机构,并且要加强药企与药品监管机构的沟通。针对基因治疗产品存在的安全风险,国家药品监督管理局于2021年6 月起连续发布了多项法规,包括《嵌合抗原受体T 细胞(CAR-T)产品上市临床风险管理计划技术指导原则(征求意见稿)》、《基因治疗产品长期随访临床研究技术指导原则(试行)》、《药品生产质量管理规范-细胞治疗产品附录(征求意见稿)》,及《体内基因治疗产品药学研究与评价技术指导原则(试行)》等,旨在进一步规范行业发展、促进企业及早发现产品风险、确保上市后安全风险可控。
4.3 提高基因治疗药品可及性
基因治疗药品多用于治疗罕见病、肿瘤等疾病,价格昂贵。比如在国内率先上市的复星凯特的阿基仑赛注射液和药明巨诺的瑞基奥仑赛这两款CAR-T 细胞治疗产品,为复发难治性侵袭性非霍奇金淋巴瘤肿瘤患者带来希望的同时,也因其高昂的定价使部分患者望而却步。虽然美国、英国等多个国家已将CAR-T 治疗产品纳入医保,但由于缺乏III 期临床试验数据,其长期的安全性和长期疗效尚未得到证实。实际上,我国在基因治疗药物进入医保做了大量工作,并卓有成效。2021 年12 月,用于治疗脊髓型肌萎缩症(SMA)的靶向基因治疗药物——诺西那生钠进入医保,并且价格由2019 年进入中国市场时的70 万元降至3.3 万元,为SMA患儿带来生的希望。2022 年5 月,国内上市的两款CAR-T 治疗药物也被纳入“沪惠保”。相信随着长期疗效和安全性得到进一步证实,以及通用CAR-T等药物的研发上市,未来将会有更多的基因治疗药物进入医保,惠及患者。

