蜂斗菜总内酯对常压缺氧小鼠的保护作用研究
李炳锋,段雅倩,王 旭,郭美丽,高 越,1b (1. 海军军医大学:a. 药学院, b. 第一附属医院临床研究中心, 上海 00433;. 中国人民解放军63600 部队医院, 甘肃 酒泉 73750)
氧气是生命活动的基本物质,在机体内主要参与能量代谢过程。作为一种至关重要的生命物质,氧气在多个层面影响着机体,甚至可以通过多种渠道影响基因[1]。Kirmes 等的研究表明:在缺氧条件下,细胞在全基因组水平上会产生结构变化,染色质会发生聚集现象[2]。机体缺氧时,通过氧化呼吸链产生过多的活性氧簇(ROS),包括超氧阴离子、过氧化氢、羟自由基等。ROS 不仅可以直接损伤脂质、蛋白质及核酸等生物大分子,还可以通过Fas/FasL、TNF-α/TNFRl、MAPK 等信号通路诱导细胞凋亡[3-4]。目前,针对缺氧的防治,西药主要有碳酸酐酶抑制剂、糖皮质激素、茶碱等,中药较为成熟的有藏药红景天,胡黄连、黄芪等也被认为具有一定的抗缺氧损伤的能力[5]。乙酰唑胺作为FDA认可的唯一一种防治急性缺氧的药物,更多的是用来治疗急性缺氧,且其存在过敏反应、四肢麻木、疲劳、困倦等不良反应,肝肾功能异常的人不宜使用[6-8]。藏药红景天目前已被高原边防部队作为防治高原缺氧的常规药物。大部分学者认为红景天可以通过抑制氧化应激、抗凋亡、保护神经细胞等方式治疗缺氧性损伤,但其主要活性成分的抗缺氧作用机制仍不清楚[9]。作为预防用药,红景天需要提前7~15 d 服用,才能较好起到提高抗缺氧能力的作用,疗程较长。目前,针对缺氧的治疗仍以给予高浓度氧气最为直接有效,而对于提高耐缺氧能力,目前尚无安全高效的药物。
毛裂蜂斗菜(Petasites tricholobuson)是菊科蜂斗菜属下的一种,在民间广泛用于消肿止痛、解毒祛瘀,治跌打损伤、毒蛇咬伤等。课题组前期实验已经证明,其醇提取物具有抗炎作用[10-12]。本实验通过观察PTB 对小鼠存活时间、血清乳酸脱氢酶(LDH)活性和丙二醛(MDA)含量变化,对脑组织与心脏超氧化物歧化酶(SOD)和还原型谷胱甘肽(GSH)活性变化、脑组织病理变化,以及对大鼠肾上腺嗜铬细胞瘤细胞(PC12)制成糖氧剥夺模型(OGD)后存活率的影响,进一步探讨PTB 的抗缺氧能力及可能的作用机制。
1 材料与方法
1.1 动物与细胞株
昆明种小鼠110 只,雄性,SPF 级,体质量23~25 g,合格证号:SCXK(京)2019-0010(斯贝福生物技术有限公司),饲养于清洁级动物房,人工照明模拟昼夜变化;PC12 细胞(美国ATCC 细胞库)。
1.2 药物
蜂斗菜总内酯(自提):经高效液相色谱(HPLC)检测,蜂斗菜总内酯含量为74.8%,其中,内酯B、内酯Ⅲa、内酯Ⅳa 的含量分别为13.4%、46.8%、14.6%,各单体成分分子结构式均已明确[13];诺迪康胶囊(规格:0.28 g/粒,西藏诺迪康药业股份有限公司,批号:200402);0.9%氯化钠溶液(500 ml,济民健康管理股份有限公司,批号:S200516E52);LDH 试剂盒、GSH 试剂盒、总蛋白定量测试盒、MDA 试剂盒、SOD 测试盒(南京建成生物工程研究所),规格:96T,批号:20210914、20211012、20210603、 20211012、 20211012; MTT( 3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide)(美国Sigma 公司);高糖DMEM 培养基、胎牛血清(美国Hyclone 公司);混合气体(95%N2,5%CO2)(上海成功气体工业有限公司);CO2气体(海军军医大学热卫系)。
1.3 仪器
全自动酶标仪、1 300 SERIES A2 型超净台(美国Thermo 科技公司);SHIMADZU LC-20 高效液相色谱仪(岛津有限公司);Pico17 高速离心机(ThermoFisher 科技公司);L-420 低速离心机(湘仪离心机仪器有限公司);Tissuelyser-48 多样品组织研磨机(上海净信实业发展有限公司);DHG.9.23A 型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);DK-8D 型电热恒温水槽(上海一恒科技有限公司)。
1.4 实验方法
1.4.1 分组及给药
小鼠适应性饲养3 d,常规进食,自由饮水。根据预实验结果,采用随机数字法将小鼠分为空白对照组、模型组、阳性对照组(诺迪康280 mg/kg)、PTB 低剂量组(20 mg/kg)、PTB 中剂量组(40 mg/kg)、PTB 高剂量组(80 mg/kg),其中空白对照组10 只小鼠,其余各组20 只小鼠。适应性饲养3 d 后,按照小鼠质量10 ml/kg 灌胃给药,连续给药3 d,空白对照组和模型组给予等体积的溶剂CMC-Na。本实验过程遵守动物福利、动物保护和伦理原则及相关规定。
1.4.2 常压缺氧实验
第3 天给药1 h 后,除空白对照组外,取其余每组小鼠各10 只分别置于125 ml 磨口广口瓶中(瓶内放置5 g 钠石灰,用于吸附CO2),瓶口涂抹凡士林保证绝对密封,自盖上瓶盖开始计时,以小鼠呼吸心跳停止为小鼠窒息死亡判定依据,记录并统计各组小鼠死亡时间。
1.4.3 取材
根据小鼠常压密闭缺氧实验结果,将小鼠最短死亡时间(12 min)设为时间节点。除空白对照组外,将其余5 组剩余小鼠分别置于125 ml 磨口广口瓶中(瓶内放置5 g 钠石灰,用于吸附CO2),瓶口涂抹凡士林保证绝对密封。自盖上瓶盖开始计时,到达时间节点后立即将小鼠取出,眼眶取血,血液样品放置于冰盒中保存。空白对照组于常压未缺氧条件下直接眼眶取血。各组小鼠眼眶取血后,立即脱颈处死,解剖并小心分离出脑组织,于冰盘上快速分离出右侧大脑半球,置4%多聚甲醛固定液中。左侧大脑半球保存在清洁干燥离心管中。脑组织固定后,解剖分离出小鼠心脏,用生理盐水充分灌洗后,用清洁滤纸吸干。所有样品均放置于液氮中临时保存。
1.4.4 脑组织病理染色
将各组小鼠右侧大脑半球切片制作成石蜡切片,分别通过脱蜡、染色、分化、封片等步骤,进行HE 和尼氏染色。染色切片制作完成后进行显微镜镜检,图像采集分析。
1.4.5 生化指标检测
将取得的血液样品进行离心处理(4 000 r/min,10 min),取上清液进行LDH 活性、MDA 含量的测定。将取得的心脏、左侧大脑半球称重,按照组织与生理盐水1∶9 的比例,低温条件下制成10%的组织匀浆,进行SOD、GSH 活性的测定。MDA 含量、LDH 活性、SOD 活性、GSH 活性的检测按照试剂盒说明书进行。
1.5 体外实验
1.5.1 大鼠肾上腺嗜铬细胞瘤细胞(PC12 细胞)的培养
将PC12 细胞置于CO2细胞培养箱内培养(95%空气和5%CO2,37 ℃,饱和湿度),培养基由90%高糖DMEM 和10%胎牛血清(FBS)组成,每3 d 更换新的培养基。当细胞的生长达到80%~90%汇合度时,对细胞进行传代培养。细胞传代时,先弃去培养瓶内的培养基,用磷酸盐缓冲液(PBS)冲洗2 次,加入不含EDTA 的胰酶消化细胞,按照1:4 的比例进行传代分瓶培养。待细胞生长状态稳定处于对数期生长时进行后续实验。
1.5.2 药物配制
称取适量蜂斗菜总内酯,加入无糖培养基配制成2000 ng/ml 的溶液。按照比例,用无糖培养基将液体分别稀释为200 ng/ml 和20 ng/ml 的溶液。
1.5.3 PC12 细胞氧糖剥夺模型(OGD)的建立及药物处理
待铺于细胞培养板内的细胞汇合度达到80%且生长状态良好时,将原有培养基弃去,PBS 冲洗2 次后,模型组加入无糖培养基,给药组加入含有不同浓度PTB(20 、200、2000 ng/ml)的无糖培养基,置于缺氧装置(95% N2,5% CO2)内缺氧2 h 后,将该装置移入37 ℃的恒温培养箱继续孵育12 h形成OGD 模型。空白对照组照常更换培养基一次,在正常细胞培养环境下培养。
1.5.4 MTT 法检测细胞存活率
将状态良好的细胞以5×104个/ml 的密度铺于96 孔细胞培养板,MTT 法检测细胞存活率。MTT实验检测开始时,在各细胞培养孔中加入20 μl MTT 溶液(5 mg/ml, 即0.5%MTT),继续在37 ℃细胞培养箱内孵育4 h。弃细胞上清液,每个细胞孔加入150 μl DMSO 溶液,摇床上低速震荡10 min,使沉积在细胞内的结晶充分溶解。在酶标仪490 nm处测量各孔的吸光值(A值)。根据各组所得的A值,计算细胞的存活率,其中,未经OGD 处理的空白组细胞的存活率均一化为100%,其余各组细胞的存活率是相对于空白组比值的百分比。细胞的存活率=(A值实验组/A值空白组)×100%。
1.6 统计学处理
采用SPSS21.0 统计分析软件处理。计量资料数据以(±s)表示,组间比较采用单因素方差分析,当P<0.05 时,表示差异有统计学意义。
2 结果
2.1 PTB 对常压缺氧小鼠存活时间的影响
常压缺氧条件下,模型组小鼠的平均存活时间为859.5 s。与模型组相比,阳性对照组(诺迪康)小鼠的存活时间延长了131.9 s(P<0.05),PTB 低、中、高剂量均能显著延长小鼠的存活时间(P<0.05,P<0.01),结果见表1。
表1 PTB 对常压缺氧小鼠存活时间的影响(n=10, ±s)

表1 PTB 对常压缺氧小鼠存活时间的影响(n=10, ±s)
*P<0.05,**P<0.01,与模型组比较。
组别 给药剂量(mg/kg) 存活时间(t/s)模型组 - 859.5±84.56诺迪康组 280 991.4±140.7*PTB低剂量组 20 1 023±142.7**PTB中剂量组 40 980±120.5*PTB高剂量组 80 1 055±251.9*
2.2 PTB 对常压缺氧小鼠血清LDH 活力、MDA含量的影响
与空白对照组相比,模型组的LDH 活力明显增高(P<0.01);与模型组相比,阳性对照组(诺迪康)、PTB 中、高剂量组LDH 活力降低至空白组水平(P<0.05);低剂量组的LDH 活力较模型组有所降低,但没有统计学差异(P>0.05),见表2。
与空白对照组相比,模型组的MDA 含量显著增高(P<0.01);与模型组相比,阳性对照组(诺迪康)、PTB 低、中剂量组MDA 含量降低(P<0.05);PTB 高剂量组MDA 含量有所降低,但没有统计学差异(P>0.05),见表2。
表2 PTB 对常压缺氧小鼠血清LDH 活力和MDA 含量的影响(n=10, ±s)
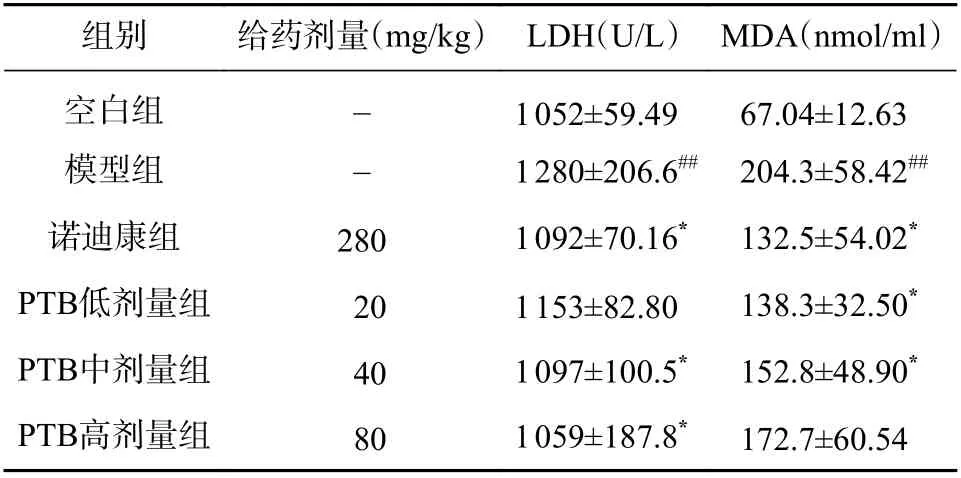
表2 PTB 对常压缺氧小鼠血清LDH 活力和MDA 含量的影响(n=10, ±s)
*P<0.05,与模型组比较;##P<0.01,与空白组比较。
组别 给药剂量(mg/kg) LDH(U/L) MDA(nmol/ml)空白组 - 1 052±59.49 67.04±12.63模型组 - 1 280±206.6## 204.3±58.42##诺迪康组 280 1 092±70.16* 132.5±54.02*PTB低剂量组 20 1 153±82.80 138.3±32.50*PTB中剂量组 40 1 097±100.5* 152.8±48.90*PTB高剂量组 80 1 059±187.8* 172.7±60.54
2.3 PTB 对常压缺氧小鼠脑组织、心脏的GSH活力的影响
在脑组织中,与空白对照组相比,模型组的GSH 活力降低(P<0.01);与模型组相比,阳性对照组(诺迪康)的GSH 活力有所升高,但是没有统计学差异(P>0.05);与模型组相比,PTB 低、中、高3 个剂量组的GSH 活力均显著升高(P<0.01),见表3。
在心脏中,与空白对照组相比,模型组的GSH 活力降低(P<0.05);与模型组相比,阳性对照组(诺迪康)的GSH 活力升高(P<0.05);与模型组相比,PTB 低、中、高3 个剂量组的GSH 活力均显著升高(P<0.01),见表3。
表3 PTB 对常压缺氧小鼠脑组织和心脏GSH 活力的影响(n=10, ±s)
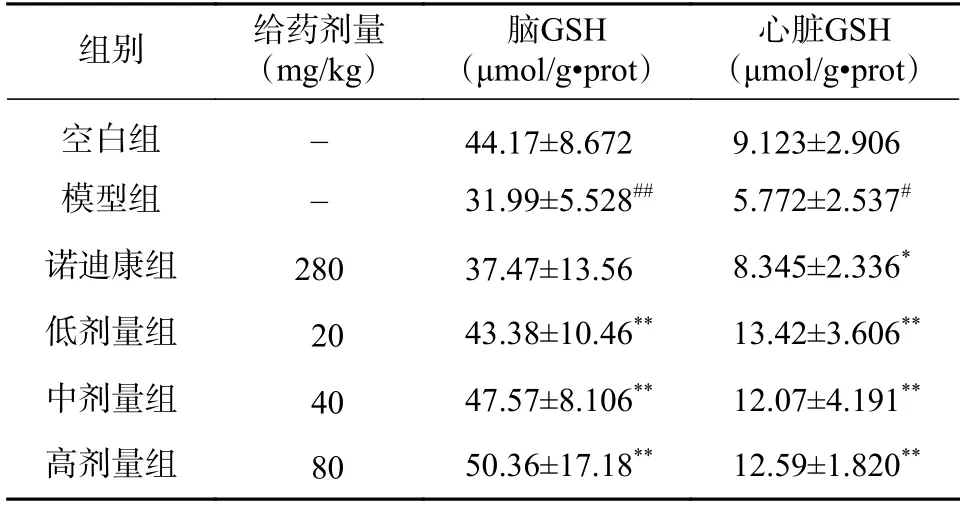
表3 PTB 对常压缺氧小鼠脑组织和心脏GSH 活力的影响(n=10, ±s)
*P<0.05,**P<0.01,与模型组比较;#P<0.05,##P<0.01,与空白组比较。
心脏GSH(μmol/g·prot)空白组 - 44.17±8.672 9.123±2.906模型组 - 31.99±5.528## 5.772±2.537#诺迪康组 280 37.47±13.56 8.345±2.336*低剂量组 20 43.38±10.46** 13.42±3.606**中剂量组 40 47.57±8.106** 12.07±4.191**高剂量组 80 50.36±17.18** 12.59±1.820**组别 给药剂量(mg/kg)脑GSH(μmol/g·prot)
2.4 PTB 对常压缺氧小鼠脑组织、心脏的SOD活力的影响
在脑组织中,与空白对照组相比,模型组的SOD 活力降低(P<0.05);与模型组相比,阳性对照组(诺迪康)的SOD 活力变化没有统计学差异(P>0.05);与模型组相比,PTB 低、中、高3 个剂量组的SOD 活力均显著升高(P<0.01),见表4。
在心脏中,与空白对照组相比,模型组的SOD 活力降低(P<0.05);与模型组相比,阳性对照组(诺迪康)、PTB 低、中、高3 个剂量组的SOD 活力均显著升高(P<0.01),见表4。
表4 PTB 对常压缺氧小鼠脑组织和心脏SOD 活力的影响(n=10, ±s)
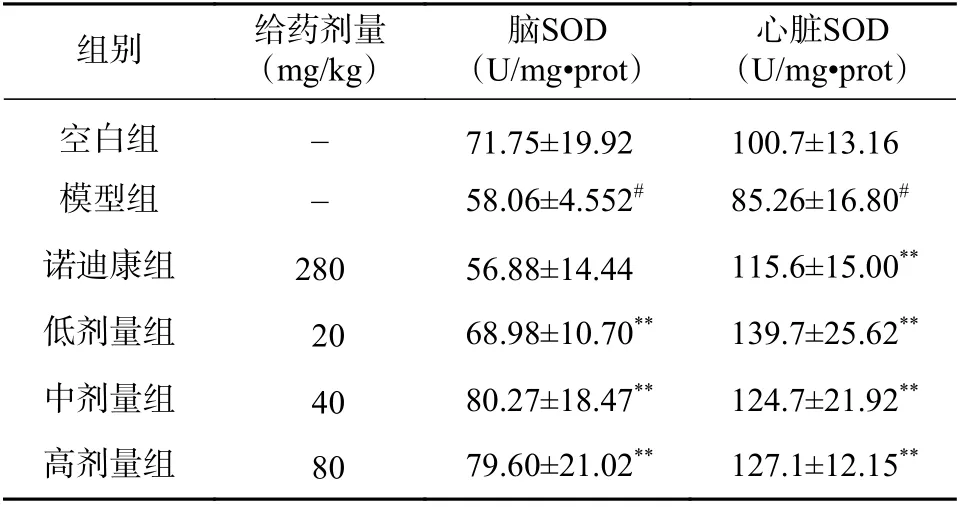
表4 PTB 对常压缺氧小鼠脑组织和心脏SOD 活力的影响(n=10, ±s)
**P<0.01,与模型组比较;#P<0.05,与空白组比较。
心脏SOD(U/mg·prot)空白组 - 71.75±19.92 100.7±13.16模型组 - 58.06±4.552# 85.26±16.80#诺迪康组 280 56.88±14.44 115.6±15.00**低剂量组 20 68.98±10.70** 139.7±25.62**中剂量组 40 80.27±18.47** 124.7±21.92**高剂量组 80 79.60±21.02** 127.1±12.15**组别 给药剂量(mg/kg)脑SOD(U/mg·prot)
2.5 PTB 对常压缺氧小鼠脑组织病理形态的影响
如图1 所示,与空白对照组相比,模型组小鼠神经细胞排列明显紊乱,细胞之间存在大量空泡(箭头所示);与模型组相比,阳性对照组及PTB中、高剂量组的小鼠脑组织排列较整齐,细胞间空泡较少,神经纤维束的走行较为整齐统一。
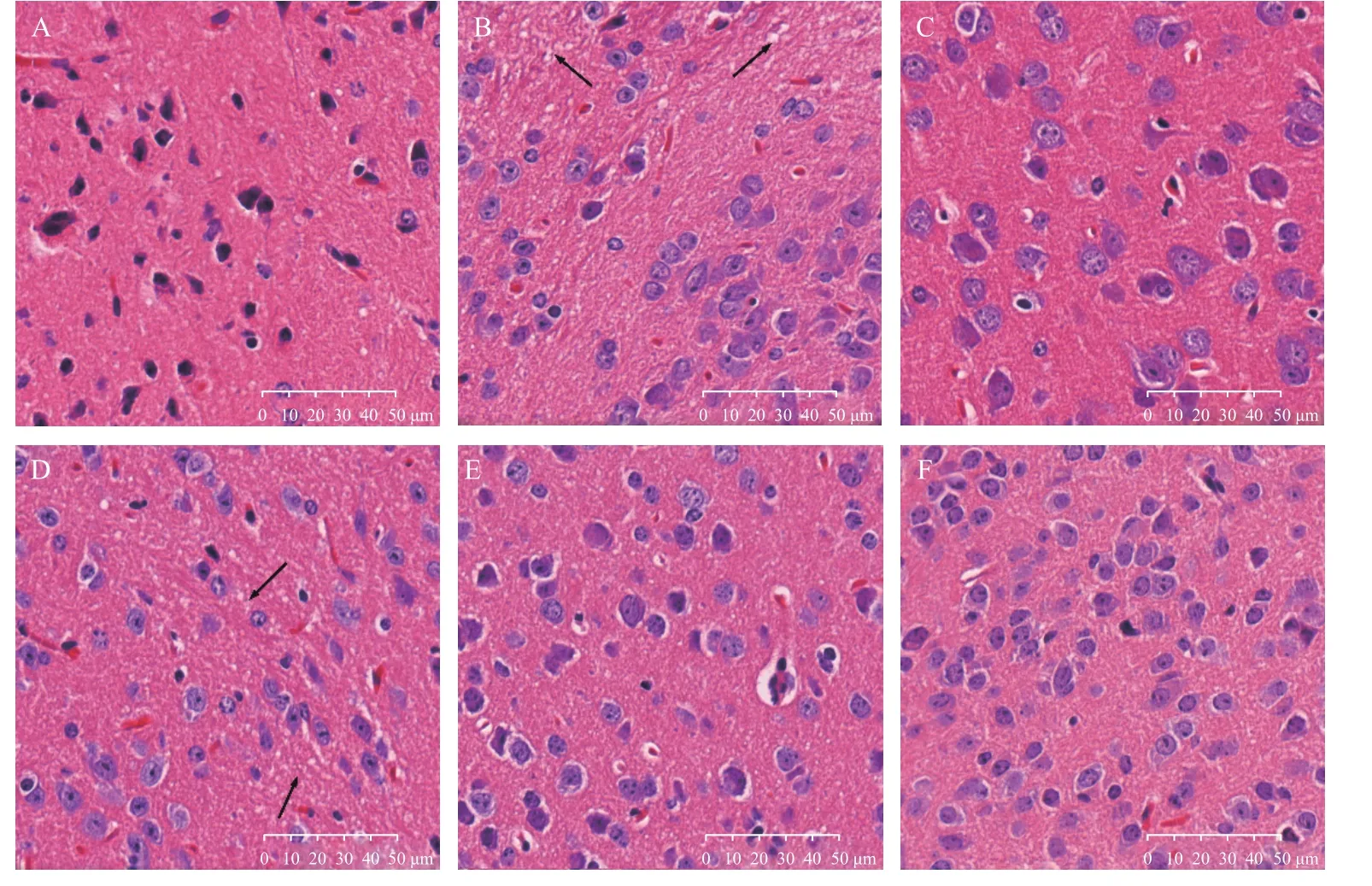
图1 HE 染色观察小鼠脑组织病理变化(40×)
尼氏染色下,与空白对照组相比,模型组海马区尼氏小体(箭头所示)明显减少,海马区细胞排列紊乱;与模型组相比,阳性对照组及PTB 各剂量组的尼氏小体明显增加,细胞排列规则,见图2。
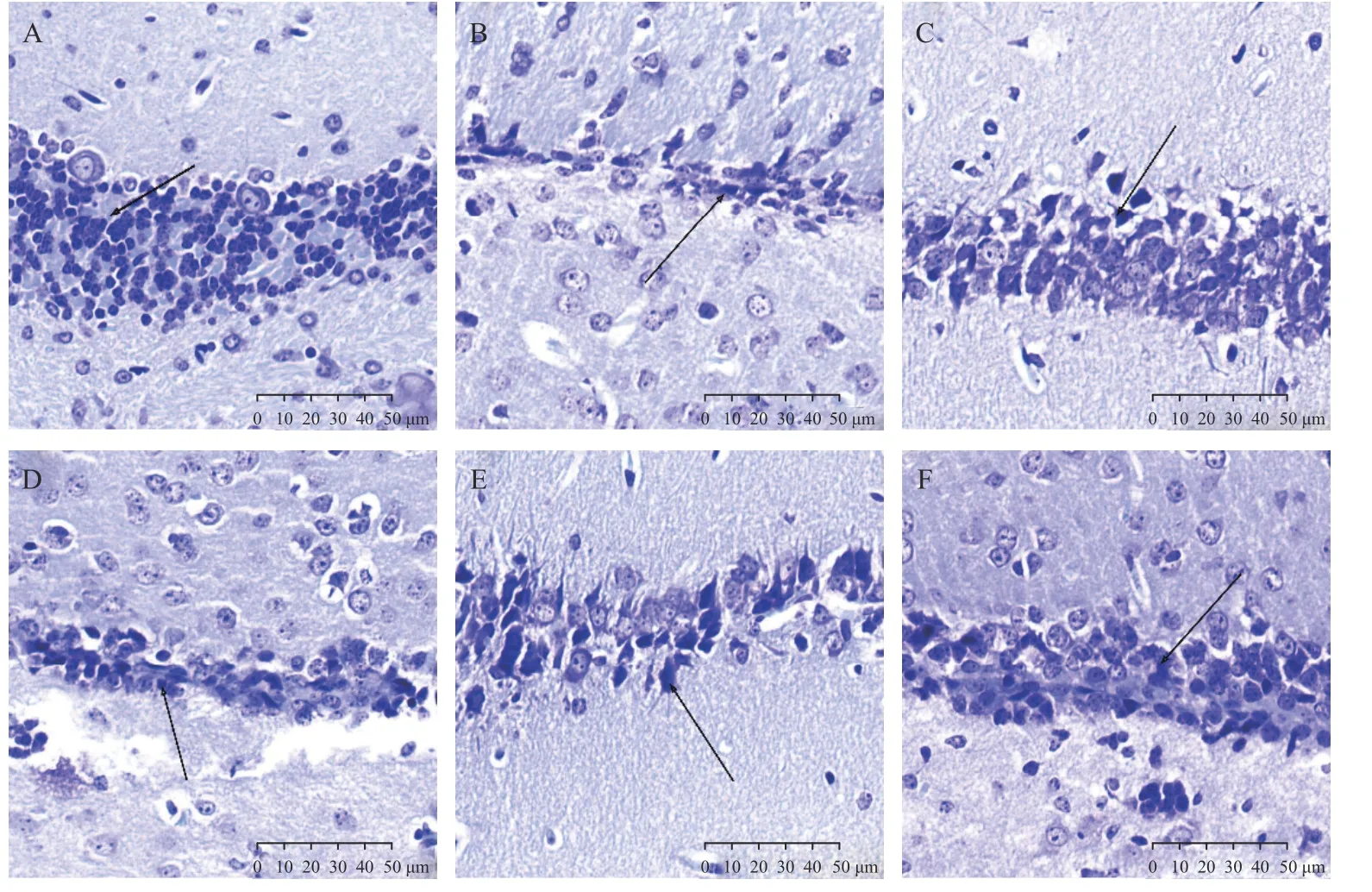
图2 尼氏染色观察小鼠脑组织病理变化( 40×)
2.6 PTB 对OGD 处理PC12 细胞存活率的影响
如表5 所示,空白组细胞存活率为100.00%,模型组细胞存活率下降至(37.26±3.80) %,与空白组相比存在非常显著性差异(P<0.001)。PTB 在20、200、2000 ng/ml 浓度下的细胞存活率分别为(46.08±4.91) %、(52.90±6.85) %、(61.09±3.53) %,各浓度组相对于OGD 组均有显著性差异(P<0.01,P<0.001,P<0.001)。
表5 PTB 对常压缺氧的PC12 细胞损伤存活率的影响( ±s)
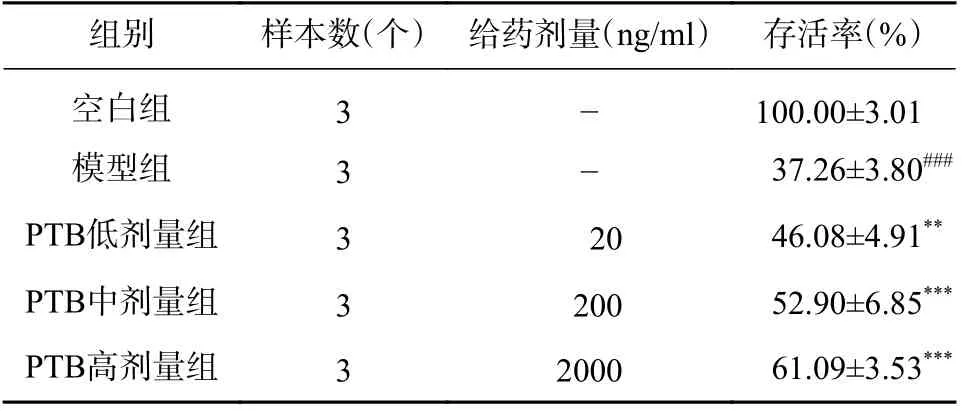
表5 PTB 对常压缺氧的PC12 细胞损伤存活率的影响( ±s)
组别 样本数(个) 给药剂量(ng/ml) 存活率(%)空白组 3 - 100.00±3.01模型组 3 - 37.26±3.80###PTB低剂量组 3 20 46.08±4.91**PTB中剂量组 3 200 52.90±6.85***PTB高剂量组 3 2000 61.09±3.53***
3 讨论
缺氧条件下,由于ATP 代谢障碍、机体代谢增强、体内Ca2+浓度增加等原因,产生过量的氧自由基。氧自由基通过损伤生物膜、蛋白质、DNA 和糖分子,影响细胞信号传导和细胞凋亡,对机体产生损伤[14-15]。
课题组前期通过建立减压缺氧模型,测定实验动物存活率、血糖、肝糖原、肌糖原、ATP、乳酸(LD)、LDH 等指标,论证了PTB 具有维持血糖稳定,提高机体主要脏器中的糖原以及ATP 的含量,减少LD 积蓄以及LDH 的活性,改善机体能量代谢的作用[13]。本论文采用常压缺氧模型进一步检测了在缺氧条件下,PTB 对实验动物体内SOD、GSH、LDH 活性、MDA 含量、脑组织病理改变、对OGD 处理后细胞存活状态等指标的影响,进一步完善了其对缺氧实验动物的保护作用。SOD 被认为是抗氧化系统的第一道防线,是一种能够专一清除氧自由基的酶。它通过降低氧化活性部位金属离子的活性,以两步快速反应使转变为H2O2和O2。H2O2再被过氧化氢酶还原成H2O[16-17]。GSH 是一种非酶性抗氧化剂,通过其巯基氧化-还原态的转换,作为可逆的供氢体,和过氧化物及自由基结合,保护细胞膜中含巯基的蛋白质不被破坏[18]。在本实验中,PTB 在低、中、高3 个剂量下,均能显著增强缺氧小鼠心、脑组织中SOD、GSH 的活性,提高机体清除氧自由基的能力,减轻缺氧损伤。
脂质过氧化物(LPO)是人体内多聚不饱和脂肪酸和氧自由基结合后形成的。在缺氧条件下,LPO水平升高,机体细胞及细胞膜产生氧化反应,溶解细胞膜表面的磷脂,破坏细胞膜的生理结构[19]。LPO 还能和细胞内的DNA、脂质、蛋白质形成复合物,刺激新陈代谢改变,导致细胞内信号传导的紊乱、功能障碍,甚至凋亡。MDA 是LPO 稳定的终产物[20]。LDH 是生物体内氧化还原的重要酶系之一,它能可逆地催化乳酸氧化为丙酮酸。当机体缺氧时,主要参与葡萄糖的无氧代谢。LDH 活性的升高是机体无氧酵解程度升高的重要提示之一[21]。在本实验中,PTB 中、高剂量组小鼠的血清LDH含量较模型组相比明显降低,说明中、高剂量组小鼠的无氧酵解相对较少,反应出机体缺氧程度较轻。低、中剂量组小鼠的MDA 含量较模型组相比明显降低,说明小鼠体内发生脂质过氧化反应相对较低。这说明PTB 可以抑制缺氧条件下机体的脂质过氧化反应,改善机体缺氧程度。
行为学实验结果显示,PTB 在各剂量下均可延长常压缺氧小鼠在密闭空间下的存活时间。脑组织HE 染色和尼氏染色表明,PTB 具有保护神经细胞,维持细胞形态及功能的作用。体外实验结果表明,PTB 在20、200、2000 ng/ml 浓度下均能够提高OGD 诱导的PC12 细胞损伤存活率,存在一定的剂量依赖性,说明PTB 对神经细胞的损伤具有保护作用。
综上所述,蜂斗菜总内酯具有明显的提高小鼠耐缺氧能力的作用,其作用机制可能与清除氧自由基、抑制脂质过氧化反应、保护神经细胞结构和功能有关。相比于藏药红景天,蜂斗菜总内脂的用药量明显减少,可作为抗缺氧的天然药物,进一步研究其作用的通路机制。

