肿瘤微环境的旁分泌型低丰度蛋白组检测的新液质联用方法
王小娟,黄雨娜,姚伟城,浮钰,岑美凤
肿瘤微环境是指肿瘤或癌症干细胞存在的细胞环境。肿瘤生长或转移的时候,肿瘤细胞所在组织的结构、功能和代谢,亦与肿瘤细胞自身的胞内基质和胞外基质有关[1]。肿瘤细胞的自分泌、旁分泌均可改变和维持自身生存微环境,促进肿瘤的生长和发展[2];有研究表明脂肪细胞分泌的激素、生长因子等可以通过旁分泌的形式进入血液,进而远程影响食管癌、肺癌等恶性肿瘤的能量代谢等相关活动[3]。分泌蛋白质组(secreted protein)包括细胞生长和趋化因子、激素和促激素、消化酶和合成酶、抗体和胞外毒素等功能各异的蛋白,与细胞粘连、转移、分化、增殖和免疫应答等多种生物学进程有关[4]。分泌蛋白已成为潜在肿瘤标志物的主要来源[5-10]。因此,利用分泌蛋白质组学技术对恶性肿瘤细胞分泌物进行系统深入的研究,不仅有助于全面理解、认识、分析与解释恶性肿瘤发生和发展的分子机制,对于肿瘤标志物的筛选,肿瘤的早期诊断、监测、治疗及抗肿瘤药物的研发等也具有重要指导意义。
蛋白质组学技术能够对某一基因所表达的对应蛋白质及其特征进行系统化研究,其高通量的特点[11]能够在蛋白质水平上解释复杂的生命活动分子网络[12]。目前,该技术已广泛地应用于药物合成与研发、药物药理和毒理学、疾病致病机理和治疗机理研究、临床生物医学研究等领域。在系统生物学中[13],蛋白质组学的变化是生物体受基因遗传、自身疾病以及外部环境等干扰后中间体的应答反应,分析在生物体的体液、细胞、组织或器官中的蛋白质产物,这些蛋白经基因组转录、转录组翻译和翻译后修饰的相关信息,有利于我们从蛋白质水平上解释生物体对外界干扰后产生的反应机制。然而,在细胞培养基中,被细胞分泌出的蛋白质[14],由于丰度较低且受到血清干扰等因素,为此类样本的蛋白质提取和分析带来了诸大的困难。
脂肪细胞是一种存在于许多不同组织中的基质细胞,在肿瘤微环境中发挥着积极作用,可通过分泌蛋白促进多种恶性肿瘤细胞的增殖与侵袭[15]。据报道,脂肪细胞分泌因子会影响乳腺癌的微环境,进而增加乳腺癌的发病、进展和转移的概率[16];脂肪细胞分泌含有circ-DB的外泌体调控肝细胞癌(HCC)的去泛素化,促进细胞的增殖[17];胰腺癌(PC)细胞的外泌体可以激活脂肪细胞,使其通过外泌因子IL-1b去分化来反过来维持PC细胞的生长和转移[18];脂肪细胞谷氨酰胺合成酶的异常分泌与结肠癌的腹腔转移及肿瘤的血管生成密切相关[19]。诸如上述可知,脂肪细胞对于肿瘤微环境和肿瘤生长转移具有重要的影响。
本研究将选用经药物处理后小鼠皮下脂肪细胞进行培养,采用液相色谱-质谱联用技术进行脂肪细胞的分泌型蛋白质鉴定。由于分泌型蛋白的含量较低、存在基质环境复杂,本文将分别探讨4D-Faims-OTIT、ETD-OTIT、OTIT三种采集方法对小鼠皮下脂肪组织的原代细胞培养基这一研究模型的蛋白质组进行解析,为外泌型低丰度蛋白质的鉴定和分析提供有效、高灵敏的检测方法,以辅助研究相关肿瘤的预防、临床诊断、治疗新方向。
1 资料与方法
1.1 实验材料和仪器
丙酮(A949,ThermoFisher),BCA蛋白定量试剂盒(23227,ThermoFisher),细胞培养基,乙醇(459828,2 L,Sigma),UA buffer(U820349,Sigma,8 M、PH 8.5),二硫苏糖醇溶液(D9779-1g,Sigma,质谱水配母液),碘乙酰胺溶液(V900335-5G,Sigma,50 mM碳酸氢铵配母液),胰蛋白酶Trypsin溶液(V5280,Promega,50 mmol/L乙酸复溶至1μg/μL),三 氟 乙 酸(85183,ThermoFisher),SPE萃 取 柱(186000383,Waters),恒温摇匀仪(thermomixer C,Eppendorf),肽段定量试剂盒(23275,ThermoFisher),液相色谱/质谱联用仪(Easy-nLC 1200 Orbitrap Fusion,ThermoFisher)。
1.2 实验方法
1.2.1 蛋白提取 C57/B6小鼠皮下脂肪组织S-FA7消化后提取的原代细胞扩增后,用1%FBS加入到DMEM细胞培养基中进行培养。本实验用2种不同药物处理方式得到S1组和S2组,每组各3份生物学重复。细胞培养24 h后取细胞培养基上清至50 mL离心管,置于-80℃中冷冻成块状后,转移到-80℃中真空浓缩成干粉。称取1 mg的冻干粉,加入100μL 50 mmol/L NH4HCO3溶液复溶,用BCA试剂盒检测蛋白浓度,取相当于50μg蛋白至新的1.5 mL离心管中,用50 mmol/L NH4HCO3补足至100μL,加入四倍体积的冰冷丙酮,涡旋后放于-20℃中过夜沉淀蛋白。
1.2.2 蛋白酶解 将-20℃过夜沉淀的蛋白,置于15 000×g,4℃下离心30 min,弃上清,交替使用500μL冰冷的丙酮溶液和500μL新鲜配制的70%乙醇溶液,分别清洗蛋白沉淀物,放置于15 000×g,4℃离心机下离心5 min,弃上清,置于-80℃冻干。加入50μL UA buffer,恒温摇匀仪(Eppendorf,thermomixer C)37℃、1300 r/min变性、溶解2 h。加入2μL二硫苏糖醇溶液,在37℃、1300 r/min的条件下进行2 h蛋白质还原反应。加入13μL碘乙酰胺溶液,放置于25°C,1300 r/min的条件下避光,进行蛋白烷基化反应45 min后,加入50 mmol/L NH4HCO3溶液至总体积600μL,再按1∶40(质量比,酶:蛋白)加入胰蛋白酶溶液,在37℃、1300 r/min的条件下孵育16 h,用三氟乙酸溶液酸化终止反应。
1.2.3 肽段脱盐 完成酶解反应后进行脱盐,步骤如下:活化和平衡SPE萃取柱(186000383,Waters),加入适量乙腈活化柱子,去滤液后,加入适量0.1%甲酸水溶液平衡柱子,去滤液。进行载样,每次取样品200μL加入到柱子,直至全部样品过完柱子;再次是脱盐,加入200μL 0.1%甲酸水溶液洗脱柱子,去滤液,重复操作2次。最后样品洗脱,分别取200μL 60%乙腈水溶液(含0.1%甲酸)、80%乙腈水溶液(含0.1%甲酸)、100%乙腈(0.1%甲酸)依次洗脱样品(不可更换顺序),重复操作2次,收集合并续滤液约1200μL,放置在真空浓缩仪中浓缩。
1.2.4 肽段检测前复溶方法 加入15μL 0.1%甲酸水溶液进行样本复溶,涡旋5 min混匀,置于15 000 r/min,4℃下离心30 min。取上清使用肽段定量试剂盒(PierceTMQuantitative Colorimetric Peptide Assay,23275,thermo Invitrogen)进行肽段浓度测试,并用0.1%甲酸水溶液稀释样品浓度至500 ng/μL。将稀释后的样品放在4℃的离心机中以15 000 r/min的转速离心5 min,取上清转至进样瓶中,进行LC-MS/MS分析(ThermoFisher Easy-nLC 1200-Orbitrap Fusion三合一质谱联用分析仪)。
1.3 LC-MS检测方法
使用非标记定量方法(Label Free)对细胞培养基中的蛋白进行分析,液相为Easy1200液相系统,填装一体C18 Tip色谱分析柱(75μm×150 mm,11.9μm,广州科福技术);适配流动相A:0.1%甲酸/水溶液;流动相B:0.1%甲酸、80%乙腈/水溶液,300 nL/min的流速,90 min梯度洗脱,洗脱比例如下:0~2 min,4%~8%B相;2~72 min,8%~28%B相;72~82 min,28%~38%B相;82~85 min,38%~100%B相;85~90 min,100%B相。
1.3.1 静电场轨道阱线性离子阱模式(Orbitrap ion trap,OTIT)离子源的参数设置为:正模式电压2100 V,毛细管温度320℃,一级分辨率为6e5,扫描范围为300~2000 m/z,采集模式是轮廓图。二级质谱的分辨率为1.5e5,四级杆的同位素隔离窗口是1.6 m/z,自动增益控制standard,注入时间选用dynamic,碰撞池HCD,碰撞能量30 V,二级检测器离子阱(Ion trap),采集模式是Centroid,循环扫描时间3 s。
1.3.2 电子转移裂解-静电场轨道阱线性离子阱模式(ETD-OTIT)基于OTIT模式下相同的离子源参数与一级Full MS参数,扫描范围200~2000;循环扫描时间3 s,二级ddMS2 OT-EThcD和ddMS2 IT-HCD模式:OT-EThcD的参数是ETD反应时间120 ms,最大注入时间150 ms,碰撞类型ETD叠加HCD,碰撞能量32%;ddMS2 IT-HCD模式的参数同OTIT模式一致。
1.3.3 梯度电压补偿-高场非对称波形离子迁移谱-静电场轨道阱线性离子阱模式(4D-Faims-OTIT)基于OTIT模式下相同的离子源参数与一级Full MS参数,增加4D-Faims组件,其参数设置Faims mode是Standard resolution,Faims Gas为0 L/min,三个一级Full MS-OT采集事件的Faims voltages为on,Faims CV值分别是-40 V、-60 V、-80 V;dd-MS2 IT-HCD模式的参数同OTIT模式一致。
1.4 数据分析
使用Proteome Discoverer 2.4(PD)软件对质谱的原始数据进行定性统计分析。软件检索参数设定为:最大漏切位点为3、母离子质量偏差为±10 ppm、固定修饰为半胱氨酸碘乙酰胺化、可变修饰为甲基化、磷酸化(Phospho/+79.966Da)、糖基化(Glycosyl/+148.037 Da)、氧化(Oxidation/+15.995 Da)、琥珀酰化(Succinyl/+100.016 Da)、赖氨酸乳酸化(Lactylation/+72.063 Da)和乙酰化(Acetyl/+42.011 Da,蛋白N端),使用UniProt蛋白质数据库(Uniprot-mouse-filtered-reviewed.fasta)进行搜索。
1.5 统计学分析
实验重复3次得到的数据使用GraphPad Prism 7.0进行统计学分析和作图。所有数据采用均值±标准差的方式表示,两组之间使用t检验进行统计分析。当P<0.05时,认为对比组之间的差异有统计学意义。
2 结果
2.1 总离子流(TIC)图和二级质谱图谱
图1所示,A图和B图分别是S1组和S2组在OTIT、ETD-OTIT、Faims-OTIT三种采集模式下得到的TIC图。结果显示,ETD的碎裂产生了更为丰富的修饰基团和c、z离子,结合OTIT组同时存在的b、y离子,使得ETD-OTIT组的TIC图更加丰富,而高场非对称波形离子迁移谱Faims的存在,使得干扰更少,TIC图背景更加干净。
三种采集模式得到的二级质谱图比对结果如图2所示,经纵向比对,三种采集模式得到的二级质谱图信息重复率不高,不可完全替代。OTIT采集模式的b、y离子信息丰富、ETD-OTIT采集模式的b、y、c、z离子相对较多,Faims-OTIT采集模式经过对杂质离子的过滤和筛选,TIC图谱背景干扰更少,能够得到更为可靠蛋白组信息。

图2 样本S1(A),S2(B)分别在OTIT、ETD-OTIT、Faims-OTIT三种采集模式的二级质谱图 A:样本S1三种采集模式的二级质谱图(MS2);B:样本S2三种采集模式的二级质谱图(MS2)
2.2 一级与二级质谱图数目,肽段鉴定,蛋白质组鉴定结果
使用Proteome Discoverer 2.4(PD)软件进行定性分析,结果显示,4D-Faims-OTIT采集模式下,图3-D和3-E分别是三种方法提取的一级质谱图(MS1)和二级质谱图(MS2)的数目比对图。结果显示,一级质谱采集中,结果大小依次为4D-Faims-OTIT>OTIT>ETD-OTIT。而在二级质谱离子鉴定数目中,结果大小依次为4D-Faims-OTIT>ETDOTIT>OTIT。肽段鉴定数目在4D-Faims-OTIT,OTIT和ETD-OTIT这三种模式下,S1样本分别为3124±61,1479±19和840±12,S2样本分别为2426±120,971±32和502±48(图3-B)。修饰位点在4DFaims-OTIT,OTIT和ETD-OTIT这三种模式下,S1样本分别为138±12,105±1和75±14,S2样本分别为122±15,66±15和42±7(图3-C)。蛋白质组和肽段鉴定数目大小结果依次为4D-Faims-OTIT>OTIT>ETD-OTIT,统计学分析表明,三者比较具有显著性差异,4D-Faims-OTIT是OTIT的2倍以上。S1样本中鉴定的蛋白质组数目为1040±21,S2样本中为851±31;OTIT采集模式下,S1样本为428±4,S2样本为290±10;ETD-OTIT采集模式下,S1样本为274±6,S2样本为192±14(图3-A)。
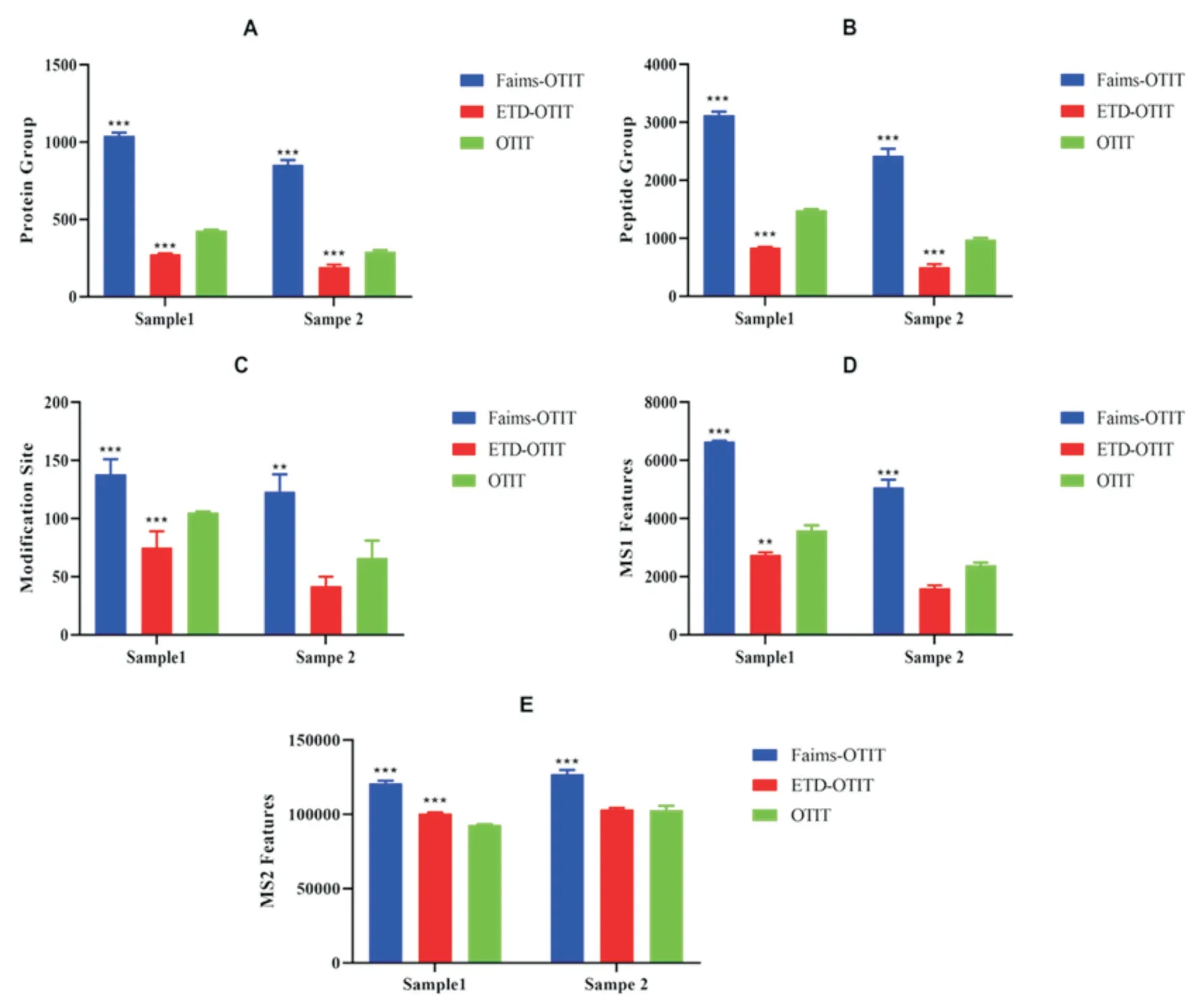
图3 三种采集模式下 鉴定到的蛋白组数目(A),肽段组(B),修饰位点(C),一级质谱特征数目(D),二级质谱特征数目(E);与OTIT组比较,*P值<0.05,**P值<0.01,***P值<0.001
针对两组样品S1和S2的蛋白鉴定结果进行组内并集后,再进行组内方法间的交集韦恩图,结果如图4显示,4D-Faims-OTIT采集模式下鉴定到的特异性蛋白分别占据了58.5%和63.2%,OTIT采集模式下鉴定到的特异性蛋白分别占据了5.2%和4.4%,ETD-OTIT采集模式下鉴定到的特异性蛋白分别占据了2.2%和1.6%。结果表明,4D-Faims-OTIT采集模式的优势比较明显,但是OTIT和ETD-OTIT这两种采集模式也各有优势,存在不可替代性。

图4 样本S1(A),S2(B)分别在OTIT、ETD-OTIT、Faims-OTIT三种采集模式的蛋白鉴定结果韦恩图
2.3 S1样本中分泌型蛋白鉴定分析结果
对S1样本中4D-Faims-OTIT鉴定到的分泌型蛋白进行归类,除自身生长所需的各类蛋白外,其他影响相关癌症病症的各类型酶(enzyme)有26种,各类生长因子(growth factor)有16种。如表1所示,影响结肠癌的标志物分泌因子有Q9Z0J7(GDF15)[5],影响肺癌的标志物分泌因子有P40224(CXCL12)[6],影响胰腺癌的标志物分泌因子有P18242(Cathepsin D)/P10605(Cathepsin B)[7],影响卵巢癌的标志物分泌因子有P70389、P47880等(Insulin-like growth factor)[8],影响肝癌的标志物分泌因子有P08226(Apolipoprotein E)/P21460(Cystatin C)[9-10]。肝癌的分泌因子标志物P08226对应的质谱检出谱图如图5所示,检出肽段是带+2电荷的ELEEQLGPVAEETR。

表1 S1样本肿瘤中潜在的标志物的旁分泌型蛋白结果

图5 样本S1检出的肝癌标志物P08226分泌因子对应的质谱
3 讨论
为深度解析脂肪细胞旁分泌的低丰度蛋白质,本实验以小鼠皮下脂肪原代细胞培养基样本为模型,使用丙酮沉淀法提取总蛋白,基于液相色谱-质谱联用OTIT,ETD-OTIT和4D-Faims-OTIT三种采集模式,对旁分泌型低丰度蛋白质进行检测。结果显示,4D-Faims-OTIT的方法对于蛋白质鉴定数目、肽段匹配鉴定数和修饰位点的鉴定都具有更深的覆盖,极大提升了修饰检测的灵敏度和深度。在二级质谱离子鉴定数目中,结果大小依次为4D-Faims-OTIT>ETD-OTIT>OTIT,这与OTIT采集模式下的b、y离子信息丰富,而ETD-OTIT采集模式下的b、y、c、z离子相对较多有关。
生物色谱-质谱联用分析技术现已广泛应用于肿瘤蛋白质组学的研究,当前新技术ETD的出现,不仅具备了碎裂过程基本不受肽的长度、序列的影响,基本保留了翻译后修饰的位点信息。对于非胰蛋白酶酶切的较长的高碱性肽和蛋白,能够产生丰富的离子信息,提高了蛋白质的鉴定覆盖度的优点,其获得二级离子的时间只需要100~300 ms,具有更高的检测通量特点[20]。而且,已报道出ETD在测定N-和O-糖基化修饰、磷酸化修饰、磺化修饰等翻译后修饰方面优势显著[20-22],ETD主要断裂主链,可以保留修饰的主链基团、得到丰富的b、y、c、z序列离子,结合碰撞池HCD产生的b、y序列离子,使得鉴定结果更加可靠与完整。而离子淌度(Ion Mobility)和高场非对称波形离子淌度迁移谱(Faims)技术的应用,四维蛋白质组学(4D-Proteomics)研究也正式发展起来。4DProteomicsTM[5,6]是在3D分离即保留时间、质荷比、离子强度的基础之上扩展的第四个维度。离子淌度的分离功能是从质谱的扫描速度、灵敏度上提升蛋白质组学的蛋白鉴定数量、定量准确性等性能。同时,Faims技术具有明显减少单电荷离子的干扰,显著提高分析选择性等特点,显著提高了蛋白质的鉴定深度[7,8]。
本次实验对S1样本鉴定到的分泌型蛋白进行归类,除自身生长所需的各类蛋白外,鉴定到多种外科肿瘤疾病的标志物。其中,影响相关癌症的各类型酶(enzyme)有26种,各类生长因子(growth factor)有16种。如结肠癌的分泌因子Q9Z0J7(GDF15),肺癌的分泌因子P40224(CXCL12),胰腺癌的分泌因子P18242(Cathepsin D)/P10605(Cathepsin B),卵巢癌的分泌因子P70389、P47880等(Insulin-like growth factor),肝癌的分泌因子P08226(Apolipoprotein E)/P21460(Cystatin C)。这些结肠癌、肺癌、胰腺癌、卵巢癌、肝癌等外科疾病标志物的发现,有利于研究各类肿瘤疾病中肿瘤微环境的细微改变对肿瘤生长或凋亡速度、侵袭和转移速度的改变影响,从而为研究找出肿瘤潜在的治疗靶点起着重要的作用[5]。
综上所述,4D-Faims-OTIT对于蛋白质,肽段匹配和修饰位点鉴定数目都具有更深的覆盖度,具有明显的提升率,且对杂质离子的过滤和筛选,TIC图谱背景干扰更少,能够得到更为可靠蛋白组信息,对于脂肪细胞的分泌型蛋白质影响肿瘤微环境的研究有着重要的意义。因此,该检测方法在相关肿瘤疾病蛋白质组学的研究方面具有明显的辅助功能和优势。
4 结论
本实验基于LC-MS/MS分析技术,使用4DFaims-OTIT、ETD-OTIT、OTIT三种采集方法检测C57/B6小鼠皮下脂肪组织S-FA原代细胞培养基的低丰度蛋白质组。结果显示,4D-Faims-OTIT采集方法能够高效灵敏地检测低丰度蛋白质,具有稳定的数据提升率、普遍的样本类型适用性等特点,对于蛋白鉴定深度,肽段鉴定数和修饰位点都具有明显优势。该方法对于旁分泌型低丰度蛋白的检测有着较高的灵敏度,对于研究脂肪细胞的旁分泌型低丰度蛋白质组影响肿瘤的微环境起着重要的作用。因此,有助于结直肠癌、肺癌和卵巢癌等疾病机理的研究。

