冻融作用对金川泥炭沼泽土壤酶活性的影响
郭 彤,孙嘉鸿,徐志伟,*,王升忠,董彦民
1 东北师范大学地理科学学院,长白山地理过程与生态安全教育部重点实验室, 长春 130024
2 东北师范大学泥炭沼泽研究所,长白山湿地与生态吉林省联合重点实验室, 长春 130024
3 东北师范大学国家环境保护湿地生态与植被恢复重点实验室, 长春 130024
冻融是指土层由于温度降到0℃以下和升至0℃以上而产生冻结和融化的一种物理地质作用和现象。土壤的冻结和融化实质是水分的相态变化过程[1],且广泛存在于中、高纬度以及高海拔地区[2—3]。全球受冻融作用影响的陆地面积约占陆地总面积的55%—70%,因此冻融作用对人类的生产活动和生存环境产生重要影响[4—5]。冻融作用强烈地改变土壤理化性质[6—7],影响微生物活性[8],从而影响土壤碳、氮生物地球化学过程[9]。
土壤酶是生态系统碳、氮循环的重要参与者,对温度的变化十分敏感。土壤碳库变化主要发生在活性碳库中易被土壤微生物分解矿化,对植物和微生物产生较高有效性的那部分有机碳,其中可溶性有机碳(DOC)和微生物量碳(MBC)是重要的表征指标[10]。大部分的研究表明,室内冻融模拟实验对活性碳库的影响比较显著[10—12]。同时,冻融作用是作用于土壤的非生物应力[13],对土壤氮素迁移转化乃至整个生态系统的氮循环过程具有十分重要的调控作用[14—15]。土壤碳及养分的转化速率与土壤酶活性的高低直接相关[16—18]。先前研究结果发现,土壤酶对冻融作用的响应受到酶活性的检测方法、土壤理化性质与土壤酶的种类的不同而存在差异[19—21]。沼泽土壤纤维素酶、淀粉酶和转化酶活性在冻融作用影响下呈现出降低或先降低后增加的变化趋势[22—23]。同时,冻融作用对深层土壤酶活性的影响更大,酶活性强度变幅更大[22]。以往的研究多关注于与碳循环有关的酶如转化酶、纤维素酶等[23—24],对与碳、氮、磷循环相关的水解酶以及在泥炭地分解中起重要作用的氧化酶关注较少。在全球变暖趋势下,季节性冻土区泥炭沼泽土壤的冻融频次、冻融温度和冻融时间都将产生变化。然而,这些改变将如何影响泥炭沼泽土壤活性有机碳氮和土壤酶活性,进而影响区域土壤碳库平衡和气候变化,仍需进一步研究。
长白山地泥炭沼泽区是我国泥炭沼泽最主要的分布区之一,该区泥炭泥炭平均覆盖度0.19%,最强覆盖度为0.76%[25]。同时,该地区位于东北及华北北部温带中-深季节冻土亚区,冻融作用频繁。本研究以金川泥炭沼泽为研究对象,分别在采样地采集表层(0—15 cm)和深层(15—30 cm)的土壤样品,通过室内冻融模拟实验,测定土壤活性有机碳、氮组分及水解酶和氧化酶活性,揭示不同冻融模式下泥炭沼泽土壤酶活性的的变化特征,并结合土壤有机碳、氮组分,探讨泥炭沼泽土壤酶活性的影响因素。研究有助于了解全球气候变化背景下,冻融作用对泥炭沼泽碳排放过程影响的酶学机制,为东北地区泥炭沼泽土壤碳收支估算提供了科学依据。
1 材料与方法
1.1 研究区概况
金川泥炭沼泽(42°20′42.58″—42°21′9.27″N,126°21′48.61″—126°22′37.74″E)位于长白山西麓龙岗山脉中段,海拔为613—616 m,泥炭层厚度一般为4—6 m。该区属温带季风气候,年均温为3.3℃,年降水量为1054 mm,降水集中在7—8月,7月最高平均气温为22.4℃,1月最低平均气温为-18℃。该区一般初霜在9月中旬,终霜在5月中下旬,无霜110—120 d,5—9月积温2500—2600℃。受到水文条件的制约,主要植物群落类型为居中且占优势的臌囊薹草群落和分布在外缘的油桦群落[26—27]。
1.2 样品采集与处理
在金川泥炭沼泽中心部位设置3个间隔50 m的5 m×5 m采样点,采用多点混合法于2019年1月份利用泥炭钻(油气钻),采集0—15 cm和15—30 cm的土壤样品,装入自封袋,尽快带回实验室并放4℃冷藏保存。培养实验前,去除土壤中的杂草和植物根系,并分别将两个土层的样品混合均匀,4℃冷藏备用。另取一部分土壤自然风干,研磨后过100目筛,用于土壤理化性质的测定,土壤理化性质见表1。

表1 土壤基本理化性质
同列不同小写字母表示差异显著(P<0.05)
1.3 培养实验与测试
称取50 g(相当于风干土重)混合均匀的土壤样品置于500 mL玻璃培养瓶中,用去离子水调节土壤含水量为最大持水量的60%,为使微生物恢复到正常状态,在室温(20℃)条件下预培养1周,同时定期称重并补充损失的水分。根据冻融期间金川泥炭沼泽实际温度,设置(-5—5℃)与(-10—10℃)两个冻融幅度,根据全球气候变暖的背景下气温升高幅度设定-5℃,-10℃则与当地冬季的平均气温较为接近。即把土壤样品分别放入-5℃和-10℃低温培养箱中培养24 h,再分别调节温度为5℃和10℃使其融化24 h,作为一次冻融循环。本实验设置15次冻融循环,共培养30 d。准备好足够数量的培养瓶土壤样品,培养过程中,分别在冻融循环的第0、1、3、5、7、15次后不放回的取出培养瓶,每次取出每个土层每个冻融处理的3个培养瓶,作为3个重复。取出培养瓶的时间前后不超过5 min,各冻融处理的时间保持一致。测定土壤酶活性(水解酶和氧化酶)、土壤可溶性有机碳、氮(DOC和DON)和微生物碳、氮(MBC和MBN)指标。
土壤β- 1,4-葡萄糖苷酶(BG)、β- 1,4-N-乙酰葡糖胺糖苷酶(NAG)和酸性磷酸酶(AP)等3种水解酶活性采用微孔板荧光法测定[28],利用多功能酶标仪(Cytation 5,BioTek)。采用4-甲基伞形酮酰-B-D-吡喃葡糖酸苷为BG酶的底物,采用4-甲基伞形酮酰-B-D-吡喃葡糖酸为NAG酶的底物,采用4-甲基伞形酮磷酸酯为AP酶的底物。首先,称取培养后的鲜土样0.5 g加入烧杯中,加入125 mL的50 mmol/L醋酸钠缓冲液(pH=5),用磁力搅拌器搅拌均匀,以制备土壤悬浮液。吸取200 μL土壤悬浮液和以上3种土壤酶对应的底物50 μL,加入微孔板中于20℃黑暗条件下培养4 h。培养结束后,在每个孔中加入10 μL的1 mol/L的NaOH 溶液,1 min后进行荧光检测。标准物为4-甲基伞形酮,在365 nm波长处激发,在450 nm波长处测定。每个样品重复测定8次。
土壤氧化酶(多酚氧化酶(PPO)和过氧化物酶(PER))活性也利用多功能酶标仪进行测定。采用L- 3,4-二羟基苯丙氨酸(L-dihydroxyphenylalanine,L-DOPA)为两种氧化酶的底物。首先,称取培养后的鲜土样1.5 g,制备土壤悬浮液的其余步骤与水解酶相同。吸取600 μL土壤悬浮液和150 μL底物于深孔板内用于测定PPO酶活性,PER酶活性还需另加30 μL 0.3%的H2O2,在20℃黑暗条件下培养5 h。停止培养,以3000 r/min离心5 min后,转移上清液250 μL至浅口透明板中,在460 nm波长下测定吸光值。
土壤微生物量碳氮采用氯仿熏蒸 0.5 mol/L K2SO4浸提法[29—30]。取10 g土壤样品用三氯甲烷熏蒸24 h,用0.5 mol/L的K2SO4浸提熏蒸与未熏蒸的样品30 min,采用总有机碳分析仪(Multi N/C 2100 TOC,德国耶拿)测定浸提液总有机碳浓度,由熏蒸与未熏蒸土样浸提液的浓度差值计算得到MBC,转换系数0.45[31],熏蒸与未熏蒸土样浸提液的浓度差值计算得到MBN,转换系数 0.54[31]。土壤可溶性有机碳氮:称取1 g新鲜土样置于50 mL离心管,加入50 mL去离子水后充分震荡5 h,用离心机转速8000 r/min离心5min,取上清液过0.45 μm滤膜进行真空抽滤,采用总有机碳分析仪(Multi N/C 2100 TOC,德国耶拿)测定[32]。
1.4 数据处理
采用单因素方差分析方法,分析不同冻融模式下土壤活性有机碳、氮组分和酶活性的差异,并辅以Levene方差齐性检验。采用双因素方差分析法,分析不同深度下,冻融幅度和冻融频次对土壤酶活性及土壤活性有机碳、氮组分的交互影响。采用 Pearson相关分析法,分析土壤酶活性与土壤活性有机碳、氮组分的关系。在 SPSS 22.20 软件进行统计分析,并利用Origin 2019绘图。
2 结果与分析
2.1 冻融作用下土壤活性有机碳、氮变化特征
-5—5℃冻融模式下,随着冻融频次的增加,两层土壤DOC和DON 含量均表现为先增加、后减少、再增加的变化趋势。-10—10℃冻融模式下则表现为先增加后减小的变化趋势,并在3次冻融循环后达到最大值。-5—5℃冻融模式下,与冻融前相比,15次冻融循环结束后0—15 cm和15—30 cm土壤DOC含量分别增加了33.2%和138.5%,而DON含量分别增加了36.4%和33.9%(图1)。-10—10℃冻融模式下,与冻融前相比,0—15 cm土壤DOC含量减少了33.2%,15—30 cm土壤DOC含量增加了30.2%,0—15 cm土壤DON含量增加了41.9%,15—30 cm土壤DON含量减少了9.2%(图1)。冻融幅度、冻融频次以及二者的交互作用均对土壤DOC与DON含量有显著影响(P<0.05)(表2)。实验结果表明,-5—5℃的冻融作用对DOC与DON的影响大于-10—10℃的冻融作用。随着土层深度的增加,土壤DOC的变化幅度表现为0—15 cm<15—30 cm,但对DON的影响表现为0—15 cm>15—30 cm。

表2 冻融幅度和冻融频次对土壤活性有机碳、氮含量影响的方差分析

图1 -5—5℃和-10—10℃处理下不同冻融频次土壤可溶性有机碳、氮的变化Fig.1 Variations in the soil dissolved organic carbon and nitrogen concentrations under different freezing-thawing times in -5—5℃ and -10—10℃不同大写字母表示同一次取样两种深度之间差异显著(P<0.05);不同小写字母表示同一深度在冻融频次上的差异显著(P<0.05);图中数据为平均值±标准偏差(n=3);DOC:可溶性有机碳 dissolved organic carbon;DON:可溶性有机氮dissolved organic nitrogen
两种冻融模式下,随着冻融次数的增加,0—15 cm和15—30 cm土壤MBC含量均表现为逐渐增加的变化趋势。在-5—5℃冻融模式下,与冻融前相比,0—15 cm和15—30 cm土壤MBC含量分别增加了80.2%和100.6%,而土壤MBN含量分别减少了5.6%和60.6%(图2)。在-10—10℃冻融模式下,与冻融前相比,0—15 cm和15—30 cm土壤MBC含量分别增加了434.8%和479.0%,而土壤MBN含量分别减少了63.0%和54.4%(图2)。冻融幅度和冻融频次以及二者的交互作用均对土壤MBC和MBN含量具有显著影响(P<0.05)(表2)。实验结果表明,冻融幅度对土壤MBC和MBN含量的影响表现为-5—5℃<-10—10℃。随着土层深度的增加,土壤MBC和MBN含量的变化幅度均表现为0—15 cm<15—30 cm。
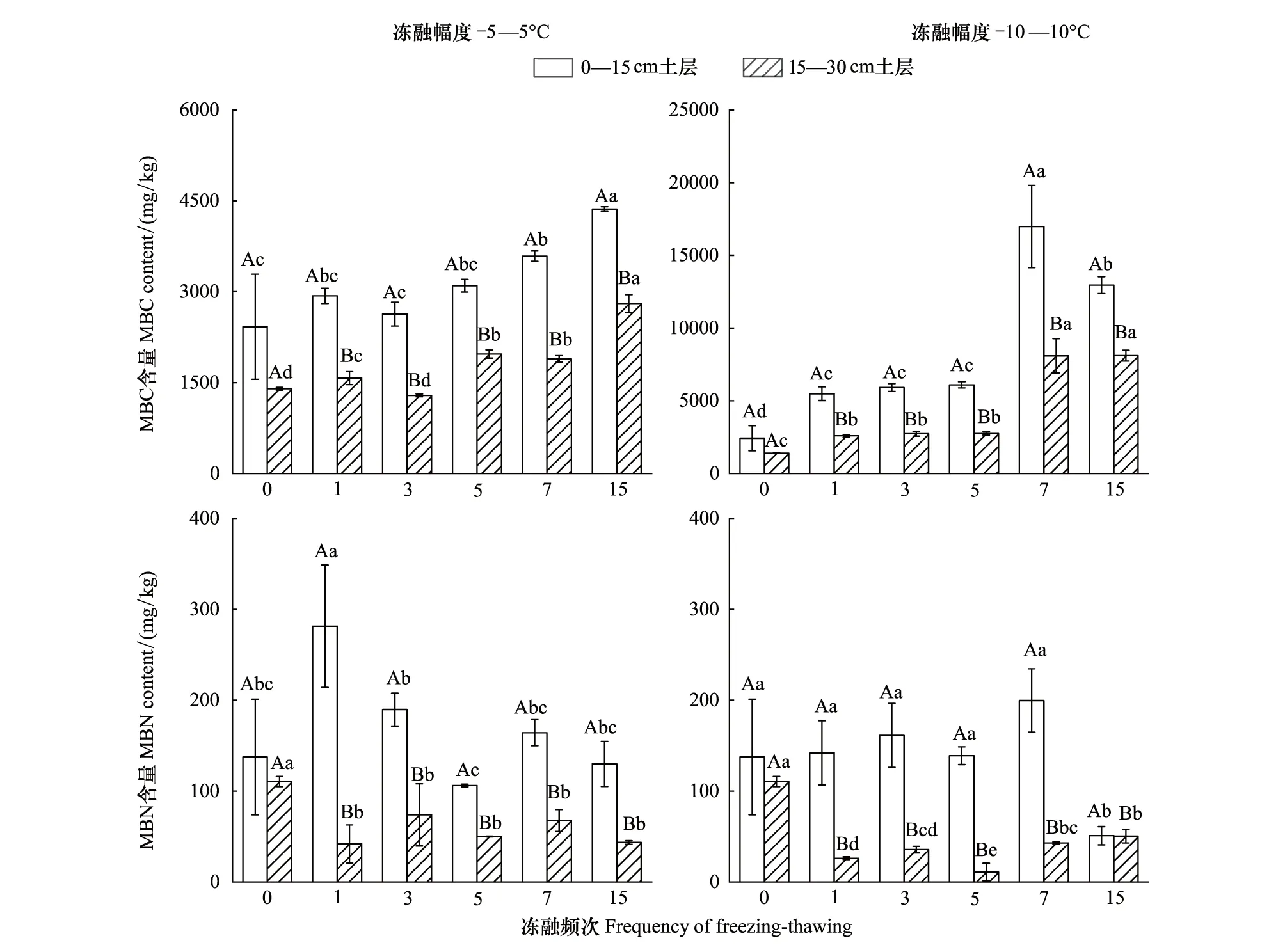
图2 -5—5℃和-10—10℃处理下不同冻融频次的土壤微生物量碳、氮的变化Fig.2 Variations in the soil microbial biomass carbon and nitrogen concentrations under different freezing-thawing times in -5—5℃ and -10—10℃不同大写字母表示同一次取样两种深度之间差异显著(P<0.05);不同小写字母表示同一深度在冻融频次上的差异显著(P<0.05);图中数据为平均值±标准偏差(n=3);MBC:微生物量碳microbial biomass carbon;MBN:微生物量氮 microbial biomass nitrogen
2.2 冻融作用下土壤水解酶活性变化特征
-5—5℃冻融作用下,与冻融前相比,0—15 cm和15—30 cm土壤BG酶活性在冻融循环作用的初期显著降低;在15次冻融循环结束后,土壤BG酶活性再次增加,但最高值仍低于冻融前土壤BG酶活性。-5—5℃冻融模式下,与冻融前相比,0—15 cm和15—30 cm土壤BG酶活性分别降低了42.9%和58.3%,土壤NAG酶活性分别降低了16.2%和39.3%,土壤AP酶活性分别降低了36.7%和32.4%(图3)。冻融频次对0—15 cm土壤水解酶活性均有显著影响 (P<0.0001),而冻融幅度仅对0—15 cm土壤的NAG酶活性及15—30 cm的AP酶活性影响显著,而冻融频次和冻融幅度的交互作用对土壤水解酶活性均产生显著影响(P<0.05)(表3)。综上,15次-5—5℃冻融循环后,土壤水解酶活性显著降低。
-10—10℃冻融模式下,两层土壤水解酶活性在冻融作用初期显著降低,而在冻融循环后期又再次增加。-10—10℃冻融模式下,与冻融前相比,0—15 cm和15—30 cm土壤BG酶活性分别降低了21.2%和12.8%,而土壤NAG酶活性分别增加了17.6%和7.3%。0—15 cm土壤AP酶活性增加了14.7%,15—30 cm土壤AP酶活性降低了28.4%(图3)。数据分析显示,-5—5℃的冻融循环对水解酶的影响略大。随着土层深度的增加,土壤水解酶活性变化的幅度表现为0—15 cm<15—30 cm。

图3 -5—5℃和-10—10℃处理下不同冻融频次的土壤水解酶活性的变化Fig.3 Variations in the soil hydrolytic enzyme activities under different freezing-thawing times in -5—5℃ and -10—10℃不同大写字母表示同一次取样两种深度之间差异显著(P<0.05);不同小写字母表示同一深度在冻融频次上的差异显著(P<0.05);图中数据为平均值±标准偏差(n=3);BG:β- 1,4-葡萄糖苷酶 β- 1, 4-glucosidase;NAG:β- 1,4-N-乙酰葡糖胺糖苷酶 4-N-acetylglucosaminosidase;AP:酸性磷酸酶 acid phosphatase
2.3 冻融作用下土壤氧化酶活性变化特征
与冻融循环前相比,冻融初期土壤氧化酶活性显著降低,随着冻融次数的增加,土壤氧化酶活性逐渐增加,但仍低于冻融前的酶活性。-5—5℃冻融模式下,与冻融前相比,15次冻融循环后0—15 cm和15—30 cm土壤PPO酶活性分别减少了49.6%和21.9%,土壤PER酶活性分别减少了91.0%和60.1%(图4)。-10—10℃冻融模式下,与冻融前相比,0—15 cm和15—30 cm土壤PPO酶活性分别减少了46.2%和43.0%,土壤PER酶活性分别减少了83.8%和62.7%(图4)。冻融频次对0—15 cm及15—30 cm土壤氧化酶活性均有显著影响(P<0.05),冻融幅度及其与冻融频次的交互作用对土壤氧化酶活性均无显著影响(表3)。实验结果表明,-10—10℃的冻融幅度对土壤氧化酶活性的影响略大。随着土壤深度的增加,土壤氧化酶活性的变化幅度表现为0—15 cm>15—30 cm。

图4 -5—5℃和-10—10℃处理下不同冻融频次的土壤氧化酶活性的变化Fig.4 Variations in the soil oxidase activities under different freezing-thawing times in -5—5℃ and -10—10℃不同大写字母表示同一次取样两种深度之间差异显著(P<0.05);不同小写字母表示同一深度在冻融频次上的差异显著(P<0.05);图中数据为平均值±标准偏差(n=3);PPO:多酚氧化酶 polyphenol oxidase;PER:过氧化物酶peroxidase

表3 冻融幅度和冻融次数对土壤水解酶和氧化酶活性影响的方差分析
2.4 土壤酶活性与土壤活性有机碳、氮的关系
相关性分析显示,0—15 cm土壤AP酶活性与土壤MBC与MBN含量呈显著正相关(P<0.05),土壤PPO酶活性与DOC含量呈负相关(P<0.05)(表4)。15—30 cm土壤BG酶活性与土壤MBN含量呈显著正相关(P<0.01)(表4)。15—30 cm土壤AP酶活性与土壤DOC与DON含量呈显著正相关(P<0.05)(表4)。15—30 cm土壤PER酶活性与土壤DOC含量和MBC含量呈显著负相关(P<0.05),但与土壤MBN含量呈显著正相关(P<0.01)(表4)。土壤NAG与土壤DOC和DON含量呈负相关,但不显著(表4)。
3 讨论
3.1 冻融交替作用对土壤活性有机碳、氮的影响
在土壤有机物转化和微生物代谢活动中,会产生土壤DOC与DON,其含量的高低能够反映土壤微生物分解与利用有机物的情况[33]。本实验结果表明,随着冻融次数的增加,大幅冻融环境下DOC和DON含量先增加后减少,说明短期冻融过程对土壤DOC和DON的释放有促进作用。已有研究表明,冻融过程可改变土壤团聚体的大小和稳定性,冻融初期,土壤孔隙中冰晶的膨胀打破颗粒之间的联结,破碎大团聚体,释放小分子有机质[34],同时冻融交替对微生物有灭杀作用,即会降低土壤微生物数量,造成微生物死亡。在分解菌的作用下,死亡的微生物会释放出小分子糖和氨基酸等,进而增加了土壤中DOC与DON含量[35]。同时,大幅度的冻融作用对团聚体的破碎作用更强,释放出的小分子有机质速度更快[36],因此,本研究中在-10—10℃冻融作用下,土壤DOC和DON含量在3次冻融循环后达到最大值,而在-5—5℃冻融幅度下,养分释放缓慢,DOC和DON在15次冻融循环后依旧较高。随着冻融次数的增加,土壤微生物开始适应冻融作用,而释放DOC和DON为微生物提供能量和养分,促进微生物的生长,使得冻融后期土壤DOC和DON出现下降趋势[11,13]。同时,由于矿化作用,土壤中原有的DOC与DON在不断被利用分解,因此经多次冻融后土壤DOC与DON含量减少[35,37—38]。此外,本研究发现两种冻融幅度对比,小幅度冻融幅度对DOC与DON含量的影响更大,这可能是因为大幅度冻融作用中融化温度较高,在相对较高温度的融化时期加速 DOC和DON的消耗,从而导致小幅度冻融循环下DOC和DON含量变幅更大[24]。研究发现,0—15 cm土壤DOC和DON受冻融频次及冻融幅度的影响不显著,可能是因为0—15 cm土壤受微生物影响较大,表层土壤的微生物群落数量多于深层土壤,表层土壤微生物对DOC、DON的利用也就更强[36]。

表4 土壤活性有机碳氮组分与土壤酶活性之间的相关性
冻融强度、冻融循环次数对土壤微生物量有显著影响[39]。土壤MBC和MBN含量主要受到土壤微生物的数量与种类的决定性影响,同时还受土壤水分、土壤温度、土壤通气性等各生态因子的作用[40—41]。随着冻融频次的增加,与冻融前相比,15次冻融循环后土壤MBC含量增加。冻融交替作用和氯仿熏蒸会杀死土壤中的微生物,在冻融作用的初期,死亡微生物的细胞可作为存活微生物的底物,进而增加了土壤微生物活性;此外,死亡的微生物在分解过程中释放小分子物质,提高了土壤中有机质含量,同时也增加了土壤的微生物量[42]。然而,冻融循环短期内改变了泥炭土壤基本理化性质,低温环境抑制了土壤微生物的活性,土壤中微生物的生物量随之受到影响[43]。因此,随着冻融频次的增加,土壤MBN含量下降,MBC在7次-10—10℃冻融作用后也开始下降,在其他湿地中也发现类似的研究结果[43—44]。土壤MBC与以往研究结果有所差异,这可能是受采样时间及采样时温度的影响,采样时研究区土壤平均温度为-7.3℃,能够存活的土壤微生物对低温有一定的适应性可以很好存活,并在释放的DOC和DON的作用下,呈现增加趋势。土壤MBN与MBC含量变化不一致,可能是因为氮在土壤中不稳定,极易发生矿化,冻融作用加剧了氮的矿化[45]。本研究发现,随着土壤深度的增加,冻融作用对深层土壤MBC和MBN含量变化影响更大,可能是因为在整个冻融循环中,冻土下界面稍晚于表层开始融化,已有研究表明,冻融交替主要发生在冻土近地表层,在该层产生单向的土壤解冻与双向的土壤冻结,即同时从地面和活动层的底部开始冻结,因此深层土壤冻结时间更长,从而导致微生物活性受到更强烈的抑制作用。此外,两种冻融幅度对比,大幅度冻融幅度对土壤MBC与MBN含量的影响更大,这可能是因为大幅度冻融循环作用下释放养分更快,微生物充分利用周围有机质维持自身生命活动使MBC、MBN含量变幅更大。
3.2 冻融交替作用对土壤酶活性的影响
土壤BG、NAG和AP酶在土壤有机质的分解转化过程中具有重要作用,表征土壤碳、氮、磷元素的生物有效性[46—48]。土壤PER酶主要氧化酚类、胺类为醌,能够反应土壤腐殖化状况,而土壤PPO酶是一种非特异性酶,可分解木质素和腐殖酸等难降解聚合物[49]。本研究发现,冻融频次显著影响了土壤胞外酶活性。两种冻融模式下,上述5种土壤胞外酶活性在冻融交替作用初期显著降低,而冻融作用后期有所增加,这与先前的研究相一致[50]。土壤酶大部分是土壤微生物的产物,因此影响土壤微生物活性或组成结构的条件也会改变土壤酶活性[51]。双因素方差分析表明,冻融频次对0—15 cm土壤氧化酶与水解酶均有显著影响。土壤酶由微生物分泌,0—15 cm土壤微生物数量高于15—30 cm土壤。然而,在-5—5℃冻融模式下,不同频次下各种酶的变化趋势有差异,在冻融循环初始阶段,冻融循环杀死了微生物,导致土壤水解酶和氧化酶活性降低;另一方面,冻融作用下土壤DOC含量增加,不需要微生物释放过多的酶满足其对能量的需求。在冻融作用后期,土壤团聚体的破碎和微生物细胞的破裂增加了胞内酶向土壤的释放[52],同时也增加了土壤微生物与活性有机质的接触面积,促进了土壤酶活性后期的增加。土壤NAG酶和AP酶呈现先增加后降低的变化趋势,表明在-5—5℃冻融作用下,这2种土壤酶活性并未完全钝化[53]。冻结作用下,土壤中DOC快速释放,同时磷元素的有效性降低,促使微生物释放更多的NAG和AP酶来缓解自身氮、磷限制[54]。本研究中,土壤AP酶与土壤MBC和MBN的显著正相关关系验证了这一结论。
冻融循环初期,相对于-5—5℃,-10—10℃的大幅冻融作用下土壤氧化酶活性下降更为明显,且在冻融作用后期增加也更为显著。这意味着大幅度冻融作用下土壤可溶性养分的释放及吸收更为迅速,促使土壤酶做出快速的反应,这与本研究中大幅度冻融作用对土壤DOC和DON的影响更为显著的研究结果相一致。此外,冻融作用对0—15 cm的土壤氧化酶活性变化比对15—30 cm的影响更加显著,其原因可能是土壤表层覆盖大量植物残体,同时具有利于微生物繁殖的较为良好的水气环境,使得土壤有效养分较高,因此表层土壤有较高的土壤酶活性[55],且表层土壤直接应力于冻融循环,由于温度、水分的变化表层土壤酶活性而产生相应的变化;而深层土壤对于冻融循环的响应较上层土壤而迟缓[56]。
4 结论
(1)通过冻融模拟实验结果得知,冻融作用显著改变泥沼泽土壤活性有机碳氮含量。-10—10℃冻融作用下土壤养分释放更为迅速,土壤DOC和DON呈现先增加后减小的变化趋势。-5—5℃冻融作用下土壤养分释放缓慢,在15次冻融循环后土壤DOC和DON含量高于-10—10℃冻融作用。
(2)冻融作用增加了土壤MBC含量,降低了土壤MBN含量,且-10—10℃冻融作用下对土壤微生物量碳氮的影响更为显著。-5—5℃和-10—10℃冻融幅度均对15—30 cm土壤微生物量碳氮的影响更强。
(3)冻融作用冻融作用显著降低了土壤水解酶和氧化酶活性,且-5—5℃冻融作用下对土壤水解酶活性变化影响更加显著,而-10—10℃冻融作用下土壤氧化酶活性的变化更为剧烈。随着土层深度的增加,土壤水解酶活性变化的幅度表现为0—15 cm<15—30 cm,土壤氧化酶活性变化的幅度表现为0—15 cm>15—30 cm。冻融作用下土壤酶活性的变化与土壤活性有机碳、氮组分的变化密切相关。

