光催化材料CdS/TiO2的制备及其光催化还原U(Ⅵ)性能研究
宋 艳,陈树森,康绍辉,宿延涛,王凤菊,勾阳飞,李子明
(核工业北京化工冶金研究院,北京 101149)
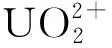
从铀资源回收利用及生态环境保护方面考虑,较理想的治理铀污染的方法是将废水中的U(Ⅵ)还原为U(Ⅳ)。目前,主要采用微生物还原法、化学还原法及光催化还原法来还原去除废水中的U(Ⅵ)。微生物还原法在实际应用中存在的问题是条件苛刻、周期冗长、受外界环境影响较大[3-4]。化学还原法中应用较多的是含铁还原材料,但其存在的问题是铁离子进入水体后,积累过多会导致水体铁污染[5-6]。因此,迫切需要一种高效、清洁和低成本的技术解决含铀废水污染问题。
光催化还原法作为一种新型水处理技术,其优点是效率高、工艺简单、无二次污染。目前,利用光催化法来还原铀酰离子的研究较少,且主要集中在TiO2光催化还原U(Ⅵ)[7-9]。TiO2具有优异的光学性质,当其受到光照射时,价带中的电子受到激发会跃迁至导带中空轨道,从而使其成为良好的光敏还原剂或光敏氧化剂。但TiO2是宽带隙半导体材料(禁带宽度为3.2 eV),只有在紫外光照射下才能被激发,降低了对太阳能的利用率。研究发现,将对可见光有较好光敏响应的窄带隙半导体材料CdS(禁带宽度为2.4 eV)与TiO2进行复合,可将TiO2光响应范围拓宽至可见光区,以提高对太阳能的利用率[10-12]。
目前,CdS/TiO2复合纳米粒子的制备方法主要包括水热法[13]、微乳液法[14]、溶胶-凝胶法[15],较少采用分步沉淀法,且对其光催化还原U(Ⅵ)性能的研究尚未见报道。本文拟采用分步沉淀法制备CdS/TiO2复合纳米粒子,借助SEM、XRD、DRS等手段对材料的表面形貌、晶型和光吸收特性进行分析,并在可见光照射下,研究材料光催化还原含铀废水中U(Ⅵ)的性能,为我国核工业领域含铀废水中U(Ⅵ)的还原处理提供一种新途径。
1 方法
1.1 主要试剂与仪器
硫酸钙、硫化钠、氟化钠、氢氧化钠、氯化钛,分析纯,天津恒兴化学试剂有限公司;硫酸镁、氯化镉、盐酸、甲酸钠,分析纯,上海联试化工试剂有限公司。
AP135W型电子天平,日本岛津公司;DF-101S型磁力搅拌器,巩义市予华仪器公司;DH-203型电热恒温干燥箱,苏州普奇机械设备有限公司;1 400 ℃立式单温区管式电炉,天津中环电炉股份有限公司;GT10-1型高速离心机,北京时代北利离心机有限公司;D/max2500 X射线衍射仪,日本理学公司;S-4800型扫描电子显微镜,日本日立公司;TU-1901型光谱仪,北京普析通用仪器有限公司。
1.2 光催化材料制备
量取16.8 mL TiCl3溶液和200 mL蒸馏水置于烧杯中,于50 ℃恒温水浴中反应1 h后,缓慢滴加一定量1 mol/L NaOH溶液,反应完全后,将制得的样品离心,用蒸馏水反复冲洗,直至溶液为中性,烘干,置于管式炉中于650 ℃下热处理2 h后取出,研磨得到TiO2纳米粒子。称取0.799 g TiO2纳米粒子、1.0 g NaOH和200 mL蒸馏水置于烧杯中,超声10 min后,置于40 ℃恒温水浴中,向上述溶液中缓慢滴加一定量的0.004 mol/L CdCl2溶液和0.015 mol/L Na2S溶液,得到黄色沉淀物。将制得的沉淀物离心,用蒸馏水反复冲洗,直至溶液为中性,烘干,研磨得到光催化材料CdS/TiO2复合纳米粒子。
1.3 光催化试验
利用自制的光催化反应仪对材料的光催化还原活性进行评价,反应仪由带有循环冷却水装置的圆柱形反应器、石英冷阱、支架、磁力搅拌器、温度计等组成,其中圆柱形反应器容积为250 mL,光源为500 W氙灯。所用溶液为某尾矿库废水(废水中U(Ⅵ)的质量浓度为0.417 6 mg/L、NH4+的质量浓度为1 284.5 mg/L、COD的质量浓度为63 mg/L、pH=7.7)和根据其特点配制的模拟废水,pH=7.0,其组成列于表1。根据试验的具体要求,用0.1 mol/L HCl溶液或NaOH溶液调节废水的pH值。
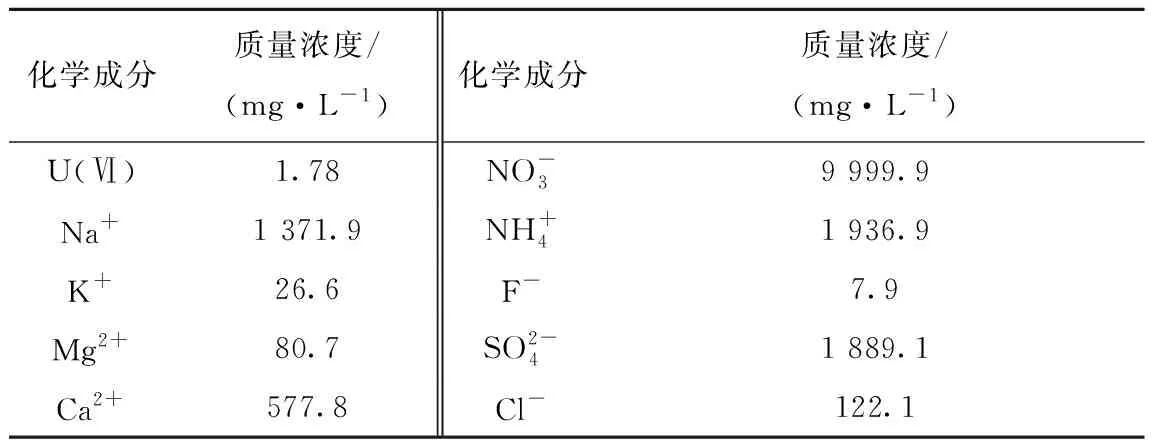
表1 模拟废水化学成分Table 1 Chemical composition of simulated wastewater
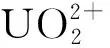
η=(1-ct/c0)×100%
(1)
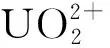
2 结果与讨论
2.1 CdS/TiO2复合纳米粒子表征
1) XRD分析
利用XRD对TiO2纳米粒子和CdS/TiO2复合纳米粒子进行结构分析,结果如图1所示。由图1可知,25.403°、37.892°、38.598°、48.202°、53.988°、55.212°、69.013°、70.409°和75.993°处的衍射峰分别归属于锐钛矿型TiO2的(101)、(004)、(112)、(200)、(105)、(211)、(116)、(220)和(301)晶面(PDF 21-1272);27.513°、36.188°和62.757°处的衍射峰归属于金红石型TiO2的(110)、(101)和(002)晶面(PDF 89-4920),故TiO2纳米粒子是由锐钛矿型和金红石型组成的。图1中除TiO2纳米粒子的特征峰外,26.693°、29.611°、44.149°和52.141°处的衍射峰归属于立方晶型CdS的(111)、(200)、(220)和(311)晶面(PDF 65-2887)。因此,CdS/TiO2复合纳米粒子是由锐钛矿型和金红石型TiO2与立方晶型CdS组成的光催化材料。
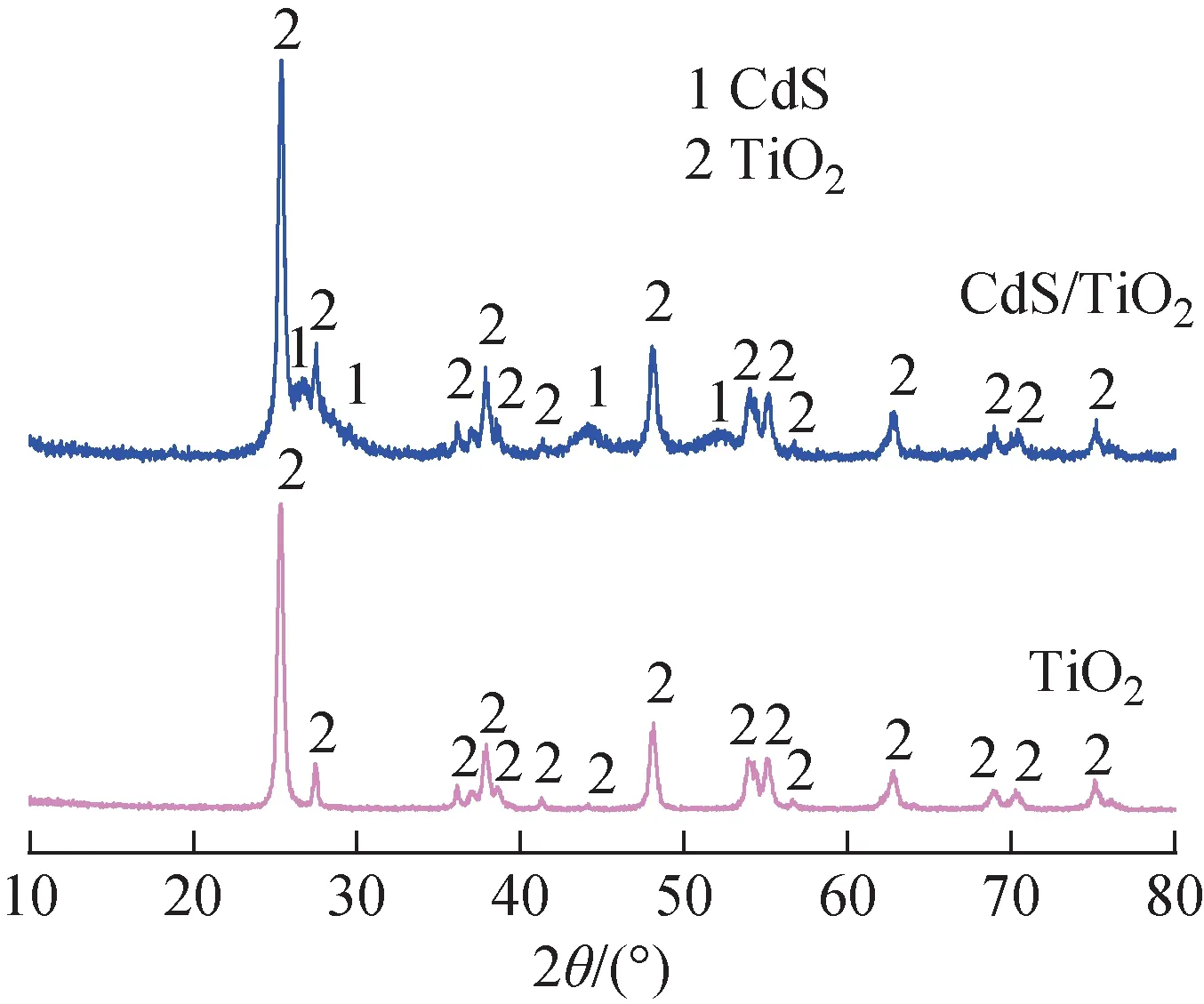
图1 TiO2纳米粒子和CdS/TiO2复合纳米粒子的XRD谱Fig.1 XRD patterns of TiO2 and CdS/TiO2 composite nanopartical
2) SEM分析
利用SEM对CdS/TiO2复合纳米粒子的形貌进行分析,结果如图2所示。从图2可看出,CdS/TiO2复合纳米粒子的粒径小,较均一,粒子之间分散性好,无大范围团聚成块或成片情况,其粒径约为30~50 nm。

图2 CdS/TiO2复合纳米粒子的SEM图像Fig.2 SEM image of CdS/TiO2 composite nanopartical
3) DRS分析
利用DRS对TiO2纳米粒子和CdS/TiO2复合纳米粒子的光吸收特性进行分析,结果如图3所示。从图3可看出,与TiO2纳米粒子(吸收带边为395 nm)相比,CdS/TiO2复合纳米粒子在395~550 nm出现1个吸收带,并呈现双禁带的特性,这是由于CdS是窄带隙半导体材料,在TiO2中引入CdS,可将TiO2的光响应范围由紫外光区拓展到可见光区,即发生红移现象。将CdS和TiO2的吸收带边(Eg)代入公式Eg=1 240/λ,可得到其禁带宽度分别为2.16 eV和3.14 eV。
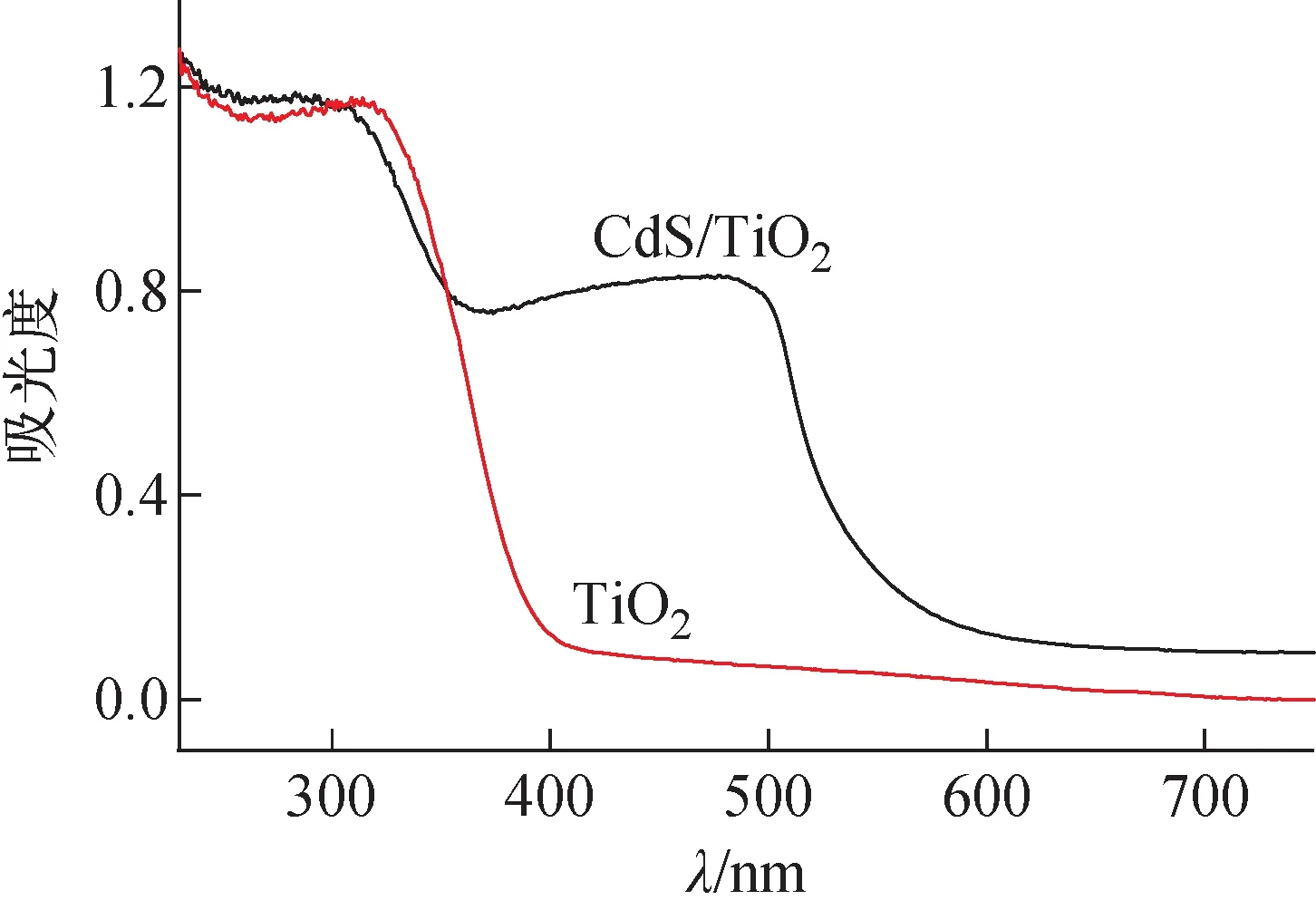
图3 TiO2纳米粒子和CdS/TiO2复合纳米粒子的DRS谱Fig.3 DRS spectra of TiO2 and CdS/TiO2 composite nanopartical
2.2 模拟废水中的光催化还原U(Ⅵ)性能
1) CdS/TiO2复合纳米粒子用量的影响
在废水pH=7.0、光催化时间为2 h条件下,考察CdS/TiO2复合纳米粒子用量对光催化还原U(Ⅵ)效果的影响,结果示于图4。由图4可见,CdS/TiO2复合纳米粒子用量对废水中U(Ⅵ)的还原率随材料用量的增加呈先增加后减小的趋势,CdS/TiO2复合纳米粒子用量为1.0 g/L时还原率最高,为98.89%。这是因为光照CdS/TiO2复合纳米粒子产生的光生载流子的数目随CdS/TiO2复合纳米粒子用量的增加而增加,使得U(Ⅵ)的还原率增大;但当光辐照的强度不变时,随着CdS/TiO2复合纳米粒子用量的继续增加,废水变得浑浊,使得光发生散射,导致部分CdS/TiO2复合纳米粒子接触不到光,降低了其对U(Ⅵ)的还原效果。因此,最佳CdS/TiO2复合纳米粒子用量为1.0 g/L。
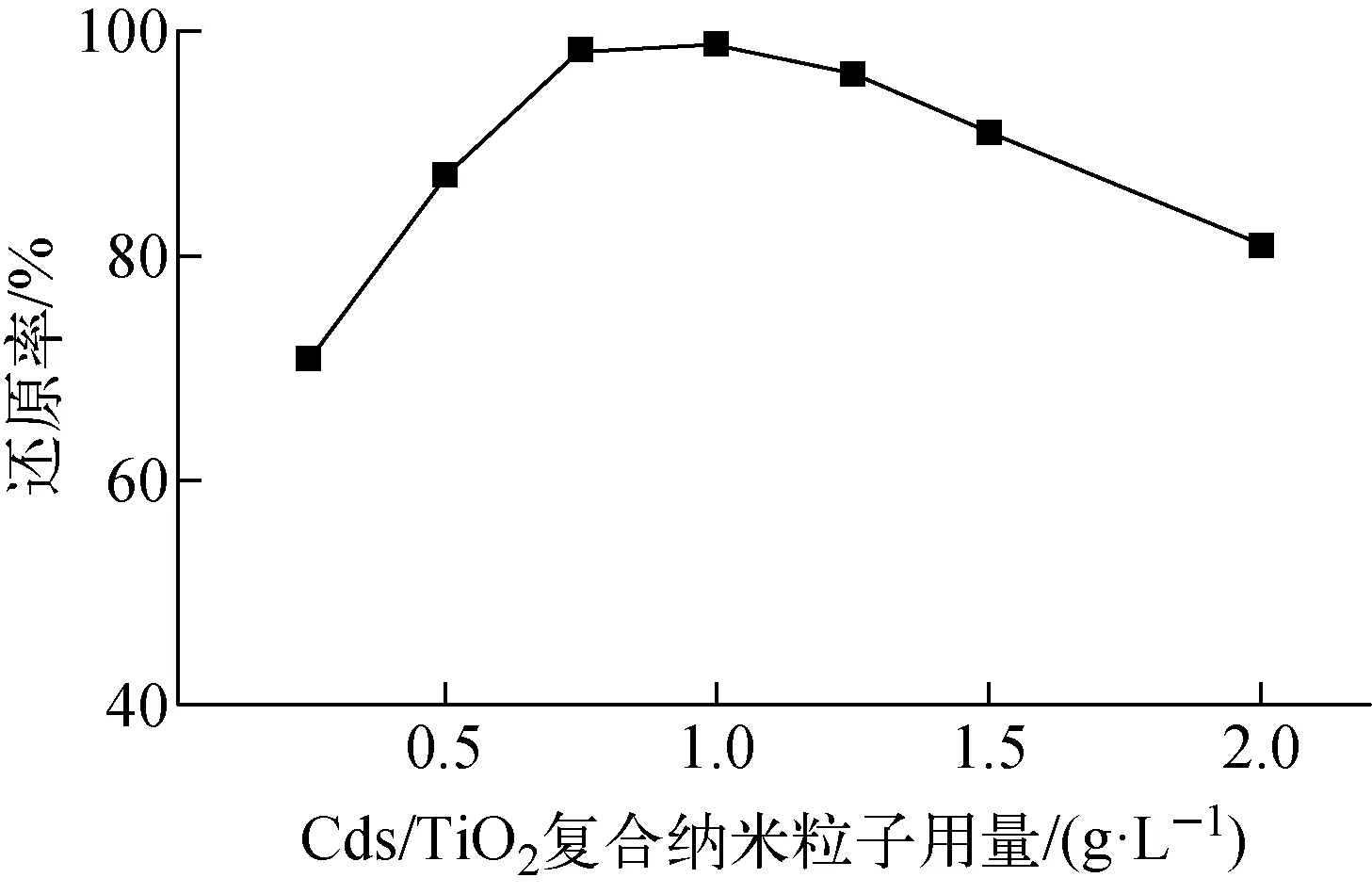
图4 CdS/TiO2复合纳米粒子用量对光催化还原U(Ⅵ)的影响Fig.4 Effect of dosage of CdS/TiO2 composite nanopartical on photocatalytic reduction of U(Ⅵ)
2) 废水pH值的影响
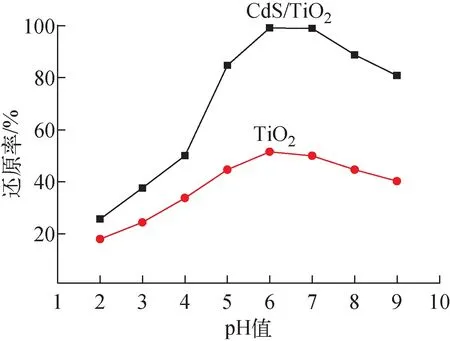
图5 废水pH值对光催化还原U(Ⅵ)的影响Fig.5 Effect of pH on photocatalytic reduction of U(Ⅵ)
3) 反应时间的影响
在模拟废水pH=6.0、CdS/TiO2复合纳米粒子用量为1.0 g/L条件下,考察反应时间对光催化还原U(Ⅵ)的影响,结果示于图6。由图6可见,随着暗反应时间的增加,CdS/TiO2复合纳米粒子对废水中U(Ⅵ)的吸附量增大,60 min时达到吸附-脱附平衡,之后CdS/TiO2复合纳米粒子对U(Ⅵ)的吸附量几乎不变。暗反应150 min后开启光源进行光催化反应,可见,废水中U(Ⅵ)的还原率随光照时间的增加而增加,120 min后光催化反应达到平衡,U(Ⅵ)还原率几乎不再变化,此时还原率为99.13%。因此,选择最佳暗反应时间为60 min,光催化反应时间为120 min。
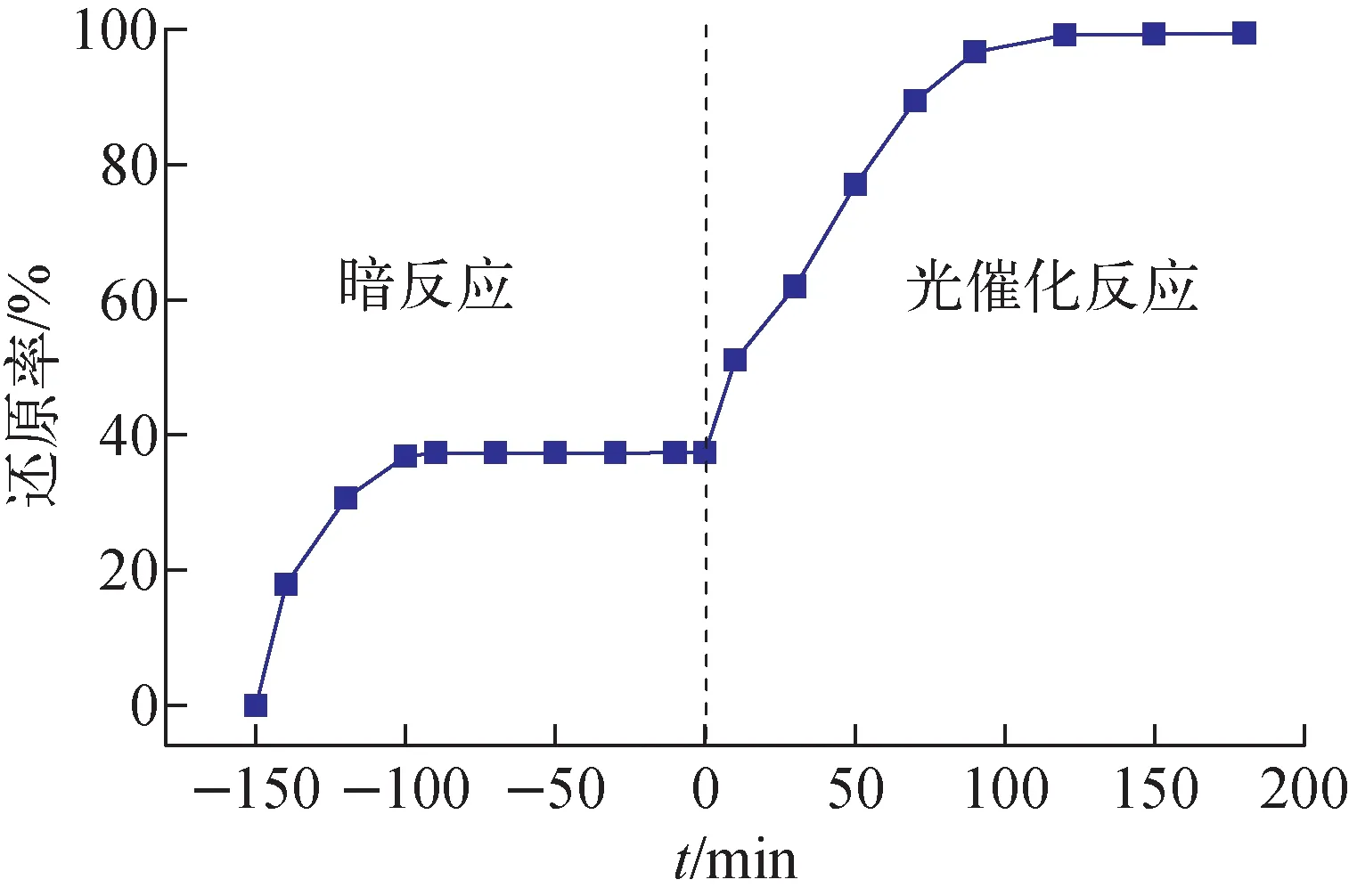
图6 反应时间对光催化还原U(Ⅵ)的影响Fig.6 Effect of time on photocatalytic reduction of U(Ⅵ)
采用准一级动力学方程(ln(ct/c0)=kt)对图6进行拟合,结果示于图7。准一级反应动力学曲线方程为y=-0.035 4x-0.129 7,线性相关系数R2为0.955,说明采用准一级动力学方程可较好地描述CdS/TiO2复合纳米粒子对废水中U(Ⅵ)的光催化反应。
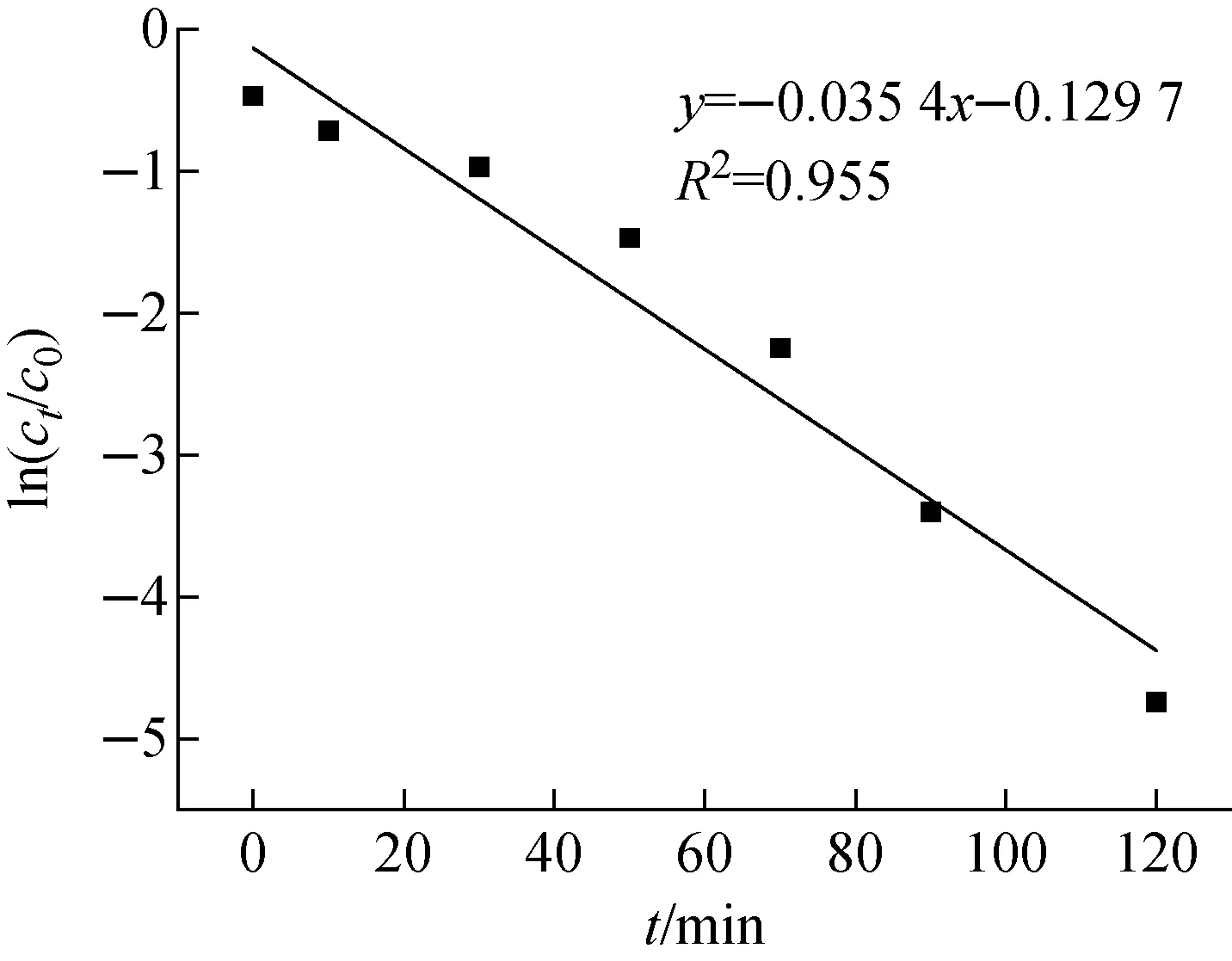
图7 准一级动力学曲线Fig.7 Quasi first order kinetic curve
2.3 真实废水中的光催化还原U(Ⅵ)性能
为验证CdS/TiO2复合纳米粒子在真实废水中的光催化还原效果,以某尾矿库真实废水为研究对象,加入1.0 g/L的CdS/TiO2复合纳米粒子进行光催化反应,以TiO2纳米粒子作为对比,在相同条件下进行试验,结果示于图8。由图8可见,CdS/TiO2复合纳米粒子的光催化还原效率大于TiO2纳米粒子,CdS/TiO2复合纳米粒子对真实废水中铀的还原率为90.4%,此时铀浓度为0.04 mg/L,已达到GB 23727—2020[18]中规定的废水铀含量排放标准(≤0.05 mg/L),表明CdS/TiO2复合纳米粒子是一种具有应用前景的光催化材料。CdS/TiO2复合纳米粒子在真实废水中对铀的还原率与在模拟废水中不一致,是因为模拟废水是根据真实废水特点配制的溶液,其杂质离子种类较真实废水少,不能完全反应真实废水的特点,且真实废水和模拟废水的pH值不同,而pH值对废水中铀化学形态的种类和含量有较大影响,使得材料对铀的光催化还原效果不同。
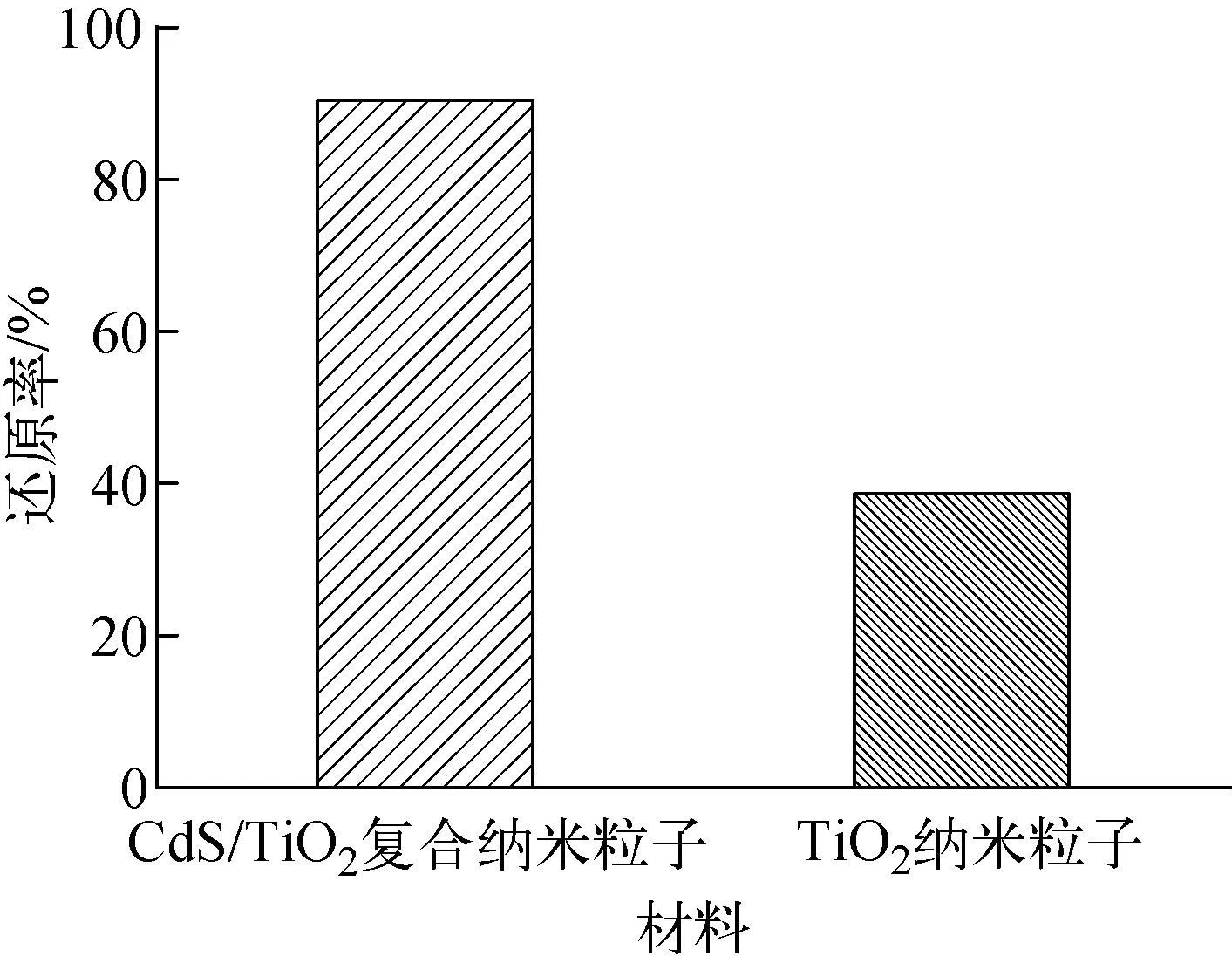
图8 真实废水中CdS/TiO2复合纳米粒子的光催化性能Fig.8 Photocatalytic property of CdS/TiO2 composite nanopartical in real wastewater
2.4 CdS/TiO2复合纳米粒子对U(Ⅵ)的光催化机理
当CdS/TiO2复合纳米粒子与含铀废水接触时,废水中的U(Ⅵ)首先吸附在材料表面,然后利用光照CdS/TiO2材料时产生的电子直接还原U(Ⅵ),或利用产生的空穴间接还原U(Ⅵ)[19-20],光催化还原铀的作用机理如图9所示。
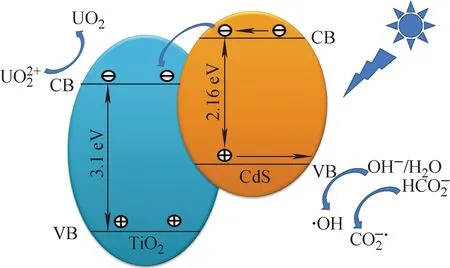
图9 CdS/TiO2复合纳米粒子光催化还原U(Ⅵ)的机理Fig.9 Mechanism of photocatalytic reduction of U(Ⅵ) with CdS/TiO2 composite nanoparticle
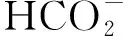
(2)
(3)
(4)
(5)
(6)
(7)
(8)
3 结论
1) 采用分步沉淀法制备了CdS/TiO2复合纳米粒子,复合纳米粒子是由锐钛矿型和金红石型TiO2及立方晶型CdS组成的光催化材料,粒径为30~50 nm,复合纳米粒子呈双禁带特性,其吸收带边较TiO2发生了明显的红移。
2) CdS/TiO2复合纳米粒子对模拟废水中的U(Ⅳ)具有良好的光催化活性,其还原反应符合准一级反应动力学特征。在模拟废水pH=6.0、CdS/TiO2复合纳米粒子用量为1.0 g/L、光催化反应时间为2 h时对U(Ⅳ)的光催化还原效率最高,为99.13 %;在真实废水中对U(Ⅳ)的还原率为90.4 %,处理后的含铀废水达到了国家规定的排放标准。
本文所研制的CdS/TiO2复合纳米粒子是一种可见光型光催化材料,利用光催化还原技术可将废水中的U(Ⅵ)还原为U(Ⅳ),整体工艺路线简单、环境友好、具有较好的推广应用前景。