CYP2D6*10基因多态性检测体系的建立与评价*
吴建元,章柏钰,蔡君龙,汪再兴,刘凤麟,曾 超,黄建英△
1.武汉大学中南医院临床试验中心,湖北武汉 430071;2.武汉友芝友医疗科技股份有限公司,湖北武汉 430075
细胞色素P-450(CYP450)属于单氧酶,代表亚铁血红素蛋白家族,因其在450 nm有特异吸收峰而得名。CYP2D是CYP家族重要成员,其基因位于22号染色体上,由CYP2D6、CYP2D7、CYP2D8组成,其中CYP2D7P和CYP2D8P为假基因,仅有CYP2D6能够在肝脏及其他组织中表达,编码酶活性蛋白,发挥代谢作用。人群中CYP2D6的活性呈现强代谢者、中间代谢者、弱代谢者和超强代谢者四态分布的现象。CYP2D6在药物代谢中起重要作用。去甲替林等抗抑郁药,奋乃静、硫利达嗪等抗精神病药物、美托洛尔等抗心律失常药物主要由CYP2D6代谢,CYP2D6活性会影响其血药浓度,进而影响其疗效及不良反应[1-2]。此外,CYP2D6多态性与三环类抗抑郁药、选择性血清素再摄取抑制剂、昂丹司琼和托烷司琼等药物用药的关联已经有相关临床药物基因组学实施联盟(CPIC)指南[3-6]。与其他大部分CYP同工酶不同,CYP2D6对于酶诱导效应并不敏感。不同基因型对酶活性和药物代谢的影响不一。中国人群中CYP2D6最常见的导致酶活性降低的等位基因为CYP2D6*10(C188T),等位基因频率为53%[7]。
因此,临床上需要快速准确的手段对CYP2D6进行分型检测,尤其是在中国人群分布广泛的CYP2D6*10基因型。由于CYP2D6、CYP2D7、CYP2D8高度同源,如CYP2D6和CYP2D7同源性超过95%,极易干扰CYP2D6基因的检测结果。核酸检测时应重点排除CYP2D7和CYP2D8的影响。目前国内外针对CYP2D6分型,多采用Sanger直接测序法、PCR高分辨率溶解曲线法等,这些方法均存在着一定的局限性,如需要特殊仪器、操作复杂等。本研究以当前临床实验室普遍采用的荧光定量PCR平台,采用Taqman探针分型技术结合扩增阻滞突变聚合酶链式反应(ARMS-PCR)技术,建立一种适用多种类型临床样本(抗凝全血、石蜡组织切片等)的快速检测CYP2D6*10基因的方法。
1 资料与方法
1.1一般资料 乙二胺四乙酸 (EDTA)抗凝全血、枸橼酸钠抗凝全血、石蜡组织切片,每种样本类型CYP2D6*10 3种基因型(C/C野生型,T/T纯合突变型,C/T杂合突变型)各20例。本研究经武汉大学中南医院医学伦理委员会批准,伦理批件号为科伦[2021083],研究样本的收集与使用均在伦理委员会监督下进行。
1.2仪器与试剂 ABI7500荧光定量PCR系统;德国QIAGEN GmbH公司的QIAamp DNA Blood Mini Kit(货号51104)或武汉友芝友医疗科技股份有限公司的血液基因组DNA提取试剂盒(货号YZYMT-028)用于提取全血样本、德国QIAGEN GmbH公司的QIAamp DNA FFPE Tissue Kit(货号56404)或武汉友芝友医疗科技股份有限公司的核酸提取试剂盒(货号YZYMT-029)用于提取石蜡组织样本;TaKaRa TaqTMHS PCR Kit-UNG plus(TaKaRa,货号R013A);引物及探针由宝生物工程(大连)有限公司合成。
1.3方法
1.3.1样本类型选择与提取试剂盒测试 在进行核酸检测前,需要对样本中的核酸进行提取/纯化。该步骤可最大量分离出目的核酸外,还可对核酸进行纯化,尽可能去除血液或组织中会对后续PCR检测产生抑制作用的血红素、蛋白质和脂类物质等。核酸提取的质量,直接影响后续的检测体系的性能。
与CYP2D6活性相关的药物极多,用途也很广泛,检测CYP2D6*10的体系需要可以兼容尽可能多的临床样本类型。从易于获取、以便于保藏、减轻患者痛苦等方面考虑,选择抗凝全血和石蜡包埋组织作为样本。临床常见的抗凝剂中,肝素会抑制Taq 酶的活性,所以选用EDTA或枸橼酸(ACD)盐抗凝全血作为全血样本。
随机选取EDTA和枸橼酸钠抗凝全血各5例,使用德国QIAGEN GmbH公司的QIAamp DNA Blood Mini Kit(货号51104)和武汉友芝友医疗科技股份有限公司的血液基因组DNA提取试剂盒(货号YZYMT-028)两种血液基因组DNA提取试剂盒,对同一样本都提取200 μL全血1次,使用相同的100 μL体积洗脱1次,使用NanoDrop One检测提取的基因组DNA的浓度及纯度,比较两种提取试剂盒的提取效能。
随机选取5例石蜡包埋组织,使用德国QIAGEN GmbH公司的QIAamp DNA FFPE Tissue Kit(货号56404)或武汉友芝友医疗科技股份有限公司的核酸提取试剂盒(磁珠法,货号YZYMT-029)两种石蜡包埋组织 DNA提取试剂盒,对同一样本使用相同数量的组织切片进行DNA提取,使用相同的100 μL体积洗脱1次,使用NanoDrop One检测提取的基因组DNA的浓度及纯度,比较两种提取试剂盒的提取效能。
1.3.2引物探针设计与扩增体系建立 CP2D6*10的代表单核苷酸多态性(SNP)-rs1065852(C188T)为检测靶标,设计特异性扩增包含该位点的引物,为了覆盖周围序列存在的SNP,同时利用扩增阻滞突变聚合酶链式反应(ARMS-PCR)技术特异性区分CYP2D7序列,设计2条不同的下游引物用于含有周围不同SNP的序列的扩增。正向引物:5′-CCTGATGCACCGGCG-3′;反向引物1:5′-TGGTCCAGCCTGTGGTTT-3′;反向引物2:5′-GCAGGGGGCCTGGTA-3′。设计覆盖识别的SNP位点,分别对应不同基因型的探针,野生型探针WP:5′-FAM-CACGCTAACCACCAG-MGB-3′;突变型探针:5′-VIC-CTGGTGAGTAGCGT-MGB-3′。
为了监测荧光定量PCR反应是否顺利进行、体系中是否添加了正常的DNA样本、提取的样本是否含有抑制PCR反应的物质,设计了针对人看家基因甘油醛-3-磷酸脱氢酶(GAPDH)的特异性内标引物及探针,用于监控PCR反应的进行。内标上游引物:5′-GGCCACTAGGCGCTCA-3′;内标下游引物:5′-GCCACCCGCGAACTCA-3′;内标探针:ROX-5′-CTCCCTCCGCGCAGCCG-3′-BHQ2。
配制并优化CYP2D6*10荧光PCR检测体系,优化体系内的引物和探针浓度,使体系检测杂合型时两个通道的信号及循环数阀值(Ct值)接近,使体系对野生型模板和突变型模板的检测能力相近。建立体系为总体积25 μL,含1×浓度的含尿嘧啶糖基化酶的PCR缓冲液(PCR Buffer for UNG plus),2.25 mmol/L Mg2+,内含0.6 mmol/L的脱氧尿苷三磷酸(dUTP)和 0.2 mmol/L的脱氧腺苷三磷酸(dATP)、脱氧鸟苷三磷酸(dGTP)和脱氧胞苷三磷酸(dCTP)的脱氧核糖核苷三磷酸混合液(dU plus dNTP Mixture),0.625 U TaKaRa Taq HS,0.5 U尿嘧啶-N-糖基化酶,400 nmol/L 引物F、R1和R2;200 nmol/L 探针WP和MP;200 nmol/L内标上游和下游引物;100 nmol/L内标探针,0.2~200.0 ng血液或石蜡组织提取的基因组DNA。
测试退火温度、退火时间、循环数等反应条件,优化的反应条件:37 ℃,10 min,95 ℃,5 min;95 ℃,15 s,60 ℃,1 min,40个循环,于60 ℃退火步骤末采集FAM、VIC和ROX通道荧光信号。
1.3.3性能评价 为了验证CYP2D6*10基因多态性检测体系是否受同源序列干扰,将检测的序列放入美国国家生物技术信息中心(NCBI)数据库进行blast数据库比对,将同源序列与内标序列共同构建到pUC57质粒之中构成CYP2D7质粒,用于验证检测体系的特异性。选取已知CYP2D6*10基因纯合野生、纯合突变和杂合突变基因型的EDTA抗凝全血、枸橼酸钠抗凝全血和石蜡组织各20例样本,采用本研究建立的方法进行检测,确定样本适用类型。分别选取已知CYP2D6*10基因纯合野生、纯合突变和杂合突变基因型的浓度为100 ng/μL的基因组DNA,配制100.0、60.0、30.0、10.0、5.0、0.5 和0.1 ng/μL的浓度梯度,然后采用本研究建立的方法进行检测,以评价本方法的灵敏度。选取抗凝全血和石蜡组织切片,每种样本类型CYP2D6*10 3种基因型(野生、杂合突变、纯合突变)已知样本各20例,采用本研究建立的方法进行检测,与直接测序确定基因型进行比较,评价本方法的准确性。
2 结 果
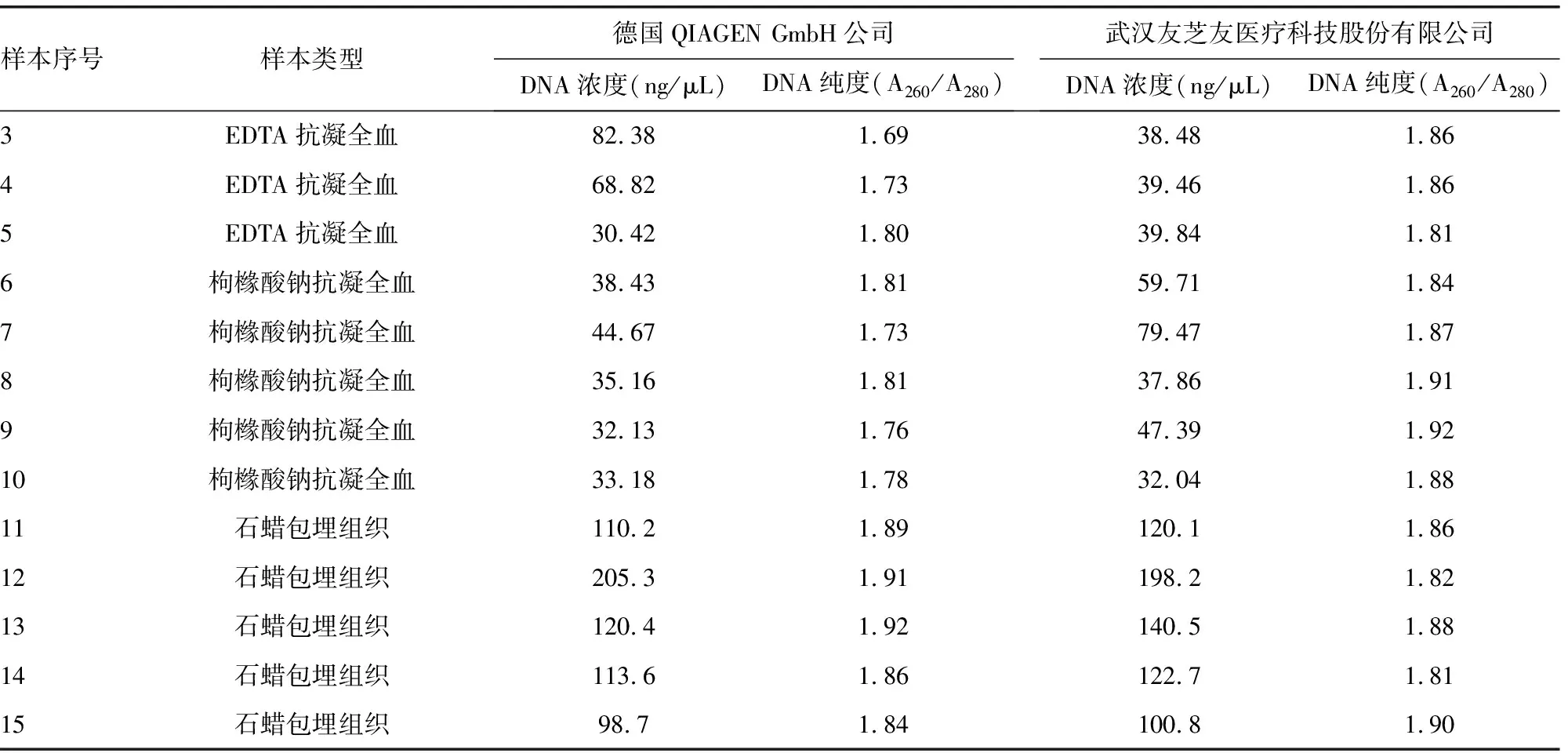
2.1样本提取试剂盒的选择 德国QIAGEN GmbH公司的QIAamp DNA Blood Mini Kit和武汉友芝友医疗科技股份有限公司的血液基因组DNA提取试剂盒对EDTA和枸橼酸钠抗凝全血样本的提取的基因组DNA的质量比对结果见表1样本序号1~10所示。

表1 DNA提取试剂盒提取质量对比
续表1 DNA提取试剂盒提取质量对比
从提取的DNA的纯度及浓度测定结果来看,二者都可以提取出EDTA和枸橼酸钠抗凝全血中的基因组DNA。同样的200 μL全血,同样的100 μL体积洗脱,两种试剂盒提取基因组DNA浓度虽有差别,但都在30 ng/μL以上;武汉友芝友医疗科技股份有限公司的血液基因组DNA提取试剂盒提取的基因组DNA的纯度稍好于德国QIAGEN GmbH公司的QIAamp DNA Blood Mini Kit,但都可以用于后续检测。
对于石蜡包埋组织 DNA提取试剂盒的选择,本研究选用德国QIAGEN GmbH公司的QIAamp DNA FFPE Tissue Kit和武汉友芝友医疗科技股份有限公司的核酸提取试剂盒两种常见的石蜡包埋组织 DNA提取试剂盒进行提取效果对比。随机选取石蜡包埋组织各5例,使用两种试剂盒,按照各自的试剂盒说明书,对同一样本都取10 μm切片3片并提取1次,均使用100 μL体积洗脱,使用NanoDrop One检测提取的基因组DNA的浓度,比较两种试剂盒的提取效能,结果见表1样本序号11~15所示,并且从提取的DNA的浓度测定结果来看,二者提取相同的石蜡组织获得的基因组DNA量比较相近,都可以用于后续检测。
2.2CYP2D6*10荧光PCR检测体系的建立 本研究建立的 CYP2D6*10基因荧光 PCR 检测体系,经过对体系内引物、探针浓度的优化之后,检测CYP2D6*10野生型FAM通道有 S 型扩增曲线,VIC通道扩增信号出现;检测CYP2D6*10纯合突变型VIC通道有 S 型扩增曲线,FAM通道扩增信号出现;检测CYP2D6*10杂合突变型FAM通道和VIC通道均有 S 型扩增曲线,可有效区分不同基因型。检测不同基因型样本,内标ROX通道均有S 型扩增曲线,可有效指示PCR反应的进行,见图 1、表2。

注:A为CYP2D6*10野生型模板扩增结果,B为CYP2D6*10纯合突变型模板扩增结果,C为CYP2D6*10杂合突变型模板扩增结果;1为FAM通道,2为VIC通道,3为ROX通道。

表2 不同CYP2D6*10基因型的检测Ct值
从图1及表2显示的结果来看,设计的引物和探针对3种不同基因型(野生型、纯合突变型、杂合突变型)有识别能力,这一检测体系可以作为初始体系,并对该检测体系的扩增程序的进行了优化,分别对退火温度、延伸时间和循环数进行测试。见图2~4。

注:A为CYP2D6*10野生型模板58 ℃退火扩增结果,B为CYP2D6*10野生型模板60 ℃退火扩增结果,C为CYP2D6*10野生型模板62 ℃退火扩增结果;1为FAM通道,2为VIC通道,3为ROX通道。

注:A为CYP2D6*10野生型模板退火45 s扩增结果,B为CYP2D6*10野生型模板退火60 s扩增结果,C为CYP2D6*10野生型模板退火70 s扩增结果;1为FAM通道,2为VIC通道,3为ROX通道。

注:A为CYP2D6*10野生型模板扩增35个循环的结果,B为CYP2D6*10野生型模板扩增40个循环的结果,C为CYP2D6*10野生型模板扩增45个循环的结果;1为FAM通道,2为VIC通道,3为ROX通道。
体系随着退火温度升高,体系特异性提高,但是目标信号值下降,S型曲线拐点滞后,说明扩增效率随之降低。60 ℃退火的特异性优于58 ℃,扩增效率优于62 ℃,因此优选退火温度为60 ℃;延伸时间为45 s时,体系扩增曲线拐点不明显,且扩增信号值较低;延伸时间为60 s和70 s时,扩增曲线无明显差异,考虑扩增时间,延伸时间选择60 s;循环数为35个循环时,体系扩增信号值太低,S型不明显;循环数为45个循环时,程序运行时间延长;循环数为40个循环时信号值优于循环数为35个循环时的信号值,并且与循环数为45个循环时的信号值无明显差异,可以满足需求,因此选择循环数为40个循环进行PCR扩增。优化后的扩增程序:37 ℃,10 min,95 ℃,5 min;95 ℃,15 s,60 ℃,1 min,40个循环,于60 ℃退火步骤末采集FAM、VIC和ROX通道荧光信号。
2.3CYP2D6*10荧光定量PCR检测体系性能验证 对CYP2D6*10基因多态性检测体系所要检测的序列的同源序列进行系统分析,将其序列放入NCBI数据库进行blast数据库比对。显示CYP2D7基因与CYP2D6*10基因野生型有94%的一致率。这表明检测体系的扩增区域与CYP2D7基因同源性极高,有一定的非特异性扩增的风险。将选定的CYP2D7序列及内标序列共同构建到pUC57质粒之中,获得CYP2D7质粒,使用CYP2D6*10荧光PCR检测体系,分别检测30 000、20 000、10 000、600、150和30 copy/μL的CYP2D7质粒,见表3。

表3 CYP2D7质粒检测结果
由表3检测结果可知,检测体系扩增最可能产生干扰的CYP2D7同源基因,FAM和VIC通道均无扩增,说明检测体系可以很好的区分同源序列,特异性能符合要求。本研究建立的方法进行检测,其检测结果与Sanger直接测序法结果符合率为100%,见表4,而且由表4检测结果可知,本研究建立的CYP2D6*10检测体系可以对EDTA抗凝全血、枸橼酸钠抗凝全血和石蜡包埋组织的CYP2D6*10基因多态性进行准确的检测。

表4 本方法与Sanger直接测序法结果一致性比较
检测浓度分别为30 000、18 000、9 000、4 500、1 500、150和30 copy/μL的CYP2D6*10基因型为野生型、纯合突变型和杂合突变型的基因组DNA,检测20次,见表5,而且由表5结果可见,本研究建立的CYP2D6*10基因荧光PCR检测体系都可以100%准确检出CYP2D6*10基因不同的基因型,灵敏度较高。

表5 灵敏性检测结果
3 讨 论
CYP2D6在药物代谢中起重要作用。CYP2D6基因多态性会影响其酶活性,造成药物血药浓度波动,进而影响其疗效及不良反应[8-9]。
他莫昔芬(TAM)属于三苯乙烯非甾体类抗雌激素受体拮抗剂,通过与雌激素竞争结合雌激素受体,从而抑制乳腺癌细胞的增殖,广泛应用于雌激素受体阳性乳腺癌的治疗。国内外的大量研究证实,CYP2D6的基因多态性,尤其是CYP2D6*10基因多态性,与乳腺癌患者服用TAM的疗效密切相关[10-12]。CPIC、荷兰药物遗传学工作组(DPWG)、加拿大药物基因组学药物安全网络(CPNDS)临床推荐小组,都建议根据CYP2D6代谢强弱指导TAM的用药[13-15]。2015年国家卫生和计划生育委员会医政医管局发布的《药物代谢酶和药物作用靶点基因检测技术指南(试行)》中指出携带“CYP2D6*10等位基因的患者他莫昔芬的疗效欠佳”[7]。CYP2D6基因多态性对其他大量药物的其疗效及不良反应也有重要的影响。如精神类药物去甲替林、帕罗西汀,抗心律失常药物美托洛尔、美西律等。
开展中国人群的CYP2D6*10基因多态性检测可以预测CYP2D6酶活性,能为相关药物使用提供指导。目前国内外针对CYP2D6分型,一般采用Sanger直接测序法。该方法需要对测序样品扩增、纯化、序列分析,过程比较繁琐、耗时长,且对取材和技术要求比较高,在临床应用中有一定的局限性。另一种常用方法是高分辨率溶解曲线法,该方法对设备要求较高,要求设备温度控制及均一性达到较高水平,且对待分析DNA样本的浓度及纯度有较高的要求,此外,该方法设备运行时间长,结果分析复杂。
荧光定量PCR技术操作简单、设备要求较低、设备运行时间短,通量大,已经成为临床常用的检测方法。本研究基于荧光定量PCR技术平台,采用Taqman探针分型技术结合扩增阻滞突变聚合酶链式反应(ARMS-PCR)技术,建立了一种适用多种类型临床样本(抗凝全血、石蜡组织切片等)的快速检测CYP2D6*10基因的方法。该方法适用样本类型多,检测的灵敏度高、准确性好,将极大促进CYP的科学及临床研究。

