ATP生物荧光检测法在软式内镜清洗质量监测中的应用研究
沈茹 高爱东 马哲红 刘桂芳 钟峰 刘安云
软式内镜属于中度感染风险的医疗器械,由于其复杂精密的构造,难以触及的死角较多,极大增加了诊疗操作后软式内镜的清洗难度,提高软式内镜清洗质量可有效降低生物膜的形成[1-2]。我国在《医疗机构消毒技术规范》(WS/T 367—2012)[3]中推荐使用三磷酸腺苷(adenosine-triphosphate,ATP)生物荧光法监测诊疗器械、器具和物品的清洗效果,目前国内主要的检测方法是菌落计数法,但该方法存在耗时长、结果延迟、操作繁琐等不足。为此,本研究随机抽取皖南医学院第二附属医院内镜中心预处理及漂洗后的胃镜、支气管镜,采用ATP 生物荧光检测仪评价清洗效果,并与菌落计数法结果进行比较,以探究ATP 生物荧光检测技术在软式内镜清洗质量监测中的可行性,以提高软式内镜清洗质量,现将研究结果报告如下:
1 材料与方法
1.1 一般材料
1.1.1 试验材料 选取2019 年5—9 月皖南医学院第二附属医院内镜中心处于使用状态的胃镜、支气管镜为检测对象,每种内镜随机分为A 组和B 组,每组样本量40 个,A 组检测方法为ATP 生物荧光检测法,B 组为菌落计数法。
1.1.2 仪器与试剂 3MTMClean-TraceTM手持式ATP 荧光检测仪及配套的表面、水质采样棒由3M 中国有限公司提供。
1.2 方法
1.2.1 软式内镜的清洗流程 依据《软式内镜清洗消毒技术规范》(WS/T 507—2016)[4]的要求,软式内镜的手工清洗流程包括:预处理、测漏、酶洗、漂洗、消毒、终末漂洗、干燥。
1.2.2 采样方法(1)采样时机:皖南医学院第二附属医院内镜中心的软式内镜严格按照软式内镜手工清洗流程执行,A 组分别在床旁预处理后、漂洗后两个时间点采样,B 组在漂洗后采样。(2)采样部位:选择每条软式内镜的外表面、活检孔、管腔三个部位为检测对象。(3)ATP 生物荧光检测法:采样前规范进行手卫生,并佩戴手套、口罩、工作帽,软式内镜外表面用表面采样棒施以适当压力在距离末端10 cm 处自上而下旋转涂抹5 次进行采样;活检孔用表面采样棒反复旋转涂抹5 次进行采样;管腔采用无菌注射器抽取50 mL 无菌生理盐水从活检孔缓缓注入冲洗并全量收集,用水质采样棒进行检测。采样后将采样棒放入试管,按压拭子激活后水平振荡5 s,放入ATP 生物荧光检测仪读取数据。(4)菌落计数法:采样与检测方法按照《医院消毒卫生标准》(GB 15982—2012)[5]执行,具体采样部位及面积与A 组相同,采样后立即送检,在(36±1)℃恒温箱中培养48 h,计算菌落数。
1.2.3 评价标准 目前国内外对ATP 荧光检测法的软式内镜清洗质量合格标准并未统一,研究采用3MTMClean-TraceTM设备推荐阈值200 RLU 作为清洗质量合格参考值,≤200 RLU可视为清洗合格。
1.2.4 质量控制 为保证检测结果的准确性和稳定性,尽可能降低偏倚,试验过程中需做到以下几点:(1)内镜清洗人员固定1~2 名,采样人员固定为经过专门培训的2 名感染管理科专职人员。(2)采样棒避光存储在2~8℃环境中,使用前在室温下平衡10 min。(3)拿取采样棒时,不能触碰采样棒的头或柄,以免造成污染。(4)ATP 水质采样棒头部浸入待测水样中,轻轻弹击数下待头部表面无气泡后取出检测。(5)荧光检测仪读取发光值(relative light unit,RLU)过程中需保持垂直,且不应移动。
1.3 统计学分析
采用SPSS 16.0 进行数据整理及分析,计数资料采用(n,%)进行描述,计量资料采用中位数(第25 百分位数,第75 百分位数)即M(P25,P75)进行描述,采用Wilcoxon 配对符号秩和检验描述非正态计量资料间的总体分布情况,Spearman秩相关描述非正态计量资料间相关性,秩相关系数rs描述非正态计量资料线性相关强度和方向,检验水准α=0.05;采用GraphPad Prism 5.0 绘制箱式图。
2 结果
2.1 软式内镜预处理后及漂洗后荧光检测结果
漂洗后,两种内镜外表面、活检孔及管腔ATP 值均较预处理后显著下降(P<0.05),其中胃镜3 个采样部位ATP 值M(P25,P75)分别由10 689.5(4 249.0,18 486.3)RLU、2 038.5(1 153.0,2 687.3)RLU、8 730.0(5 909.3,14 237.8)RLU 降 至92.0(52.0,158.8)RLU、33.5(20.5,62.5)RLU、44.0(24.3,142.5)RLU(统计量Z均为-4.782),清洗合格率分别为95.0%(38/40)、90.0%(36/40)、90.0%(36/40);支气管镜三个采样部位ATP值M(P25,P75)分别由8 3 2 3.5(3 827.0,17 476.0)RLU、2 721.5(953.0,5 720.0)RLU、1 920.5(1 256.5,2 752.8)RLU 降至70.5(34.0,132.8)RLU、43.0(27.8,85.3)RLU、7.5(5.0,16.5)RLU(统计量Z均为-4.623),清洗合格率分别为92.7%(37/40)、100%(40/40)、100%(40/40),将检测结果取常用对数后绘制箱式图,如图1。
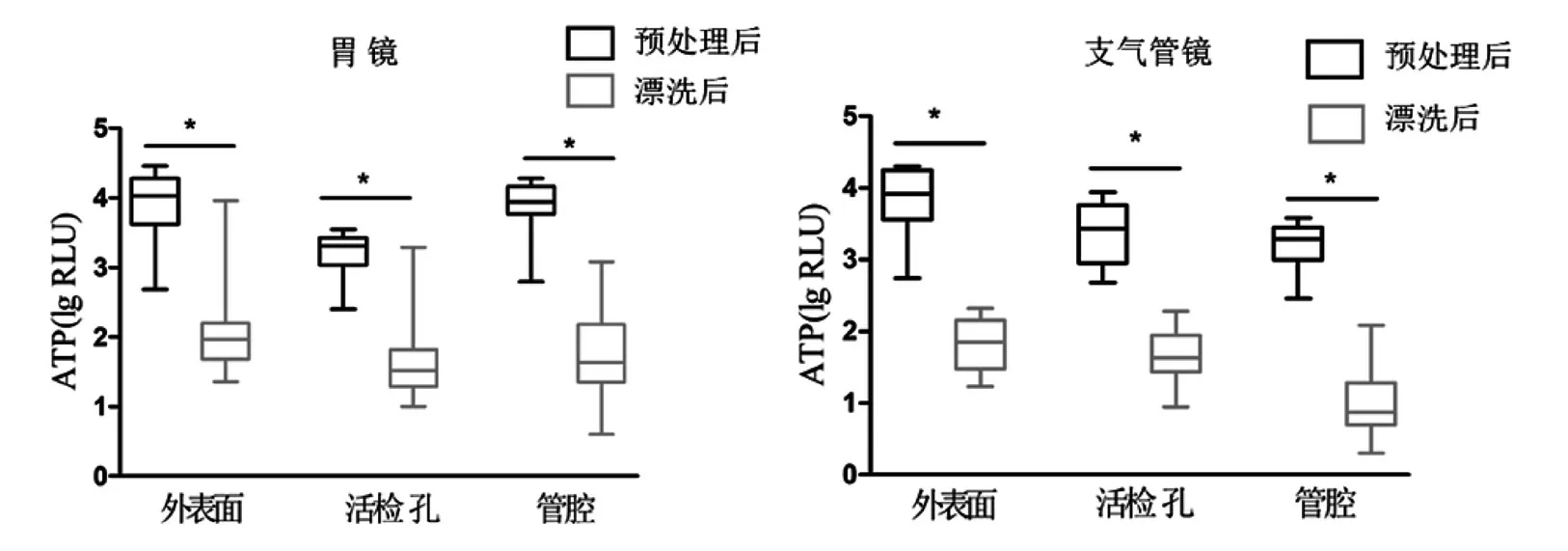
图1 软式内镜预处理后、漂洗后ATP 值的变化情况
2.2 两种方法对漂洗后检测结果的相关性比较
采用Spearman 秩相关描述ATP 检测法与菌落计数法间的相关性,结果显示两种方法在漂洗后内镜各个采样部位的秩相关系数rs均在0.4 以下,且均差异无统计学意义(P>0.05),结果见表1。
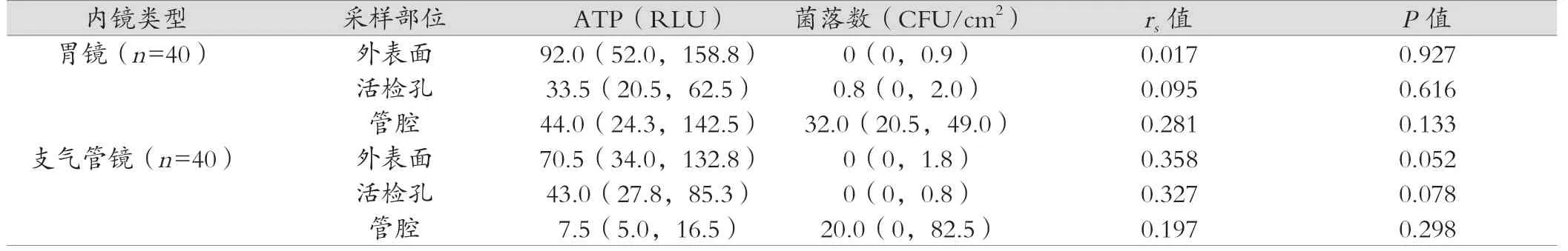
表1 两种检测方法对漂洗后软式内镜不同部位的检测结果相关性分析[M(P25,P75)]
3 讨论
3.1 软式内镜规范化清洗及清洗质量检测的必要性
软式内镜在医疗机构中被广泛用于各种体腔疾病的诊断和治疗,具有结构复杂、价格昂贵及复用率高等特点,其通过非无菌孔道进入患者体内,内镜外表面及内部管道等部位在诊疗操作后微生物负载量呈指数增加,并与医源性感染高度相关[6-8],规范、及时的再处理质量对预防内镜诊疗引起的交叉感染及阻止生物膜的形成至关重要,其中清洗是再处理过程中最重要的一步,充分、有效的清洗是保证后续消毒或灭菌质量的关键[9]。
目镜和(或)借助带光源的放大镜是最基本的诊疗器械清洗质量检测方法,也是《软式内镜清洗消毒技术规范》(WS/T 507—2016)[4]中要求的检测方法,可通过观察器械表面有无血渍、锈迹、水垢等可见残留物直观的判断清洗是否合格,但此法仅可检测出器械表面的可见污染物,对于管腔器械或关节部位的检查结果易出现假阴性,且缺乏客观性,个体差异较大。临床诊疗操作后污染物主要存在于肉眼难以观察到的内镜管腔、齿钳及关节等部位,所以在清洗质量基本检测方法的基础上,需要一种可弥补肉眼无法观察或控制肉眼观察的主观误差的技术手段协助评价清洗质量。ATP 生物荧光检测原理为细胞壁或者细胞膜在提取剂作用下裂解,释放ATP 与荧光素酶反应,将化学能转化成为光能,用荧光检测仪测试荧光强度,由此得出ATP 含量,从而反映微生物污染和有机物残留的程度,可有效反映器械的清洗质量[10-11]。
3.2 ATP 荧光检测法评价软式内镜清洗质量的分析
本研究中,临床诊疗使用后的胃镜、支气管镜经漂洗后,外表面、活检孔及管腔3 个部位的ATP 值较床旁预处理后显著下降,清洗合格率均在90.0%~100%之间,表明通过规范、及时的清洗流程,可去除诸如外表面等规则部位及活检孔、管腔等复杂部位残留的大部分污染物,同时使内镜清洗人员通过量化的发光值快速判断清洗质量是否合格以及内镜的清洗薄弱环节;漂洗后,胃镜、支气管镜ATP 值均表现为外表面污染物残留量高于活检孔及官腔等相对不易清洗的部位,且预处理后ATP 值较高的部位,漂洗后ATP 值仍较高,分析原因可能在于操作人员在处理规则易清洗表面时,对标准流程的依从性降低,主观上认为光滑表面的残留污染物通过简单清洗即可完全去除,从而出现忽视清洗液及擦拭纱布的一用一换或擦拭表面时未适当施以摩擦力等操作不到位现象,造成漂洗后的内镜外表面的污染物残留量高于其他检测部位;研究表明,清洗时适当施以摩擦力可显著降低十二指肠镜的微生物负载量[12-13];另外,国外多项研究表明[14-15],内镜清洗流程中的每个环节之间ATP 水平具有相关性,清洗之前较高的污染水平意味着清洗流程结束后仍具有较高的污染物残留量,本研究结果所呈现规律与之一致。这些研究结果也提示内镜洗消责任部门及质量监管部门在遵循清洗消毒操作规程的同时,应重视诊疗器械手工清洗流程中的每个细节,对薄弱环节采取针对性的优化及强化措施以逐步改进清洗方法,提高清洗质量。
研究发现,ATP 荧光检测法与菌落计数法对漂洗后内镜的检测结果之间秩相关系数rs均在0.4 以下,且差异均无统计学意义(P>0.05),所以尚不能认为两种方法具有相关性,ATP值不能反映实际染菌量,此结果与Parohl 等[15]文献报道一致,但李璇等[16]用ATP 检测仪和菌落计数法检测不同菌种梯度稀释的标准菌悬液,发现两种方法的结果之间基本成直线正相关,文章研究结果则与之相反,分析原因可能为菌落计数法仅代表细菌的污染水平,无法反映有机物污染程度,而ATP 检测法可同时检测微生物及有机物的污染水平,所以在无有机物干扰前提下,两种方法的检测结果之间可以表现出良好的一致性,但临床诊疗实际情况复杂,内镜使用后被患者体内多种有机物污染,故本研究结果显示ATP 发光值不能反映清洗后内镜的实际染菌量。
3.3 ATP 荧光检测法的器械清洗质量监测价值
经验证,通过ATP 水质及表面检测可直观反映软式内镜管腔、活检孔等难以直接观察部位的清洗效果,可作为肉眼无法观察或控制肉眼观察产生的主观误差的技术手段协助评价清洗质量,且手持ATP 荧光检测仪的使用经简单培训即可掌握,将采样棒放入检测仪中仅需10 s 左右就能得出结果,整个检测过程用时在1 min 之内,操作简便、快速,作为现场快速检测方法,可成为检测医疗器械高水平消毒前各个处理环节质量的有效工具;另外,虽然ATP 荧光检测法现阶段无法区分微生物ATP 与非微生物ATP,但可对器械的污染程度进行量化,有效、客观地反映器械的清洗质量,可作为临床诊疗器械清洗质量持续改进过程的重要参考[17-18]。
综上所述,ATP 生物荧光检测法虽然无法确切反映软式内镜清洗后的微生物污染情况,但可作为一种快速、定量的现场评价方法与其他检测方法相结合以应用于胃镜、支气管镜等不同系统软式内镜的清洗质量评价,从技术角度和管理层面来看,可推广到医院感染重点科室,利用其快速、有效的清洁效果评价优势,监测环境、物体表面的清洁状态,以及时发现并处理存在的医院感染隐患,降低医院感染发生率。
——石家庄市保利启新小学软式棒垒球侧记

