高考与竞赛的结合
——分光光度法的相关知识及例题分析
吉林 赵鑫光
(作者单位:长春吉大附中实验学校)
高考是一种综合性、选拔性考试,自《普通高中化学课程标准(2017年版2020年修订)》实施以来,在《中国高考评价体系》的指导下,近几年高考化学试题的命制发生了很大变化,题目设置在考查化学基础知识、基本技能的同时,突出了对化学基本思想和化学学科核心素养的考查,对学生接受、分析、整合化学信息的能力提出了更高的要求,并强化考查了分析和解决化学问题的能力。分光光度法是一种仪器分析方法,在教学科研和化工生产中有重要用途,以分光光度法进行命题,试题情境真实、信息陌生,可以对学生的能力进行较为全面的考查,试题的区分度较大。本文详细介绍分光光度法的相关知识,并配以例题,以期对学生的复习有所帮助。
一、分光光度法概述及相关定律
分光光度法是基于物质对光的选择性吸收而建立起来的分析方法,其特点是灵敏度高,测定的最低浓度可达10-6~10-5mol/L,相当于含量0.000 1%~0.001%的微量组分;准确度较高,分光光度法的相对误差为2%~5%;操作简便,测定速度快,应用广泛。

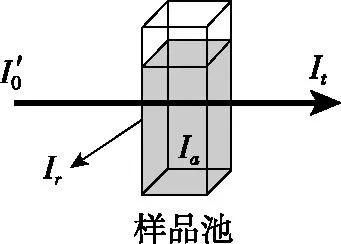
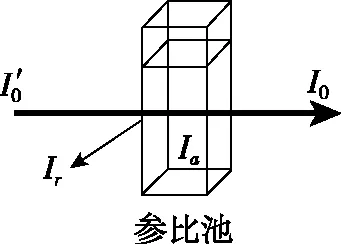
图1
在分光光度法中,测定时采用同样质量的比色皿,反射光的强度基本上是不变的,其影响可以相互抵消,这种方式叫做空白调零。
1.透光率(T)
透过光强度It与入射光强度I0之比称为透光度或透光率。用T表示:
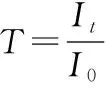
从上式可以看出,T取值为0.0%~100.0%,全部吸收,T=0.0%;全部透射,T=100.0%。
溶液的透光度越大,说明溶液对光的吸收越小,浓度低;相反,透光度越小,说明溶液对光的吸收越大,浓度高。
2.吸光度(A)
若光全部透过溶液,I0=It,A=0;若光几乎全被吸收,It≈0,A=∞。
吸光度A也可以用来衡量溶液中吸光物质对波长为λ的单色光的吸收程度,值越大,其吸收程度越大。
将不同波长的光透过某一固定的溶液,测量不同波长下溶液对光的吸光度,可得到如图2曲线,A、B、C、D代表不同浓度下的吸收曲线。
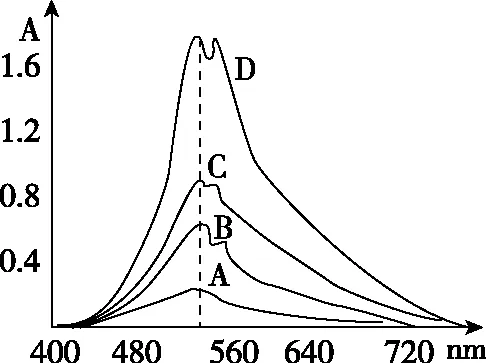
图2 KMnO4溶液的吸收曲线
对吸收曲线的讨论:
(1)同一种物质对不同波长光的吸光度不同。吸光度最大处对应的波长称为最大吸收波长λmax。(KMnO4的λmax=525 nm)
(2)不同浓度的同一种物质,其吸收曲线形状相似,λmax相同。而对于不同物质,它们的吸收曲线形状和λmax则不同。可作为物质定性分析的依据之一。
(3)不同浓度的同一种物质,在某一定波长下吸光度A有差异,A随浓度的增大而增大。此特性可作为物质定量分析的依据。
(4)在λmax处吸光度随浓度变化的幅度最大,所以测定最灵敏。吸收曲线是定量分析中选择入射光波长的重要依据。
二、朗伯—比耳定律
朗伯于1760年发现,当λ、c、T一定时,溶液对光的吸收程度A与液层厚度b成正比,即A∝b。比耳于1852年发现,当λ、b、T一定时,溶液对光的吸收程度A与浓度c成正比,即A∝c。
K为比例常数,它与入射光的波长,有色物质的性质和溶液的温度等因素有关。
上式表示当一束平行单色光通过均匀的溶液时,溶液对光的吸收程度与溶液的浓度和液层厚度的乘积成正比。这一定律也称为光吸收定律。
1.比例系数K
(1)吸光系数a
当c的单位为g/L,b的单位为cm时,比例系数K用a表示,称为吸光系数,其单位为L·(g·cm)-1,则吸光度A=abc。
a是吸光物质在一定的条件下的特性常数,与本性有关,与吸光物质的浓度和液层厚度无关。
(2)摩尔吸光系数ε
当c的单位为mol/L,b的单位为cm时,比例系数K用ε表示,称为摩尔吸光系数,其单位为L·(mol·cm)-1。则吸光度A=εbc。
摩尔吸光系数ε的讨论:
①ε是吸光物质在一定波长和溶剂条件下的特征常数,不随浓度c和液层厚度b的改变而改变。在温度和波长等条件一定时,ε仅与吸收物质本身的性质有关,与待测物浓度无关。
②同一吸光物质在不同波长下的ε值是不同的。在最大吸收波长λmax处的摩尔吸光系数,常以εmax表示。εmax表明了该吸光物质最大限度的吸光能力,也反映了光度法测定该物质可能达到的最大灵敏度。
③εmax越大表明该物质的吸光能力越强,用光度法测定该物质的灵敏度越高。ε<104,反应灵敏度低;104<ε<5×104,反应灵敏度中等;5×104<ε<105,反应灵敏度高;ε>105,反应灵敏度超高。
④ε在数值上等于浓度为1 mol/L、液层厚度为1 cm时该溶液在某一波长下的吸光度。
当c=1 mol/L,b=1 cm时,A=ε。
对于微量组分的测定,一般选ε较大的显色反应,以提高测定的灵敏度。
2.吸光度的加合性
总的吸光度等于各个吸光物质的吸光度之和或溶液的吸光度应等于溶液中各组分的吸光度之和。(组分间没有干扰)
A总=∑Ai=ε1b1c1+ε2b2c2+……εnbncn
溶液中多组分测定时:
3.工作曲线——朗伯—比耳定律的分析应用,溶液浓度的测定
先配制一系列标准溶液,在最大吸收波长处,测出它们的吸光度,作图,相同条件下测未知液的吸光度,从图中查出未知液的浓度示例如图3所示。

图3 标准工作曲线图
四、分光光度法的应用
1.标准曲线法测单一组分
(1)选择合适的显色反应和显色条件;
(2)绘出被测组分的吸收光谱曲线(用标准液);
(3)在λmax下测一系列标准溶液的A值,绘制工作曲线A-c;
(4)与工作曲线相同的方法,测未知物Ax,从工作曲线上查cx。
2.多组分的测定


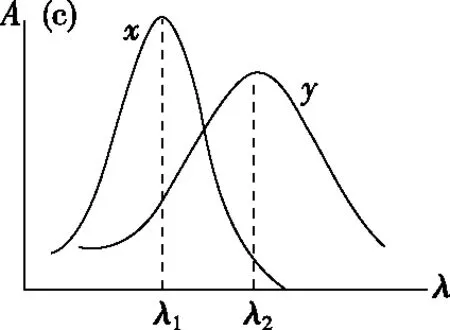
图4
(a)在λ1处测组分x,在λ2处测组分y

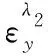
(b)在λ1处测组分x;在λ2处测总吸收,扣除x吸收,可求y

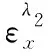
(c)x,y组分不能直接测定

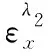

3.高含量组分测定——示差法
参比溶液:浓度稍低的标准溶液c1,用c1调节T%为100%(A=0),若被测溶液的浓度为c2。A1=εbc1,A2=εbc2
ΔA=A2-A1=εb(c2-c1)=εbΔc
结论:两溶液的吸光度差ΔA与浓度差Δc成正比。
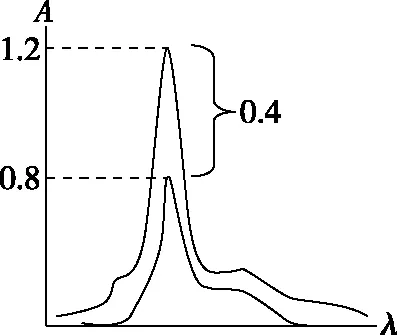
图5
示差法标尺扩展原理:
普通法:cs的T=10%;cx的T=7%
示差法:cs做参比,调T=100%
则:cx的T=70%;标尺扩展10倍
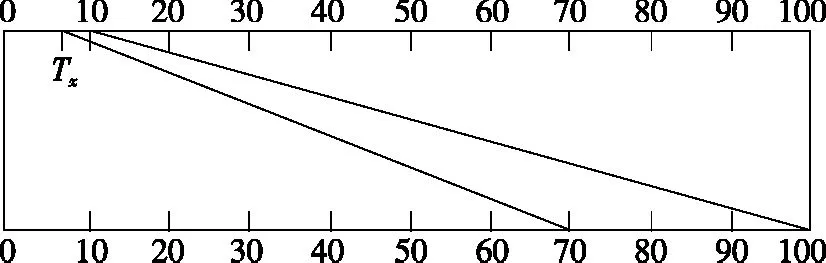
图6
4.双波长分光光度法
ΔA=Aλ2-Aλ1=(ελ2-ελ1)bc
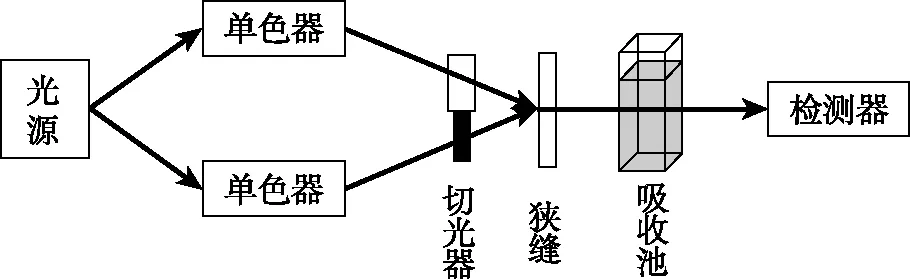
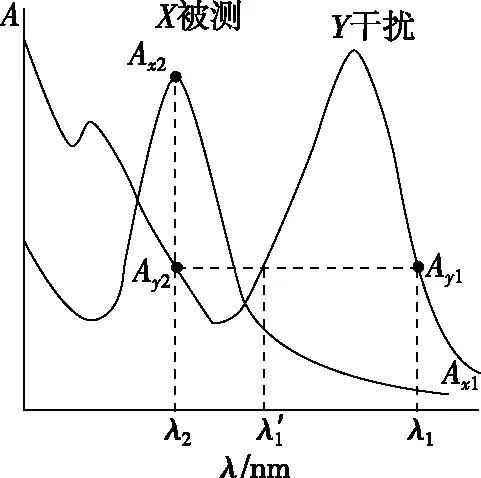
图7
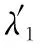
在λ2,Aλ2=Ax2+Ay2;在λ1,Aλ1=Ax1+Ay1;因为Ay2=Ay1
故ΔA=Aλ2-Aλ1=Ax2+Ay2-(Ax1+Ay1)=Ax2-Ax1=ΔAx
ΔAx=(εx2-εx1)bcx;消除了y的干扰。
5.光度滴定
由于在选定的波长下,被滴定的溶液各组分的吸光情况不同,曲线形状不同。例如用EDTA连续滴定Bi3+、Cu2+混合溶液的图像如图8所示,取切线的延长线交点作为滴定终点,V1为Bi3+的终点,V2为Cu2+的终点。
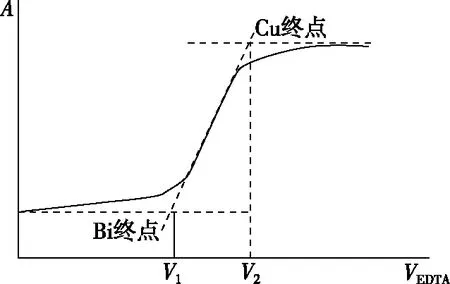
图8
6.弱酸(碱)电离平衡常数的测定

cHA=[HA]+[A-]=cHA·δHA+cHAδA
当b=1 cm时,
A=εHA[HA]+εA-[A-]
高酸度下,几乎全部以HA存在,可测得AHA=εHA·cHA;
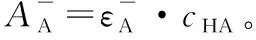
代入整理:A([H+]+Ka)=AHA[H+]+AA-·Ka
六、典型例题
【例1】为测定无水Cu(NO3)2产品的纯度,可用分光光度法。

图9
准确称取0.315 0 g无水Cu(NO3)2,用蒸馏水溶解并定容至100 mL,准确移取该溶液10.00 mL,加过量NH3·H2O,再用蒸馏水定容至100 mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是________(以质量分数表示,保留三位有效数字),写出必要的过程。
【参考答案】92.5%
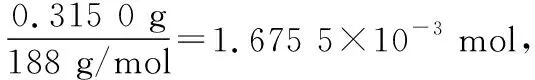
【例2】尿磷是指尿中的全部无机磷酸盐,尿中尿磷的正常值成人为22~48 mmol/24 h,儿童为16~48 mmol/24 h。某些疾病可引起尿磷升高,而另一些疾病会使尿磷降低。在测定磷酸盐的分光光度法中,大多是利用在酸性介质中磷酸盐与钼酸盐形成磷钼杂多酸的反应,反应产物是黄色的,又称磷钼黄。为提高灵敏度,一般采用钼蓝法:在温和条件下将磷钼黄还原为磷钼蓝(MoO2·4MoO3)2·H3PO4·4H2O,然后进行测定。一种测定尿磷(原子量30.97)的方法如下:尿液用钼(Ⅵ)处理,生成磷钼复合物,然后用4-氨基-3-羟基-1-萘磺酸还原,形成磷钼蓝,其最大吸收波长为690 nm。某患者24小时排尿总量1 270 mL,今移取该尿液1.00 mL用钼试剂和4-氨基-3-羟基-1-萘磺酸处理并稀释至50.0 mL,同法处理磷酸盐标准溶液系列,以试剂空白溶液作参比,在690 nm波长处测定吸光值,结果如下(1 ppm=1 μg/mL):
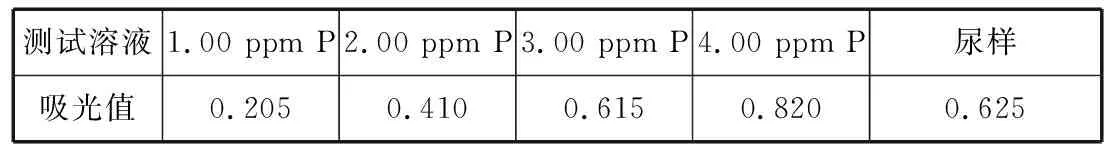
表1
(1)该组测定数据符合一元线性回归方程y=bx+a,计算该患者每天排出的磷为________ppm P。
(2)计算该尿液中磷酸盐的浓度为________mmol·L-1。
【参考答案】(1)3.05 (2)4.92
【解析】(1)回归方程y=bx+a的回归系数:



即尿样测试液含3.05 ppm P。
【例3】Ti和V与H2O2作用生成有色络合物,今以50 mL 1.06×10-3mol/L的钛溶液发色后定容为100 mL;25 mL 6.28×10-3mol/L的钒溶液发色后定容为100 mL。另取20.0 mL含Ti和V的未知混合溶液经以上相同方法发色。这三份溶液各用厚度为1 cm的吸收池在415 nm及455 nm处测得吸光度值如下:
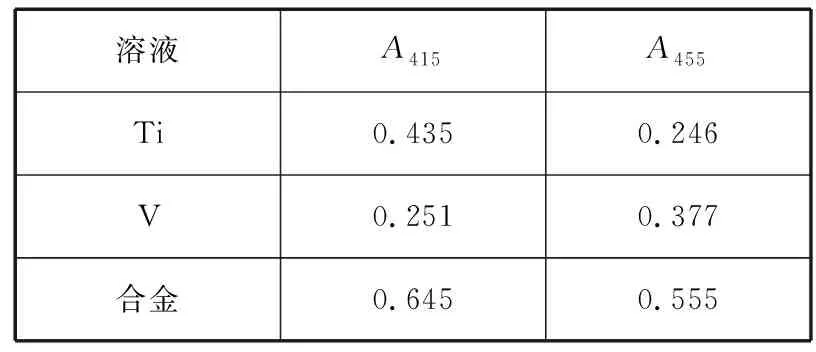
表2
求未知溶液中Ti和V的含量各为多少。
【参考答案】c0(Ti)=2.69×10-3mol/L
c0(V)=6.40×10-3mol/L
【解析】根据A=-lgT=εbc,可求出在不同波长时Ti与V的摩尔吸光系数,即
=8.21×102L·mol-1·cm-1
=4.64×102L·mol-1·cm-1
=1.60×102L·mol-1·cm-1
=2.40×102L·mol-1·cm-1
设含Ti与V的混合溶液发色后的浓度分别为c(Ti)和c(V),根据混合试液在415 nm和455 nm波长下的吸光度,可得到下列方程组
0.645=8.21×102×1×c(Ti)+1.60×102×1×c(V)
0.555=4.64×102×1×c(Ti)+2.40×102×1×c(V)
解方程组,得c(Ti)=5.37×10-4mol/L,c(V)=1.28×10-3mol/L。
则原试液中Ti和V的浓度分别为:
七、分光光度法在高考化学试题中出现形式的预测
分光光度法是一种基于精密仪器的定量分析方法,与传统的滴定定量分析方法有较大区别,在高中化学的课程教学和高考复习中涉及较少,如在高考化学试题中出现,必须以较大篇幅介绍其基本原理,其主要考查方式是对图像的识别和信息的提取,尤其需要注意的是图像中横纵坐标所代表的意义、单位和分度值。由于该方法适用于微量组分的定量测量,所以浓度的单位不一定是国际单位mol/L而有可能是mmol/L或μmol/L,另外横纵坐标的每个小格也不一定代表0.1个单位,有可能是例1中的0.2或0.4个单位。另一种考查方式是计算相关的浓度及各种平衡常数(包括化学平衡常数、电离平衡常数等)。这需要考生对相关公式非常熟悉,并可以根据题意灵活应用。综上所述,高考试题中如出现对分光光度法的考查,其难度一定不大,但综合性可能较强,因此在复习中需要教师对相关内容有一个较为全面的了解,并辅以例题、习题,以达到较好的指导复习效果。

