微生物亚硝化抑制剂对风干肠发酵成熟期间微生物菌落变化的影响及其感官评价分析
陈援援,符慧靖,罗巧枝,任小青,马俪珍
(天津农学院食品科学与生物工程学院,天津 300384)
风干肠是我国著名的传统肉制品,以其独特的风味深受消费者喜爱[1]。然而,由于传统风干肠采用的是自然发酵,会使某些有害微生物不能得到很好的控制而影响产品的风味、安全性和感官品质[2]。在肉馅中定向接种发酵剂能够在发酵的早期阶段与肉馅中的土著微生物群发生竞争,通过产酸和产细菌素来抑制有害微生物的生长繁殖,同时还可以降低发酵产品中的亚硝酸盐残留量和致癌物N-亚硝胺的形成量[3],从而达到提高产品安全性的目的[4]。乳酸菌是大多数传统发酵食品中的主要微生物菌群,它们在发酵食品中起着至关重要的作用。
风干肠的发酵和成熟是一个涉及细菌相互作用的复杂生化过程,发酵温度可以通过加速乳酸杆菌的生长来促进酸化,导致pH 值迅速下降,从而抑制假单胞菌和肠杆菌科菌的生长[5]。不同的发酵剂、外源添加物、工艺参数、气候和地理因素等都可能会影响特定细菌群落的组成,最终对产品感官品质和安全性发挥重要作用[6,7]。因此,需要确定风干肠中的细菌多样性及其相关影响因素,高通量测序技术能够更准确地表征复杂环境生态系统中的微生物多样性,并能在短时间内产生数千个序列,覆盖复杂的微生物多样性和低丰度微生物[8]。Van Reckem 等[9]采用高通量扩增子测序以评估加工因素对肉品自发发酵期间微生物群落变化的影响。研究表明,发酵过程在23 ℃和30 ℃主要由乳酸杆菌和明串珠菌控制,其次是乳酸球菌。大量肉制品微生物多样性测定结果表明,乳酸杆菌属是肉类发酵过程中经常遇到的最普遍的菌属,因为它能很好地适应特定的肉类基质[10]。
微生物亚硝化抑制剂(Microbial Nitrification Inhibitor,MNI)是发酵剂PRO-MIX5(木糖葡萄球菌+清酒乳杆菌+类植物乳杆菌)制备出的菌体碎片,MNI 能有效抑制红肠中N-亚硝胺的生成,提高红肠的安全性和感官品质[11,12]。关于MNI 对风干肠发酵成熟过程中微生物群落动态变化的研究尚未见报道。前期的研究中,风干肠是在25±2 ℃的温恒湿培养箱中进行为期12 d的发酵风干成熟过程,由于发酵温度低,接种的微生物不能快速繁殖产酸,使pH 下降缓慢,这样对腐败微生物的抑制效果不佳。本次试验对前期风干肠的工艺参数进行调整,提高发酵温度为30 ℃,降低风干成熟过程的温度(14~16 ℃)。本研究将前期优选出的能提高风干肠安全品质的PRO-MIX发酵剂、发酵牛骨调味基料和复配抗氧化剂(fermented beef flavorings and compound antioxidant,FBFA)以及MNI应用于风干肠的加工中,探讨几种方式特别是MNI对风干肠发酵成熟过程中微生物群落动态变化,及对风干肠成品感官属性的影响,从而为MNI 在风干肠中的开发应用提供理论指导。
1 材料与方法
1.1 材料与试剂
冷却排酸成熟24 h 的猪后腿肉、猪肥膘、牛骨肉末,天津二商迎宾肉类食品有限公司;食盐、白沙糖、曲酒、味精、酱油、葡萄糖、木糖,天津市红旗农贸批发市场;茶多酚、迷迭香、半胱氨酸、甘氨酸、丙氨酸、复合蛋白酶、风味蛋白酶,豫中生物科技有限公司;VE、异抗坏血酸钠、VB1,苏州佰亿鑫生物科技有限公司;VHI-41(木糖葡萄球菌+戊糖片球菌+植物乳杆菌)、PRO-MIX5(木糖葡萄球菌、清酒乳杆菌、类植物乳杆菌),意大利萨科公司;人工胶原蛋白肠衣:牛二层皮提取、孔径30 mm,神冠控股(集团)有限公司。
9 种N-亚硝胺混标(N-Nitrosamines,NAs):N-二甲基亚硝胺(N-dimethylnitrosamines,NDMA)、N-二乙基亚硝胺(N-nitrosodiethylamine,NDEA)、N-甲基乙基亚硝胺(N-nitrosomethylethylamine,NMEA)、N-二丙基亚硝胺(N-nitrosodipropylamine,NDPA)、N-亚硝基哌啶(N-nitrosopiperidine,NPIP)、N-亚硝基吡咯烷(N-nitrosopyrrolidine,NPYR)、N-亚硝基吗啉(N-nitrosomorpholine,NMOR)、N-二丁基亚硝胺(N-nitrosodibutylamide,NDBA)、N-亚硝基二苯胺(N-nitrosodiphenylamine,NDPheA),美国Supelco公司;NaCl(分析纯),购自国药集团化学试剂有限公司;MRS 培养基、结晶紫中性红胆盐葡萄糖琼脂(VRBA)、假单胞菌CFC 选择性培养基、MSA 培养基,青岛高科技工业园海博生物科技有限公司。
1.2 仪器与设备
SX-500 高压蒸汽灭菌锅,日本TOMY 有限公司;CLIMACELL 恒温恒湿箱、Friocell 22 恒温恒湿培养箱,艾力特国际贸易有限公司;BVBJ-30F 真空搅拌机,浙江嘉兴艾博实业有限公司;XZ-5L 灌肠机,广州旭众食品机械有限公司;CLASSⅡ生物安全柜,天美(中国)科学仪器有限公司;JZ-4 拍打式无菌均质器,天津歆毅翎科技有限公司;JY69-IIN 超声波细胞破碎仪,西瓦卡精密仪器有限公司。
1.3 方法
1.3.1 FBFA 的制备
FBFA 是由发酵牛骨调味基料(fermented beef flavorings,FBF)和复合抗氧化剂(compound antioxidants,CA)复配而成。FBF 的制备参照樊晓盼[13]的方法,牛骨肉末和水按1:4 的比例在0.1 MPa,121℃下高压浸提4 h,将浸提液冷却到室温后,加入0.06%的风味蛋白酶(酶活力3.6 万U/g)和0.03%的复合蛋白酶(酶活力40 万U/g),在50 ℃的摇床中酶解4.5 h,结束后沸水浴灭酶活20 min,等恢复室温后接种入用灭菌乳提前活化2 h 的VHI-41(木糖葡萄球菌+戊糖片球菌+植物乳杆菌)添加量为0.02%,在30℃,130 r/min 条件下振摇发酵12 h,结束后沸水浴灭菌20 min。待冷却至室温后分别加入1.2%木糖、1.2%葡萄糖、0.9%半胱氨酸、0.45%甘氨酸、0.45%丙氨酸、1.8% VB1 搅拌均匀后在110 ℃进行美拉德反应1 h,冷却后于4 ℃静置12 h。最后用两层纱布过滤即为成品FBF。FBF 添加量为肉重的2%,CA 的添加量按照熊凤娇[14]的方法,即茶多酚、迷迭香、VE 和抗坏血酸钠添加量分别为60.14 mg/kg、60.11 mg/kg、60.00 mg/kg 和60.00 mg/kg,将FBF 和CA 以1:1 复配得FBFA。
1.3.2 MNI 的制备
参照李秀明等[12]的方法,将PRO-MIX5 发酵剂按0.02%的量接种入含有质量浓度0.04 μg/mL 的9 种N-亚硝胺(诱导剂)的MRS 肉汤培养基扩增培养,使在600 nm 下的OD 值达到2.0~2.2,于5000 ×g、4 ℃下进行离心15 min 获得菌体沉淀后,用25 mmol/L,pH 为6 的磷酸盐缓冲溶液冲洗菌体,5000 ×g、4 ℃下离心15 min,同样步骤再进行1 次,再用PBS 以1:4 的比例稀释菌体,添加浓度为1 mg/mL 的溶菌酶,在30 ℃下作用2 h,再用功率为200 W 的超声波破碎仪破碎菌体5 min,其中超声2 s 停2 s,最后经过10000×g、4 ℃,10 min 条件下离心后倒掉上清液,得到菌体碎片,即为MNI。
1.3.3 风干肠的制作
(1)腌制:将猪后腿肉剔除筋膜、脂肪,切成8 cm×5 cm×3 cm 的方块,用绞肉机搅碎(筛板孔径8 mm),放入真空搅拌机中,加入占肉总质量(风干肠肥瘦比1:9)1.8%的食盐、0.01%的亚硝酸钠(事先用少量水溶解)和抗坏血酸钠0.55 g/kg,真空搅拌5 min,取出后放入不锈钢盆中,紧贴肉表面盖一层保鲜膜,于4 ℃冷库中腌制24 h。
(2)拌馅:将腌制好的肉倒入真空搅拌机中,依次加入4%白砂糖、1.5%曲酒、0.2%味精、0.3%生抽、10%水、真空搅拌8 min。
(3)灌肠:将制好的肉馅灌入胶原蛋白肠衣中,结扎(每节13~15 cm)、排气。
(4)发酵:将罐制好的肉馅放入30 ℃,RH=90%,风速100%的恒温恒湿培养箱中尽行发酵,在发酵初期隔8 h 测定一次pH,快到发酵终点时每隔1 h~0.5 h测定一次pH,pH 降到接近5.4 时,立刻终止发酵,CK 组、MNI 组、MNIP 组和FBFAP 分别在发酵的第22、12.5、15 和21 h 其pH 降到5.4~5.6。
(5)风干成熟:调节发酵阶段的温度为14~16 ℃,期间调节恒温恒湿培养箱的RH 和风速,恒温恒湿培养箱内的温度、相对湿度参数调节参照李玉娥等[15]的方法,略有调整,通风机比率呈梯度降低调节,以避免后期风干肠体水分过度散失,使质地变硬。具体参数设置如表1 所示,进行为期20 d 的成熟过程。

表1 风干肠工艺参数Table 1 Process parameters of air-dried sausage
1.3.4 试验设计方案
(1)CK 组:按照1.3.3 风干肠的基础配方和工艺制作。
(2)MNI 组:按照1.3.3 风干肠的基础配方和工艺制作,加入肉重0.05%的由PRO-MIX5 制备的菌体碎片(微生物亚硝化抑制剂(microbial nitrosation inhibitor,MNI))。
(3)MNIP 组:按照1.3.3 风干肠的基础配方和工艺制作,加入肉重0.05%的MNI,并接入20 g/100 kg的PRO-MIX5 商业复合菌(木糖葡萄球菌、清酒乳杆菌、类植物乳杆菌)。
(4)FBFAP 组:按照1.3.3 风干肠的基础配方和工艺制作,加入FBFA,并接入20 g/100 kg 的PRO-MIX5 商业复合菌(木糖葡萄球菌、清酒乳杆菌、类植物乳杆菌)。
将灌装好的4 组肉肠放在30 ℃恒温恒湿培养箱中进行发酵,使4 组肠肉馅的pH 降到5.4 左右后,在14~16 ℃条件下进行为期20 d 的风干成熟过程,测定4 组风干肠在发酵和成熟两个阶段乳酸菌、肠杆菌科、假单胞菌和葡萄球菌数的变化情况,及在成熟第1 d和第20 d 的微生物多样性变化,最后对4 组风干肠成品进行感官评价。
1.3.5 指标测定
1.3.5.1 乳酸菌数、肠杆菌科数、假单胞菌数、葡萄球菌数测定
在生物安全柜里无菌操作称取10 g样品放入无菌均质袋中,倒入90 mL 的无菌生理盐水,用无菌均质器拍打2 min,制成10 g/100 mL 的样品匀浆液,吸取1 mL 的样品匀浆液进行10 倍梯度稀释,吸取相应稀释梯度的1 mL 液体到无菌平皿中,每个稀释度下做2个平行,分别倒入MRS 培养基、VRBA、假单胞菌CFC 选择性培养基、MSA 培养基,在35 ℃培养箱中肠杆菌培养24 h,其余菌培养48 h,对乳酸菌、肠杆菌科、假单胞菌、葡萄球菌的菌落进行计数。
1.3.5.2 微生物多样性分析
将4 组风干肠成品送到北京奥维森基因科技有限公司,采用扩增子测序16S rDNA 的V3-4 区段,分析样品细菌群落结构等,对样品进行细菌多样性分析[16],扩增区段引物序列为:ACTCCTACGGGAGGC AGCAG,GGACTACHVGGGTWTCTAAT。
1.3.5.3 感官评定
将风干20 d 的4 组风干肠样品做好标记放入沸水中煮制15 min,切成约3 mm 左右的薄片,随机编号放入样品盘中,由本实验室经过感官培训的10 名人员组成感官评定小组。所有样品分别用三位数字编码,并随机提供,以避免遗留效应。在对每个样品进行测试之前,还提供了冷水用于漱口。评分标准见表2 所示。

表2 感官评分标准Table 2 Sensory evaluation standard
1.4 数据处理
采用Microsoft Excel 2010软件计算平均值和标准差,用SPSS 19.0 软件进行显著性分析,Origin 2018软件作图。
2 结果与分析
2.1 4 组样品在发酵和成熟过程中各种微生物数量的变化
在30 ℃发酵阶段,MNIP 组、MNI 组和FBFAP组的初始乳酸菌数分别为7.32 lg cfu/g、7.54 lg cfu/g、6.39 lg cfu/g,比CK 组(5.54 lg cfu/g)高,如图1a,可能与添加的发酵剂和MNI 有关,这一结果与其他研究报告一致[17,18],使用选择性发酵剂生产风干肠会显著影响乳酸菌的数量。随着发酵时间的延长,4 组样品中乳酸菌数逐渐增加,MNIP 组、MNI 组、FBFAP组和CK 组分别在发酵的第12.5 h、15 h、21 h 和22 h达到发酵终点(即肉馅pH 值降到5.4~5.6),乳酸菌数分别增加到8.91 lg cfu/g、8.99 lg cfu/g、8.85 lg cfu/g和8.88 lg cfu/g,成为4 组风干肠的优势菌群,其中MNI 组和MNIP 组的乳酸菌数为组内最高,分析其原因,可能是PRO-MIX5 菌体碎片(MNI)中存在群体感应的信号因子,能够促进肉馅中土著乳酸菌快速生长繁殖,试验说明添加MNI 能达到接种活的乳酸菌发酵剂的效果。发酵完成后,调节恒温恒湿培养箱温度为14~16 ℃,让4 组风干肠一起进入成熟阶段。经风干1 d 后,CK 组、MNI 组、MNIP 组和FBFAP 组乳酸菌数分别为8.78 lg cfu/g、8.97 lg cfu/g、8.72 lg cfu/g和8.70 lg cfu/g,如图1b 所示。随着风干成熟时间的延长,到成熟终点时CK 组、MNI 组、MNIP 组和FBFAP 组乳酸菌数分别降为8.43 lg cfu/g、8.47 lg cfu/g、8.14 lg cfu/g、8.30 lg cfu/g,在成熟过程中乳酸菌的轻微下降可能是由于可供微生物利用的碳水化合物逐渐被消耗[19]、aw 降低[20],该结果与Lorenzo[2]的报道一致。在整个成熟阶段,MNI 组的乳酸菌数明显高于CK、MNIP 和FBFAP,说明MNI 组的优势菌群乳酸菌数量最多。到成熟的第20 d,MNIP 组的乳酸菌数降为组内最低(8.14 lg cfu/g),MNI 组乳酸菌数仍为组内最高(8.47 lg cfu/g),这可能是因为MNIP组接种的清酒乳杆菌和类植物乳杆菌在MNI 的诱导下大量产酸,由于乳酸的积累,蛋白质形成致密的凝胶结构,使MNIP 组乳酸菌数显著降低(p<0.05)。
肠杆菌科和假单胞菌是发酵肉制品中常见的腐败微生物。在发酵前(0 h),4 组样品肉馅体系中初始肠杆菌科菌数基本保持在5.10~5.94 lg cfu/g 水平,如图1c,这取决于原料的卫生质量和加工过程中的处理条件[21];3 个处理组初始假单胞菌数为4.92~5.70 lgcfu/g显著低于CK 组(6.62 lg cfu/g)(p<0.05),如图1e,说明加入的MNI、MNIP 和FBFAP 在拌馅和灌肠的过程中开始发挥抑菌作用。随着发酵的进行,4 组样品中肠杆菌科菌数、假单胞菌数呈先升高后缓慢降低趋势,到各自发酵终点时可以明显看到MNI 组、MNIP组和FBFAP 组的肠杆菌科菌数和假单胞菌数显著低于CK 组(p<0.05),尤其是MNIP 和MNI 组,这归因于3 个处理组在发酵阶段乳酸菌成为酸化肉馅中的优势菌群,有助于防止腐败微生物的生长[22],另一方面乳酸菌也能够释放抗菌肽并抑制腐败细菌生长繁殖[1]。相比之下,在成熟期间,4 组风干肠中的肠杆菌科数和假单胞菌数持续下降,这主要是因为体系中营养物质的消耗、氧气浓度的降低以及代谢物和有机酸的积累等原因,细菌生长速度减慢并开始下降[23],且在整个风干成熟过程中MNIP组和MNI组的肠杆菌科数和假单胞菌数显著低于CK 组(p<0.05),如图1d 和图1f。到成熟终点时,4 组风干肠中,肠杆菌科和假单胞菌数均降到了最低,其从小到大的关系为:MNIP<MNI<FBFAP <CK,这表明在风干肠中加入MNI、MNIP、FBFAP 可以降低风干肠成品的肠杆菌科菌数和假单胞菌数,提高了风干肠的安全性。
MNIP 组和 FBFAP 组由于加入的发酵剂PRO-MIX5 中含有木糖葡萄球菌,所以其葡萄球菌数在发酵前显著高于CK 组和MNI 组,如图1g。到各自发酵终点,MNI 组(7.13 lg cfu/g)、MNIP 组(6.78 lg cfu/g)和FBFAP 组(8.42 lg cfu/g)葡萄球菌数显著低于CK(8.70 lg cfu/g)组(p<0.05),且在成熟阶段也保持同样的大小关系如图1h,4 组风干肠葡萄球菌数呈不同比例的降低趋势。到成熟终点时,MNI 组(5.73 lg cfu/g)和MNIP 组(5.70 lg cfu/g)葡萄球菌数为组内最低,FBFAP 组(8.00 lg cfu/g)次之,CK组(8.17 lg cfu/g)为组内最高。这是由于MNI 和MNIP组乳酸菌群的酸化能力较强所致,该结果与许多报道一致,即在强烈酸化条件下会抑制对pH 敏感的葡萄球菌生长[24,25]。
2.2 4 组样品在成熟第1 d 和20 d 的微生物多样性指数动态变化
Chao1 为菌种丰富度指数,用以估计群落中的OTU 数目,observed_species 表示随测序深度的增加,实际观测到OTU 的个数。一般情况下,如果序列之间的相似性高于97%(种水平)就可以把它定义为一个OTU,每个OTU 代表一个物种[26]。4 组样品在成熟第1天和第20天的微生物多样性指数动态变化见表3 所示。由表3 可知,在风干成熟的第1 d,CK(391.44、233.00)组和MNI(230.11、163.00)组的Chao1 指数和observed_species 指数远低于MNIP(819.51、743.00)组和FBFAP(855.27、630.00)组,其中MNI组的菌群丰富度最低,可能是CK 组和MNI 组没有接种活菌,且加入的MNI 对肉馅中的腐败菌具有抑制作用,所以经过发酵后,在成熟初期,接种有PRO-MIX发酵剂的MNIP 组和FBFAP 组菌种丰度大幅度增加。到风干成熟的第20 天时,MNI(779.36)和MNIP(731.77)组Chao1 指数高于CK(589.44)和FBFAP(415.14)组,这说明此阶段MNI 组和MNIP 组风干肠含有大量乳酸菌等优势菌群。据报道,乳酸菌可以抑制或杀死食品中的腐败微生物和致病微生物[27],提高发酵肉制品的安全性。Shannon 和Simpson 表征了群落物种分布的多样性和均匀性,由表3 可以看出,在风干的第1 天和第20 天,MNI 组和MNIP 组的Shannon、Simpson 指数均低于CK 组,主要是由于这两组样品肉馅体系中pH 较低,一些微生物菌群的生长受到抑制,进而使微生物多样性降低[28],这一结果有利于提高风干肠的安全性。8 个样品的goods_coverage 均为100.00%,表明测序深度的结果可以很好地描述所有样品中的微生物群落。
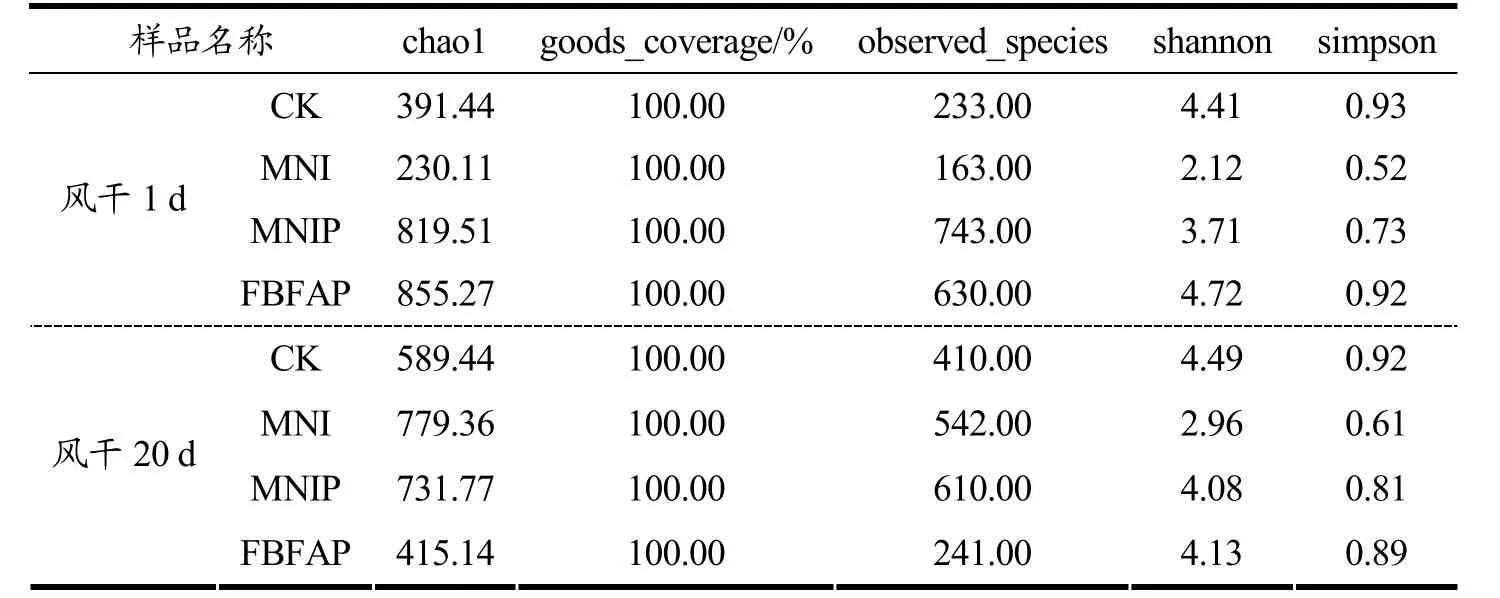
表3 4 组样品在成熟第1 天和第20 天的微生物多样性指数动态变化Table 3 Dynamic changes of microbial diversity index of four groups of samples on the 1st and 20th days of maturity
2.3 4组样品分别在成熟第1天和第20天中基于门水平微生物群落结构动态变化分析
4 组样品在成熟第1 天和第20 天中基于门水平的微生物群落结构组成及相对丰度变化如图2 所示,在8 个样品中共鉴定出28 个门水平的微生物种群,其中相对丰度大于1%的有5 个,分别为Firmicutes(厚壁菌门)、Proteobacteria(变形菌门)、Bacteroidota(拟杆菌门)、Actinobacteriota(放线菌门)和Acidobacteriota(酸杆菌门)。8 个样品中厚壁菌门和变形菌门最为丰富,占所有OTU 的93%以上,这与Zhang 等[29]测定结果相似,Deng 等[30]研究湖北恩施香肠发现,在门水平上鉴定出厚壁菌门(57.01%)、变形菌门(30.43%)、蓝藻门(7.67%)、拟杆菌门(2.63%)和放线菌门(2.01%),其中厚壁菌门和变形菌门为优势门。拟杆菌门(1.22%~3.56%)、放线菌门(0.17%~1.77%)和酸杆菌门(0.00~1.16%)在4 组样品中占很少一部分。在风干成熟的第1 天,MNI 组的厚壁菌门丰度占比最高为77.81%,变形菌门丰度占比为组内最低19.73%,说明加入MNI 的风干肠肉馅经过发酵后,有利于降低微生物多样性,提高风干肠的安全品质,CK 组、MNIP 组和FBFAP 组在厚壁菌门丰度上基本一致,分别为69.14%、67.07%和68.52%。随着风干时间的延长,到成熟终点20 d 时,MNI 组厚壁菌门相对丰度略有降低(74.41%),变形菌门有略微增加,但MNI 组的厚壁菌门OTU 仍为组内最高,变形菌门OTU 为组内最低,CK 组、MNIP组和FBFAP 组厚壁菌门有小幅度升高,变形菌门呈降低趋势,变形菌门包括许多革兰氏阴性腐败菌,它们经常作为风干肠中的不良细菌参与其中[31],试验说明风干成熟过程能抑制风干肠腐败微生物的生长。
2.4 4 组样品在成熟第1 d 和20 d 中基于属水平的微生物群落结构动态变化分析
4 组样品在成熟第1 天和第20 天基于属水平的微生物群落结构组成及相对丰度变化如图3 所示。在属水平上,根据OTU 分析,共鉴定出237 个属,乳酸杆菌是MNI 组和MNIP 组风干肠中最丰富的菌属,其相对丰度占比在成熟第1 天分别为74.93%和53.72%,在种水平上鉴定出主要为植物乳杆菌(68.33%、50.20%)和少量的清酒乳杆菌(6.57%、3.46%)。到成熟第20 d,由于风干过程中水分减少,肉馅体系溶氧量降低等环境条件变化,不利于微生物生长,MNI组和MNIP 组的乳杆菌属分别降低为66.36%和46.87%。乳酸杆菌和链球菌是FBFAP 组风干肠成品中属水平的主要菌,分别占相对丰度的23.63%和24.46%,在种水平上鉴定为清酒乳杆菌(16.60%)、副乳房链球菌(24.42%)和少量的植物乳杆菌(6.99%),Wang 等[32]使用清酒乳杆菌亚种作为发酵剂接种到四川香肠中,结果表明,乳酸菌能迅速控制香肠发酵过程中菌落总数的生长,抑制大肠杆菌等食源性致病菌的生长。乳酸菌可以分解香肠中的碳水化合物,产生大量的乳酸和少量的醋酸以及丙酸、甲酸、3-甲基丁酸、丁酸等有机酸,从而延长香肠的保质期[33]。与MNI 组、MNIP 组和FBFAP 组相比,CK 组在成熟过程中乳酸菌群更加多样化,包括乳酸杆菌属、链球菌属、肠球菌属、漫游球菌属、明串珠菌属、乳球菌属、肉杆菌属和梭菌属等。由此可以看出,单独添加MNI 能促进风干肠中优势菌群乳杆菌属的生长,在接种有PRO-MIX5 发酵剂的前提下,加入MNI 和FBFA 均会影响风干肠肉馅中微生物多样性。大量研究表明,乳酸杆菌属、链球菌属、肠球菌属、漫游球菌属、明串珠菌属、乳球菌属和肉杆菌属是风干肠中的主要乳酸菌[34],有学者报道称由于乳酸杆菌和乳酸球菌能够将蛋白质分解为肽和氨基酸,因此它们被认为是香肠中形成独特酸味和丰富风味的主要原因[35]。到成熟结束时,CK 组、MNI 组、MNIP 组和FBFAP组风干肠成品中,不动杆菌属、弧菌属、沙雷氏菌属、发光细菌属、香味菌属、嗜冷杆菌属、克雷伯菌属和米勒氏菌等革兰氏阴性腐败菌相对丰度分别降为22.53%、19.35%、22.27%、26.11%。MNI 组中这些腐败细菌的相对丰度低于其它3 组,分析其原因,可能是成熟过程大量乳杆菌(如植物乳杆菌)具有抑制其它腐败微生物生长繁殖的作用。Wang 等[36]研究表明植物乳杆菌LPL-1 产生的一种新型IIa 类细菌素,对食源性细菌具有杀菌活性,Gao 等[37]研究表明,清酒乳杆菌能产生广谱抗菌细菌素,抑制有害微生物的生长。葡萄球菌在MNIP 组风干肠成品中相对丰度占比最高(2.75%),且在种水平上鉴定出以木糖葡萄球菌为主,其余3 组风干肠成品中葡萄球菌相对丰度低于1%。葡萄球菌具有硝酸还原酶活性、过氧化氢酶活性等,可以提高产品的颜色稳定性,减少酸败的发生[38]。
2.5 4 组风干肠感官评定结果
感官评价是预测氧化稳定性、产品保质期和消费者可接受性的最重要方法[39]。经过培训后的感官评定小组对4 组风干肠成品的感官属性(嫩度、颜色、咀嚼性、回味、酸味、酸败味、风味和整体可接受性)进行评估,其结果如图4 所示。CK 组、MNI 组、MNIP组、FBFAP 组风干肠在酸败味和酸味感官属性方面表现出相似的分数,小组成员对4 组样品没有发现明显的酸败味和酸味差异。与CK 组相比,3 个处理组具有较好的颜色、回味、嫩度、风味和整体可接受性,MNI 组、MNIP 组和FBFAP 组在嫩度上的得分高于CK 组,可能是3 个实验组中微生物能产生大量的胶原蛋白酶,提高了风干肠的嫩度[40],Sun 等[41]研究发现,从哈尔滨风干肠中分离出的短乳杆菌产生的蛋白酶可与肌凝蛋白轻链、重链和肌钙蛋白相互作用,可加速肉蛋白的降解,促进肉质嫩度,进而改善哈尔滨干香肠的风味和品质。MNI 组和MNIP 组风干肠在咀嚼性方面不及FBFAP 组和CK 组,可能是添加的MNI和MNIP 促进肉馅中乳酸菌产生大量蛋白酶,使肌原纤维蛋白水解变性,形成致密的凝胶结构,再经过20 d 的风干成熟过程,使水分散失,进而增加了MNI 组和MNIP 组风干肠的咀嚼,在许多研究中,咀嚼性受到蛋白质水解的积极影响,而不受硬度的积极或消极变化的影响,研究发现,蛋白质的水解现象和水分结合能力影响香肠的咀嚼性,进而影响风味的释放和感知[42]。后期可以考虑进行微发酵或缩短成熟时间来改善MNI 组和MNIP 组风干肠的咀嚼性能。整体而言MNIP 组风干肠有较好风味、回味、嫩度,且总体可接受性得分为组内最高,说明添加MNIP 能提高风干肠的感官属性。研究表明微生物与风干肠中独特的风味有着必然的联系。Chen 等[43]发现,从酸肉中分离的木糖葡萄球菌SX16 和植物乳杆菌CMRC6 在体外具有优异的蛋白水解活性,可改善香肠的感官特性。许多乳酸菌中被鉴定出脂肪酶、酯酶和磷脂酶,且大多数乳酸菌脂肪酶具有细胞外活性。脂肪酶能在发酵的肉制品中产生独特的风味,研究表明,植物乳杆菌,具有很强的脂解活性,有助于风味和香气的形成[44]。
3 结论
加入MNI、MNIP 和FBFAP 能促进肉馅中乳酸菌在发酵过程中快速繁殖而成为优势菌群,抑制腐败微生物如肠杆菌科、假单胞菌和酸敏感性葡萄球菌的生长。4 组风干肠中乳酸菌、肠杆菌科、假单胞菌和葡萄球菌数在成熟过程中呈不同程度的减少。在整个成熟过程中,MNI 组和MNIP 组肠杆菌科、假单胞菌和葡萄球菌数显著低于CK 组(p<0.05),MNI 组乳酸菌在成熟的整个阶段为组内最高。加入FBFAP 能抑制风干肠成品中的肠杆菌科数(5.54 lg cfu/g)和假单胞菌数(5.66 lg cfu/g),但其抑制效果不及MNI(4.23 lg cfu/g、4.76 lg cfu/g)和MNIP(3.93 lg cfu/g、4.33 lg cfu/g)组,说明在接种有发酵剂PRO-MIX5 的风干肠中加入MNI 对腐败微生物的抑制效果优于FBFAP。微生物多样性分析结果表明,4 组风干肠在成熟第1 d和第20 d 的基于门水平的微生物群主要为厚壁菌门、变形菌门、拟杆菌门、放线菌门和酸杆菌门,其中厚壁菌门和变形菌门最丰富,占相对丰度的93%以上;在属水平上的鉴定结果表明:乳酸杆菌是MNI、MNIP组的优势菌属,在种水平上鉴定出主要为植物乳杆菌(68.33%、50.20%)和少量的清酒乳杆菌(6.57%、3.46%),其相对丰度随着成熟时间的延长略有降低。乳酸杆菌和链球菌是FBFAP 组风干肠成品的优势菌属,在种水平上鉴定为清酒乳杆菌(16.60%)、副乳房链球菌(24.42%)和少量的植物乳杆菌(6.99%),CK 组在成熟过程中乳酸菌群更加多样化。革兰氏阴性腐败微生物在4 组风干肠中相对丰度随成熟过程进行呈降低趋势,在MNI 组的相对丰度最低为19.35%。加入MNI、MNIP 能显著提高风干肠的安全性,MNIP能提高风干肠的质地、色泽、风味等感官性能。

