内源性n-3多不饱和脂肪酸对下丘脑神经干细胞来源外泌体miRNA的调节
路宗博,张盈月,葛科立,张金玉,薛美兰,葛银林
(青岛大学基础医学院,山东 青岛 266073)
肥胖是由多种因素导致的慢性代谢性疾病,表现为脂肪在体内过多堆积和异常分布。下丘脑对机体能量平衡的调节发挥重要作用,下丘脑炎症和肥胖之间有密切关系,抑制下丘脑炎症有助于抵抗肥胖的发生与发展。下丘脑神经核团的肽能神经元可以合成并释放对能量代谢和摄食行为进行调节的神经肽。炎症反应在糖脂代谢紊乱中发挥重要作用,抑制炎症反应有利于改善糖脂代谢。
-3多不饱和脂肪酸(-3 polyunsaturated fatty acids,-3 PUFAs)是人体必需脂肪酸,有研究显示,其具有抗炎作用,可以抑制炎性因子白细胞介素(interleukin,IL)-1、IL-6、肿瘤坏死因子(tumor necrosis factor,TNF)-α的释放,阻断机体过度炎症反应,也可能通过下调Toll样受体4(Toll-like receptor 4,TLR4)/髓样分化因子88(myeloid differentiation factor 88,MyD88)/核因子κB(nuclear factor-κB,NF-κB)通路相关基因表达而抑制炎症反应。摄入富含-3 PUFAs的膳食可以减轻胰岛素抵抗和降低肥胖症患病率,能够有效改善糖脂代谢异常的情况。Kang将秀丽隐杆线虫()的基因转入C57BL/6小鼠,得到转基因小鼠,使其可以将-6 PUFAs转化为-3 PUFAs,增加内源性-3 PUFAs的含量,小鼠成为研究-3 PUFAs作用的最佳模型。前期研究发现,相同饲养条件下,小鼠体质量以及Lee’s指数显著低于野生型小鼠,且小鼠下丘脑组织中的炎症因子、、、、的mRNA相对表达量明显下调,mRNA相对表达量明显上调,表明小鼠下丘脑中的炎症反应明显低于野生型小鼠。这提示内源性-3 PUFAs含量的增加与减轻小鼠下丘脑炎症并抵抗肥胖有关,但其机理目前尚不明确。
外泌体是一种包含蛋白质、核酸(DNA、mRNA、microRNA、lncRNA、circRNA等)和脂质等内容物的囊泡结构,对于外泌体参与疾病发生发展影响的具体分子机制,目前研究还不够透彻。外泌体可以通过参与细胞间通讯、细胞增殖与迁移等过程,影响受体细胞基因的表达和功能的改变,进而广泛参与众多疾病的发生与发展。其中,研究最多的就是外泌体内容物中的miRNA,虽然以当前的技术水平还很难排除外泌体中其他内容物对受体细胞的影响,但是miRNA仍被视为外泌体中最关键的功能元件。研究表明,细胞释放的外泌体miRNA有两种类型的功能,一种是直接与靶基因mRNA特异结合,影响受体细胞中基因的表达;另一种方式是作为特异受体的激动剂发挥配体作用从而直接与蛋白质相互作用。外泌体miRNA可以与相邻细胞直接反应或者通过体液循环到达受体细胞发挥作用。推测可能是下丘脑神经干细胞来源的外泌体经脑脊液等渠道,影响临近小胶质细胞和下游与脂质代谢相关细胞的基因表达,从而发挥抑制下丘脑炎症并抵抗肥胖的作用。
本实验以转基因小鼠为模型,以野生型C57BL/6小鼠为对照,研究内源性-3 PUFAs对下丘脑神经干细胞来源的外泌体miRNA的调节作用,探究-3 PUFAs抑制下丘脑炎症及肥胖的作用机理。
1 材料与方法
1.1 动物、材料与试剂
本课题组所饲养的SPF级转基因小鼠(杂合)由美国哈佛医学院康景轩教授建立及赠送,野生型C57BL/6小鼠由转基因小鼠传代获得。将上述小鼠置于青岛大学生物医学中心的实验动物中心进行饲养。动物实验通过青岛大学生物医学中心伦理委员会审查。
DNA提取酚试剂 北京索莱宝科技有限公司;无水乙醇、氯仿;异戊醇 国药集团化学试剂有限公司;T3 Super PCR Mix 北京擎科生物科技有限公司;PAGE凝胶快速制备试剂盒 上海雅酶生物科技有限公司;一抗兔抗鼠CD63、标记山羊抗兔IgG二抗 美国Abcam公司;HiScriptIII RT SuperMix for qPCR(+gDNA wiper)、ChamQTMSYBRColor qPCR Master Mix南京诺唯赞生物科技有限公司;NEBNextPoly(A) mRNA Magnetic Isolation Module 美国New England Biolabs公司;Ribo-ZeroMagnetic Gold Kit (Human/Mouse/Rat)美国Epicentre公司;NEB Multiplex Small RNA Library Prep Set for Illumina、TruSeq Rapid SR Cluster Kit 美国Illumina公司。
1.2 仪器与设备
1.3 方法
1.3.1 小鼠的饲养及基因型鉴定分组
将转基因小鼠与野生型C57BL/6小鼠进行杂交,待雌鼠怀孕后单独饲养,直至幼鼠出生。对同窝新生幼鼠进行标记后剪取新生幼鼠尾尖1~2 mm,用酚-氯仿法提取组织的基因组DNA。通过普通PCR法扩增基因,根据琼脂糖凝胶电泳结果,将新生幼鼠分为转基因组与野生型C57BL/6组(WT组)。
1.3.2 小鼠下丘脑神经干细胞的培养及细胞鉴定
分别取转基因组与WT组新生幼鼠各3 只,用体积分数75%乙醇溶液进行体表消毒后,在超净工作台进行解剖,获得其下丘脑组织。用移液器枪头将下丘脑组织在细胞筛中进行充分研磨,然后用无菌磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.4,下同)重悬洗涤。3 000 r/min离心5 min后,弃上清液,用神经干细胞完全培养基将细胞重悬,按照5×10个/mL的密度接种于T75一次性培养瓶中,进行原代培养。
在37 ℃ CO恒温培养箱培养7 d后传代,同时取部分细胞进行形态学及蛋白水平的鉴定。在光学倒置显微镜下观察细胞形态,与ATCC细胞库中的下丘脑神经干细胞(hypothalamus neural stem cells,htNSCs)形态学信息进行比对,鉴定所培养的细胞是否为htNSCs。此外,取部分细胞进行蛋白质提取,然后通过Western blotting对神经干细胞标志蛋白Nestin进行表达鉴定。
1.3.3 htNSCs来源的外泌体提取与鉴定
对于携手共建澜湄合作命运共同体,云南省人民政府副省长任军号提出三点倡议:一是提升区域经济整体竞争力,积极推动落实《澜湄国家关于加强跨境经济合作的部长级联合声明》,共同编制《澜湄国家跨境经济合作五年发展规划》,实施《澜湄区域合作智能贸易网络倡议》。二是基础先行,不断加快澜湄合作互联互通建设,推动各类互联互通便利化措施取得实效。三是亲诚惠容,不断深化交流合作,使澜湄合作的成果更多惠及民众。
收集组、WT组htNSCs培养上清液,每个样本取细胞上清液50 mL,差速超速离心法提取外泌体进行鉴定。500×离心5 min,从细胞上清液样品中去除细胞。转移上清液到新的离心管中,2 000×离心10 min,再将上清液转移到新的离心管中,10 000×离心30 min,去除脱落的微泡。上清液用0.22 μm的过滤膜过滤,100 000×离心2 h,沉淀中加1×PBS,吹打混匀。重复上一步骤一次,用50~100 μL 1×PBS重溶外泌体,-80 ℃保存。采用透射电子显微镜观察外泌体微结构,从-80 ℃冰箱取出样本的PBS悬液解冻,用镊子轻轻夹取一枚铜网,用铜网在样本的PBS悬液中捞取2~3 次,使样本附于铜网上,吸取1%的磷钨酸滴加到铜网上,染色2~10 s,用灭菌的滤纸片吸去多余的悬液与染色液,轻轻将铜网放置于透射电子显微镜样品槽中进行观察;采用NTA技术测定样本浓度与粒径分布,该技术依赖于Nanosight平台,可以根据观察到的样本中颗粒的运动轨迹得到颗粒的粒径数据,并利用平台对所有样本颗粒做跟踪分析,最终得出样本的粒径数量分布情况与颗粒物的浓度数据;利用Western blotting进行外泌体表面标志蛋白CD63的表达鉴定。
1.3.4 miRNA高通量测序及miRNA差异表达分析
提取外泌体总RNA,经琼脂糖凝胶电泳和NanoDrop ND-1000超微量分光光度计质检定量后,构建文库,采用2100芯片生物分析仪进行文库质量测定,测序文库在0.1 mol/L NaOH溶液作用下变性成单链DNA,在Illumina NextSeq 500测序仪上进行51个循环测序。使用edgeR软件包进行组间miRNAs的差异表达分析。通过设定阈值为1.5 倍差异(fold change)、≤0.05且组内CPM平均值≥1来筛选差异表达miRNA。对比小鼠与WT组野生型C57BL/6小鼠htNSCs来源的外泌体差异表达的miRNA。
1.3.5 差异表达miRNA的靶基因预测及靶基因功能富集分析
基于已知的和新预测的miRNA,根据种子区与靶基因3’ UTR区的互补关系,结合自由能的情况预测miRNA的靶基因。将差异表达的miRNA在miRDB和TargetScan两个数据库进行靶基因预测。通过基因本体(gene ontology,GO)分析,找出差异表达的miRNA靶基因和哪些具体的功能条目联系最大,重点关注和炎症及肥胖相关的生物学过程条目。采用R软件包ClusterProfiler分析,根据<0.05且出现在相应富集条目中的差异表达基因数目(Count)>1的标准筛选显著富集的KEGG通路。
1.3.6 qPCR测定预测的靶基因相对表达量
取分离上清液后的htNSCs,提取RNA,用超微量分光光度计检测RNA样品浓度,取等质量RNA样品进行反转录。以为内参基因,采用qPCR法检测组和WT组小鼠之间相关靶基因mRNA的相对表达量。反转录、qPCR体系及程序按诺唯赞试剂盒构建。引物序列见表1。

表1 qPCR引物序列Table 1 Primer sequences used for qPCR in this study
1.4 数据统计与分析
所有数据采用GraphPad Prism 6.01软件进行分析,各组间数据的比较采用检验,<0.05表示差异显著。
2 结果与分析
2.1 小鼠基因型鉴定及分组结果
利用琼脂糖凝胶电泳分析PCR产物,结果如图1所示,2、5、8泳道在预期位置出现单一高亮条带,证明新生幼鼠为转基因小鼠,1、3、4、6、7、9泳道在预期位置无条带,证明新生幼鼠为野生型C57BL/6小鼠。

图1 新生幼鼠基因型鉴定结果Fig. 1 Genotype identification of newborn mice
2.2 小鼠htNSCs的鉴定结果
光学倒置显微镜下观察细胞形态,结果显示,该神经球外围分布有一层大小较均匀、折光性好的细胞(图2A),符合htNSCs形态学特征;将该细胞裂解后提取蛋白,经Western blotting鉴定,结果如图2B所示,细胞表达了神经干细胞的标志蛋白Nestin,即证明该细胞为htNSCs。

图2 小鼠htNSCs鉴定结果Fig. 2 Identification of hypothalamic neural stem cells (htNSCs)
2.3 htNSCs来源的外泌体鉴定结果
样本的粒径分布结果如图3A所示,样本粒径集中分布在110 nm左右,该粒径样本占比为97.9%,符合外泌体的粒径特征。经透射电子显微镜观察样本发现了茶托型或一侧凹陷的半球形的典型外泌体结构(图3B),且直径在110 nm左右,符合外泌体结构特征。通过Western blotting实验对外泌体标志蛋白CD63进行表达鉴定,结果如图3C所示,样本中有外泌体表面标志蛋白CD63表达,表明该样本中含有外泌体。综上,经多种方式鉴定,判定所提取样本为外泌体,可以继续进行后续实验。

图3 外泌体鉴定结果Fig. 3 Results of exosome identification
2.4 htNSCs来源外泌体差异表达miRNA聚类分析结果
层次聚类是一种广泛应用于miRNA表达数据分析的聚类方法,表达模式相似的miRNA和生物学性质相近的样本会聚到一个簇中。本实验根据组间比较获得的显著表达miRNA的CPM值进行聚类分析,树状图结构展示了miRNA和样本的表达模式的关系。由聚类热图可以发现,两组样本聚类明显(图4)。

图4 miRNA聚类热图Fig. 4 Cluster heat map of miRNAs
2.5 htNSCs来源外泌体差异表达的miRNA分析
火山图可以对不同样本组间差异表达基因进行图形化展示,使用两个条件筛选得到差异表达的miRNA并绘制火山图。由图5可以发现,与WT组相比,组显著上调的miRNA有65 条,显著下调的miRNA有40 条。
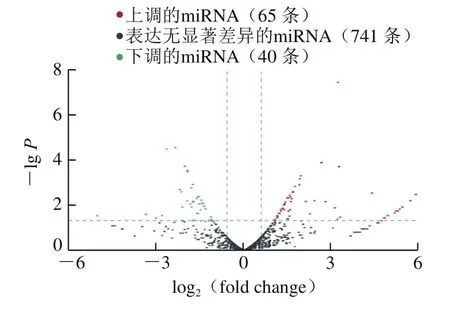
图5 htNSCs来源外泌体差异表达的miRNA火山图Fig. 5 Volcanic maps of differentially expressed miRNAs in exosomes derived from htNSCs
2.6 小鼠差异表达的miRNA靶基因预测
根据miRDB、Targetscan数据库资料及文献[18-23],筛选得到7 条可能与下丘脑炎症、脂质代谢及相关的miRNA,其靶基因及靶基因功能见表2。
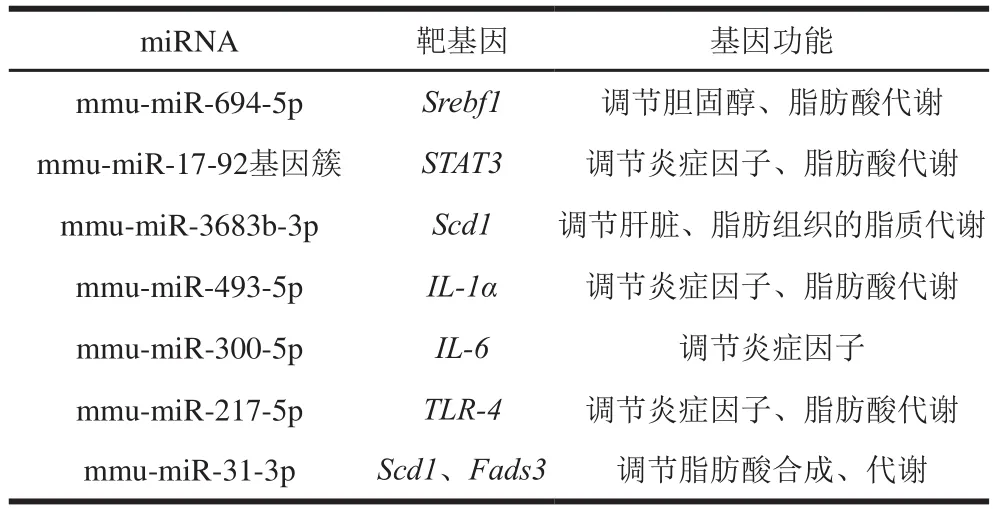
表2 htNSCs来源的外泌体中可能与下丘脑炎症及脂质代谢相关的miRNATable 2 miRNAs in htNSCs-derived exosomes that may be associated with hypothalamic inflammation and lipid metabolism
2.7 预测的靶基因mRNA相对表达量
对差异表达的miRNA的靶基因mRNA表达量进行qPCR测定,如图6所示,组与WT组相比,基因、-、表达量显著下调,相对表达量分别是0.264±0.014(<0.01)、0.762±0.038(<0.05)、0.211±0.100(<0.01);基因、、、、表达量极显著上调(<0.01),相对表达量分别是2.457±0.057、2.603±0.044、3.006±0.167、3.053±0.378、2.772±0.357。其中,TLR-4、IL-6、IL-1α均为炎症因子,其基因表达量降低,表明内源性的-3PUFAs可以抵抗炎症反应。基因、、、均为脂质代谢通路关键基因,表达量均有所上调,对脂质代谢具有重要调控作用。
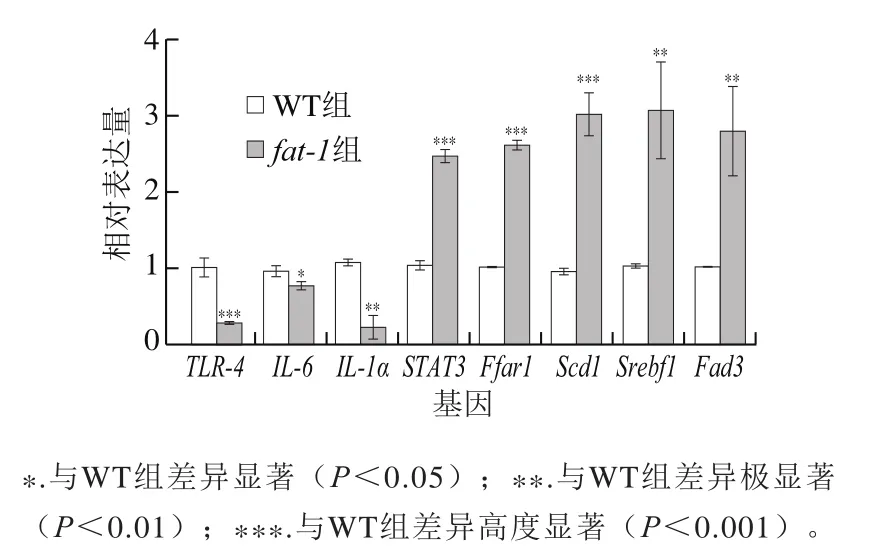
图6 htNSCs来源外泌体差异表达miRNA靶基因水平Fig. 6 Expression levels of differentially expressed miRNA target genes in htNSCs derived exosomes
3 讨 论
本课题组前期研究发现,小鼠体内3 PUFAs水平增加可以改善能量代谢控制小鼠的体质量,其机理可能是-3 PUFAs抑制下丘脑炎症因子、趋化因子的表达,缓解下丘脑炎症反应,维持下丘脑能量平衡,进而维持机体全身能量平衡抵抗肥胖的发生。吴聪等研究发现体内-3 PUFAs水平的增加可影响小鼠外周血外泌体中miRNA的表达,且与野生型C57BL/6小鼠相比有显著差异表达的miRNA所调控的靶基因大多集中在调控脂质代谢的分子通路中,这与本实验得到的结果相印证,本实验得到的具有差异表达的小鼠htNSCs来源的7 条外泌体miRNA均在炎症反应及脂质代谢中发挥重要作用。
miR-17-92基因簇编码6个miRNA,包括miR-17-5P、miR-18a、miR-19a、miR-19b、miR-20a和miR-92a-1,有研究发现转录因子c-Myc和E2F1可以直接调节miR-17-92基因簇的表达。此外,IL-6可以通过将与其启动子区域直接结合来调节miR-17-92基因簇的表达,说明miR-17-92基因簇与炎症之间存在潜在联系。本实验发现,与野生型C57BL/6小鼠相比具有差异表达的miR-17-92基因簇编码的6个miRNA均表现出差异表达,3个炎症因子相关基因、、的mRNA都出现表达量下降,表明-3 PUFAs可以通过改变htNSCs来源的外泌体中miRNA的表达,调节炎症因子相关基因的表达,从而抑制下丘脑炎症。
此外,这些差异表达的miRNA靶基因在脂质代谢中具有非常关键的作用。例如miR-694-5p的靶基因,该基因产物在AMPK信号通路中非常关键,研究发现miR-24可以通过胰岛素诱导基因1()/固醇调节元件结合蛋白1()通路轴调控PUFAs的生物合成。本实验中小鼠基因表达量极显著上调,说明差异表达的miRNA对基因具有调节作用,但是其具体分子机制还需要进一步研究。脂肪酰基去饱和酶(fatty acid desaturase,Fads)对碳链较长的不饱和脂肪酸的合成具有十分重要的作用,其中的上游基因是。硬脂酰辅酶A去饱和酶(stearoyl-CoA desaturase,SCD)的表达或活性改变可影响细胞内饱和脂肪酸与不饱和脂肪酸的比例。本实验中小鼠基因表达量也显著上调,表明差异表达的miRNA对于调节体内脂肪酸代谢具有重要作用。周飞等发现-3 PUFAs在能够抑制小鼠体质量增长的同时,还可以显著降低小鼠的血糖和血脂水平,也可以反映出-3 PUFAs对于脂质代谢的调节作用。
综上,内源性-3 PUFAs水平的增加影响了htNSCs来源的外泌体中miRNA的表达,差异表达的miRNA不仅可以调控、、等炎症因子基因的表达,还可以调控脂质代谢中的、等关键基因的表达,印证了本课题组前期小鼠体内增加的-3 PUFAs通过抑制下丘脑炎症、调节脂质代谢来抵抗肥胖的结论。这提示调节htNSCs的外泌体内miRNA可以改变下游相关基因的表达,可能是-3 PUFAs抑制下丘脑炎症和抵抗肥胖的机理之一。这些差异表达的miRNA有望成为诊断代谢异常与肥胖的参考标志物及潜在治疗靶标。接下来将对-3 PUFAs抑制下丘脑炎症和抵抗肥胖的具体机制开展进一步研究。

