子宫内膜癌脑膜转移1例诊治分析
王婷婷,苗杉,张倩,张春雨,杨华
河北大学附属医院肿瘤内科,河北保定 071000
子宫内膜癌是常见的女性生殖系统肿瘤,好发于绝经后女性,占女性生殖系统肿瘤的20%~30%。子宫内膜癌病理类型包括子宫内膜样癌、子宫浆液性癌、透明细胞癌、癌肉瘤等,以子宫内膜样癌最为常见。根据文献报道,子宫浆液性癌仅占子宫内膜癌的3%~10%,恶性程度高、侵袭能力强,更易发生远处转移[1-2]。多项研究显示,子宫内膜癌发生中枢神经系统转移非常少见[3-4]。子宫内膜癌发生脑膜转移更为罕见,仅占0.3%~1.4%[5]。从1970年至2021年发表的78篇文献共报道1 124例子宫内膜癌发生中枢神经系统转移,仅有3篇文献共报道4例子宫内膜癌发生脑膜转移[6-7],并且这些病例报告都没有详细记录患者的免疫组化及基因检测结果。现就1例子宫内膜癌脑膜转移的病例资料进行分析,探讨子宫内膜癌脑膜转移的临床特征、诊断及治疗方法,并对已经发表的文献进行回顾。
1 临床资料
患者女,62岁,主因发热伴头痛、恶心13 d于2021年11月9日在河北大学附属医院神经内科入院治疗。查体颈稍抵抗,颌胸2横指。血、尿、大便常规正常,大便潜血阴性。电解质和凝血全项正常。糖类抗原(CA)125 201.4 U/mL(正常范围0~35 U/mL),CA153 39.78 U/mL(正常范围0~25 U/mL),CA199 381.7 U/mL(正常范围0~39 U/mL),甲胎蛋白(AFP)、CA724、癌胚抗原(CEA)、骨胶素(CY211)、神经元特异性烯醇化酶(NSE)正常。头磁共振成像(MRI)+磁共振血管成像(MRA)+增强扫描提示老年性脑病。胸、腹、盆腔增强CT检查示胃底部胃壁略增厚。腰椎穿刺结果(2021年11月11日)示脑脊液压力280 mmHg(正常范围80~180 mmHg);脑脊液外观无色透明,细胞总数98×106/L[正常范围(0~8)×106/L],白细胞60×106/L[正常范围(0~8)×106/L],红细胞数38×106/L[正常范围(0~8)×106/L];异常脑脊液细胞学,可见成簇细胞体积增大,核大,核形态多变,核染色粗,可见核仁,核质比例失调,胞质嗜碱性,细胞形态及特点疑似异型细胞(47%),见图1;脑脊液蛋白0.61 g/L(正常范围0.2~0.4 g/L),葡萄糖1.5 mmol/L(正常范围2.5~4.4 mmol/L),乳酸4.7 mmol/L(正常范围0~1.3 mmol/L),腺苷脱氨酶2.1 U/L;脑脊液抗酸杆菌阴性,隐球菌阴性,脑脊液细菌培养阴性。
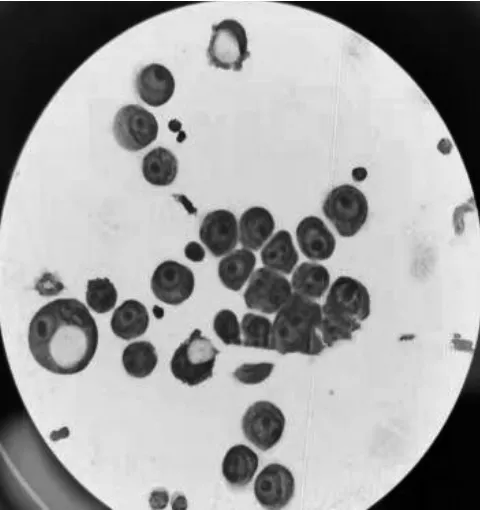
图1 2021年11月11日患者脑脊液细胞学检测结果
患者2021年1月因阴道不规则出血1月余就诊于河北大学附属医院妇科,诊断为子宫内膜癌。颈胸腹增强CT未见转移征象。2021年1月18日行腹腔镜筋膜外全子宫+双附件切除术+盆腔淋巴结切除术+腹主动脉旁淋巴结切除术+肠粘连分解术,术后病理显示全子宫双附件低分化癌,大部分为子宫内膜浆液性癌,另见少许子宫内膜样癌,侵及子宫浆膜及子宫颈肌壁全层,另见大量脉管癌栓;右侧卵巢可见少量癌组织;淋巴结可见转移癌(左侧盆腔4/9,右侧盆腔7/12,腹主动脉旁3/4);左侧圆韧带纤维脂肪肌组织可见散在癌细胞。免疫组化:雌激素受体阴性,孕激素受体阴性,Ki-67 70%(阳性),p53 90%(阳性),波形蛋白局灶阳性,WT-1阴性,Pax-8阳性,p40阴性。诊断:低分化浆液性子宫内膜癌,FIGO分期分期ⅢC期。术后给予白蛋白结合型紫杉醇(260 mg/m2,体表面积1.65 m2)+卡铂(AUC=5)化疗1周期,贝伐珠单抗+紫杉醇+卡铂全身化疗5周期(患者于外院治疗,未能提供化疗剂量,第2周期后患者因乏力、纳差改用多西他赛),于2021年8月—9月行放疗28次,靶区及剂量不详。
考虑患者子宫内膜癌脑膜转移,转入河北大学附属医院肿瘤内科继续治疗。再次行腰椎穿刺术并完善基因检测及免疫组化检查。患者脑脊液压力升至320 mmH2O,脑脊液查见癌细胞。免疫组化:角蛋白CK阳性、CK7阳性、WT-1阴性、p16阳性、人表皮生长因子受体2(Her-2)阴性。加做子宫内膜病理免疫组化:BRAFV600E阴性、MLH1阳性、MSH2阳性、MSH6阳性、PMS2局灶弱阳性、Her-2阴性。子宫内膜癌组织基因检测:AKT1基因错义突变、丰度16.06%,TP53基因错义突变、丰度9.79%。脑脊液基因检测:AKTI基因错义突变、丰度69.83%,TP53基因错义突变、丰度87.22%,MYC基因拷贝数扩增CN 10.0,RICTOR基因拷贝数扩增CN 6.3。血浆基因检测:AKTI基因错义突变、丰度6.15%,TP53基因错义突变、丰度3.36%,BRCA1、BRCA2基因未突变。子宫内膜组织PD-L1(TPS 5%),CPS评分10分。PET-CT检查示大脑镰及小脑周围脑膜代谢不均匀升高,最大标准摄取值15.2~18.0,相应部位未见明显异常密度影(图2);胃底部胃壁弥漫性增厚,高代谢,胃小弯侧、肝门处、后纵隔食管旁见多发淋巴结高代谢,考虑转移。患者胃部病理及免疫组化检查结果与子宫内膜癌相似。诊断为子宫内膜癌术后脑膜、胃、胃小弯侧、肝门处、后纵隔食管旁淋巴结转移。
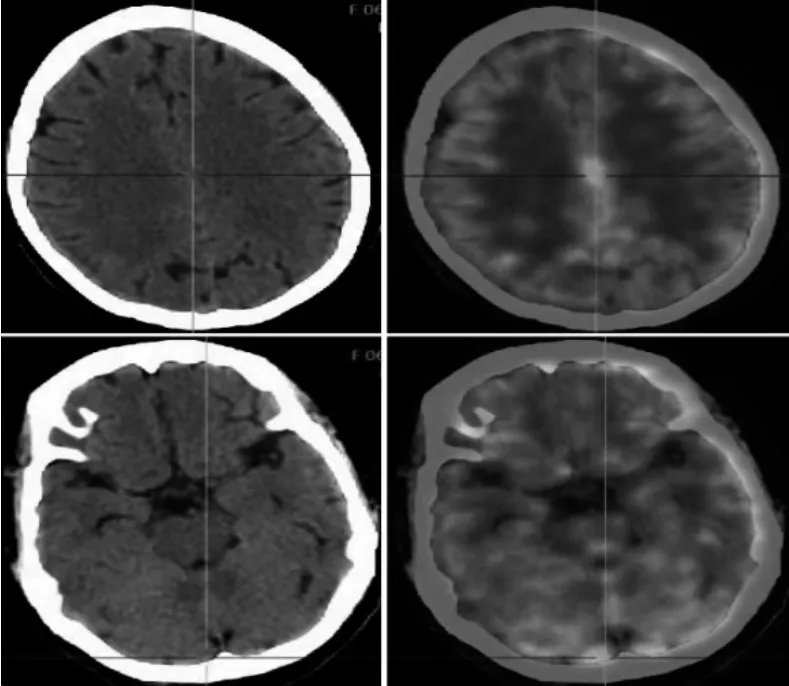
图2 患者大脑镰及小脑周围脑膜PET-CT检查影像
患者接受鞘内甲氨蝶呤注射治疗3次(前2次为10 mg,第3次为5 mg),同时给予甘露醇联合地塞米松降颅内压治疗。第1次鞘内化疗于2021年11月22日进行,当时测脑脊液压力255 mmH2O,过程顺利,治疗后头痛、恶心症状缓解,因患者出现Ⅱ度骨髓抑制,给予人粒细胞刺激因子促进骨髓功能恢复并推迟鞘内化疗。第2次鞘内化疗于2021年12月1日进行,此时脑脊液压力降至80 mmH2O,镜下可见脑脊液中细胞数较前明显减少,但患者出现Ⅲ度骨髓抑制。第3次鞘内化疗于2021年12月9日进行,因患者骨髓储备功能差,给予甲氨蝶呤5 mg鞘内注射。患者脑脊液检查显示细胞数无减少(图3):细胞总数530×106/L、白细胞数230×106/L、红细胞数300×106/L;单核细胞16%、多核细胞13%、其他分类不明细胞71%。患者脑脊液压力降至30 mmH2O,考虑低颅压,停用甘露醇,治疗后患者头痛、恶心症状缓解。患者因经济困难,拒绝进一步治疗,自行出院。

图3 患者三次脑脊液细胞涂片镜下影像
2 讨论
恶性肿瘤向脑膜转移时称为脑膜转移瘤,又称肿瘤性脑膜炎,好发于乳腺癌、小细胞肺癌、黑色素细胞瘤等[3]。来源于子宫内膜癌的脑膜转移瘤非常罕见。我们通过Pubmed仅检索到4例子宫内膜癌脑膜转移的病例,这几例病例报告均未涉及患者病变组织的免疫组化及基因检测结果[7]。根据子宫内膜癌分子检测中国专家共识(2021年版)[8],应遵循以下顺序对子宫内膜癌进行分子分型:首先考虑POLE基因是否发生致病变异,若POLE基因为野生型或未发生致病突变时,再评价MMR/MSI状态,若上述均无异常,进一步依据p53状态进行判断。本例患者分别进行了血液、脑脊液、原发肿瘤部位的基因检测及免疫组化检查,患者子宫内膜癌病理类型为低分化浆液性子宫内膜癌,59%~93%的此型患者会发生TP53基因突变,这与患者的分子分型相呼应。本例患者分子分型为p53突变型,除此之外,患者还存在AKT1基因突变,同时也提示肿瘤更易发生远处转移。
子宫内膜癌常见的转移途径为淋巴结转移,盆腔淋巴结为常见转移部位,如髂总、髂内和髂外淋巴结等,其次是腹膜后淋巴结[9]。另一种常见的转移途径为直接蔓延,肿瘤可蔓延至宫颈、阴道、子宫附件、腹腔等部位,血行转移较少见,多转移至肺、肝、骨等[10]。国内外学者一致认为,发生脑膜转移的机制主要有四种:由先前脑实质转移引起的脑膜播散,血行转移,硬膜下或硬膜外肿瘤的直接蔓延,从与中枢神经系统相邻的部位直接扩散[11]。本例患者除脑膜以外的中枢神经系统或与中枢神经系统相通部位未发现肿瘤,因此考虑肿瘤通过血行转移的可能性大。有学者认为,椎静脉丛可能是引起中枢神经系统转移的途径,其与腹、胸、腰、骶等处静脉相吻合,无静脉瓣,有可能引起上述部位病灶的中枢神经系统转移[12]。子宫内膜癌发生脑膜转移的危险因素并不明确,国外文献普遍认为子宫内膜癌晚期和病理分级3级的患者更易发生脑转移。除此之外,深部肌层浸润、脉管瘤栓也是较强的预测因子[5,13]。
出现脑膜转移时最常见的临床症状与颅内压升高有关,如头痛、恶心、呕吐等。MORONEY等[14]通过对12例子宫内膜癌脑转移的患者进行回顾性研究发现,头痛为主要症状(41.7%),少数患者还有颅内神经受损的症状,如复视、视力减退、听力下降、精神状态改变等。DIVINE等[15]也得出了相似的结论,发现以头痛为主要症状就诊的患者占37%。一项基于SEER数据库的子宫内膜癌脑转移相关研究中,头痛患者占27.4%,高于乏力(22.1%)、晕厥/癫痫(12.4%)、视力障碍(9.7%)、共济失调(8.8%)、语言障碍(7.1%)、头晕(7.1%)、精神状态改变(7.1%)、意识模糊(6.2%)、偏瘫(6.2%)、恶心、呕吐、麻木、构音障碍等[11]。脑膜转移瘤的临床表现多变,因为肿瘤细胞可以随脑脊液被运送至整个神经系统,并以片状或多灶性的方式弥漫浸润中枢神经系统。
虽然子宫内膜癌发生脑转移罕见,但由于检查方法、治疗手段的多样化和治疗方式的规范化,子宫内膜癌患者生存期延长,子宫内膜癌脑膜转移的病例较前增加。头部MRI平扫+增强扫描是诊断脑膜转移瘤最常用的影像学检查手段,敏感度为65%~75%,通常表现为脑膜异常强化,根据部位可分为硬脑膜—蛛网膜、软脑膜—蛛网膜下腔和以上两种均累及的混合型,其中以硬脑膜—蛛网膜异常强化最为常见[16-18]。本例患者头颅MRI+增强扫描未见异常,而通过脑脊液细胞学检查确诊。脑脊液细胞学是诊断肿瘤性脑膜炎的“金标准”,第1次诊断阳性率为44% ~67%,重复3次以上确诊率在84% ~91%[17]。近年来,18F-FDG PET-CT检查在神经系统肿瘤中的应用效能也得到了认可,脑膜转移瘤常表现为沿脑沟分布的线条样、片样或弥漫性异常代谢增高区[19]。本例患者头部PET-CT影像为沿脑沟分布的线条样异常代谢增高。
子宫内膜癌脑膜转移患者的预后很差,伴有全身其他部位转移的患者预后更差,中位生存期为2~4个月,未经治疗的患者中位生存期为4~6周[14]。我们通过Pubmed检索到的4例子宫内膜癌脑膜转移瘤病例中,已知有3例预后极差,生存期短,亦未能从治疗中获益。更早出现的中枢神经系统转移往往提示着更差的预后,表明原发肿瘤具有更强的侵袭性。年龄、体能状态、原发肿瘤的控制情况、合并颅外转移、脑转移的位置及肿瘤体积、脑转移的治疗方式等因素都会影响患者预后[3,5,7,17-18,20-22]。 除 此 之 外 ,有 学 者[15]还 发 现 ,血CA125<81 U/mL是中枢神经系统转移患者有利的预后因素。
多种方式联合治疗有助于提高子宫内膜癌脑膜转移瘤患者的生存率,但目前尚无统一标准[18,22]。迄今为止,病例报告中大多数病例多采用鞘内化疗和全脑放疗的联合治疗。治疗方法还包括全身化疗、免疫治疗、靶向治疗、外科治疗等。有研究报道脑转移病灶中血管内皮生长因子A表达量高于原发肿瘤病灶,这说明抗血管生成在脑转移治疗中的价值值得进一步探究[15]。治疗方式的选择应根据患者的体能状态、肿瘤等级、全身疾病负担和神经系统状况综合考虑。治疗的目标是缓解患者症状和延长生存期,但对于预期寿命短的患者,支持治疗为主要目的。最常用的鞘内化疗药物有甲氨蝶呤、阿糖胞苷和噻替哌[23-25],而本例患者未能从甲氨蝶呤中获益。对于存在颅外转移的患者应考虑同时给予全身化疗,但大多数药物不能通过血脑屏障[7]。由于本例患者体能状态差,未能给予头颅放疗及全身化疗等联合治疗,这可能导致患者预后较其他患者更差。
总之,子宫内膜癌脑膜转移临床罕见,由于发病率低,患者的生存期短,国内外尚无专门的临床试验,因此,针对子宫内膜癌脑转移瘤尚无统一的治疗标准。随着子宫内膜癌患者生存期的延长,脑膜转移瘤的发病率较前升高,需要探索更为标准的治疗方案来改善患者预后。

