米曲霉协同抗酸化菌剂制备餐厨垃圾氨基酸液态肥
贾 璇,李雪琪,刘晓佩,窦润琦,贾晨浩,高 霞,李鸣晓*
1. 北京工商大学,国家环境保护食品链污染防治重点实验室,北京 100048
2. 北京工商大学,中国轻工业清洁生产和资源综合利用重点实验室,北京 100048
3. 中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012
随着我国“无废城市”管理理念和“垃圾分类”政策的实施,推动生活垃圾源头减量化、资源化迫在眉睫[1]. 餐厨垃圾是城市生活垃圾的重要组成部分,富含糖类、蛋白质、脂肪等有机物及丰富的微量元素[2],易腐败酸化,产生渗滤液、恶臭气体等二次污染[3],因此餐厨垃圾就地快速资源化需求迫切.
目前餐厨垃圾资源化方式主要有减量脱水、好氧堆肥和液态肥制备等. 其中,通过接种功能微生物制备餐厨垃圾液态有机肥[4-5],可实现餐厨垃圾高值化利用、土壤改良及碳汇,在改善土壤养分状况的同时提高作物产量[6-8]. 任连海等[9]采用餐厨垃圾湿热处理脱出液,通过接种巨大芽孢杆菌,制备解磷液态菌肥,活菌数远高于农用微生物菌剂的标准. 郭新愿等[10]用餐厨垃圾废水作为发酵基质生产液态褐球固氮菌肥,可提高土壤的总氮水平.
餐厨垃圾制备液态有机肥过程中,易降解有机物水解酸化与大分子物质(蛋白质、淀粉、脂肪等)降解转化不同步[11],是限制其高值化的关键限速步骤.笔者所在团队前期自主筛选了具有抗酸化功能的复合菌剂,发现该抗酸化复合菌剂可以有效抑制堆肥前期易降解有机物的快速矿化和小分子酸形成,在限制矿化的同时可实现好氧发酵体系的酸度调节[12-13].
米曲霉(Aspergillus oryzae)是目前真菌发酵产酶最重要的菌株之一,能通过固态发酵产生大量蛋白酶和淀粉酶,米曲霉的高蛋白质、淀粉分解能力可有效降解转化餐厨垃圾中的大分子物质[14-15]. Pleissner等[16]通过添加泡盛曲霉和米曲霉,研究餐厨垃圾中大分子物质的转化,结果表明,处理48 h后餐厨垃圾中大分子物质被降解为葡萄糖、游离氨基氮和磷酸盐,淀粉转化率为80%~90%. 张帅等[17]接种米曲霉孢子悬浮液至餐厨垃圾培养基中,产物的淀粉酶活性最高可达438.4 U/g. 汪刚慧等[18]发现,未接种米曲霉的餐厨垃圾只有极低的蛋白酶和淀粉酶活性,而经过米曲霉发酵后餐厨垃圾中的蛋白酶和淀粉酶活性显著上升,分别提升了73.37和24.52倍.
该研究将自主筛选的抗酸化复合菌剂和米曲霉联用,旨在实现餐厨垃圾全量化过程中易降解有机质与大分子物质的同步转化,制备富含氨基酸的液态有机肥. 通过不同温度、初始pH、菌剂接种量的研究,结合高通量测序,阐明蛋白质、淀粉等物质的转化规律,探究抗酸化复合菌剂和米曲霉协同降解餐厨垃圾的工艺条件,以期为实现餐厨垃圾高值化利用提供技术支撑.
1 材料与方法
1.1 试验材料
1.1.1餐厨垃圾
餐厨垃圾取自北京某大学食堂,分拣出餐厨垃圾中骨头、塑料袋等杂质,将剩余部分混合打浆,过20目(0.850 mm)筛,置于4 ℃冰箱备用[19]. 餐厨垃圾基本理化指标:含水率为85.8%±2.0%,挥发性固体(VS)含量为16.54%±0.5%,pH为4.3±0.1,蛋白质含量为(2.23±0.13) g/L(湿基),淀粉含量为(28.32±1.0)g/(100 g)(湿基).
1.1.2微生物菌剂
抗酸化复合菌剂是笔者所在课题组从餐厨垃圾好氧发酵酸化阶段分离筛选制备的复合菌剂[20]. 试验所用米曲霉CGMCC 3.442 7购于中国微生物菌种保藏管理委员会普通微生物中心.
1.2 试验设计
1.2.1酶源制备
将平板培养的米曲霉收集至无菌瓶中,稀释后置于4 ℃冰箱保存备用,利用稀释平板计数法测得米曲霉CGMCC 3.443 7(简称“米曲霉C”)的孢子悬浮液浓度为85个/mL. 将1 mL孢子悬浮液接种到50 g餐厨垃圾中,38 ℃下培养48 h,获得富酶产物.
1.2.2正交试验
餐厨垃圾采用正交试验研究不同处理条件对功能菌剂快速降解餐厨垃圾的影响. 选取不同温度、初始pH、功能菌剂接种量设计三因素三水平正交试验(见表1). 功能菌剂包括抗酸化复合菌剂和富酶产物两部分,抗酸化复合菌剂接入量1%、10%、20%(V/V)分别对应富酶产物添加量1%、10%、20%(m/V). 所有试验组和对照组均在相同条件下设计2组平行试验.

表1 菌剂液态发酵条件试验设计Table 1 Experimental design of bacteria liquid fermentation conditions
取餐厨垃圾25 g,与去离子水按照质量比1∶1混合均匀后,将初始pH分别调节至6.0、6.5、7.0,灭菌后分别接种等量的富酶产物和抗酸化复合菌剂,置于不同温度、120 r/min下培养168 h,每隔24 h取样测定指标.
1.3 分析指标与方法
粗蛋白浓度根据GB/T 6432-2018《饲料中粗蛋白的测定 凯氏定氮法》测定;游离氨基酸浓度采用茚三酮比色法[21]测定;淀粉浓度采用酸水解法和蒽酮法[22]测定;溶解性碳水化合物浓度采用蒽酮法[23]测定. 采用SPSS 22.0软件对数据进行相关性分析.
微生物多样性分析:取0.5 g抗酸化复合菌剂样品,按照the E.Z.N.A.® soil DNA Kit(Omega Bio-tek,Norcross, GA, 美国)步骤提取总RNA,在-20 ℃下进行保存. 纯化后的基因组作为聚合酶链式反应(PCR)的模板,选用16S rRNA基因V3~V4区通过引物〔338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')〕进行PCR反应. PCR反应体系:10×PCR Buffer 4 μL,dNTP (2.5 mmol/L) 2 μL,正向引物(5 μmol/L) 0.8 μL,反向引物(5 μmol/L) 0.8 μL,模板(总DNA) 10 ng. PCR产物用AxyPrepTMMag PCR Normalizer做归一化处理.
选取A1B1C1(反应温度为38 ℃、初始pH=6.5、功能菌剂接种量1%的试验组记为E组)和A2B2C3(反应温度为55 ℃、初始pH=6.0、功能菌剂接种量20%的试验组记为F组)试验组在0、48、72、144 h的样品进行高通量测序,分别记为E0、E48、E72、E144和F0、F48、F72、F144.
2 结果与讨论
2.1 pH的变化
餐厨垃圾中易降解有机质被快速降解时,易造成小分子酸积累,导致pH下降,而餐厨垃圾发酵过程中pH的变化对于功能菌剂生长繁殖有重要影响. 如图1所示,各处理组的pH均高于4.5. 餐厨垃圾处理过程中,除处理组1外,其他组pH整体均呈先下降后趋于稳定的趋势. 初始pH为7的处理组7、8、9的pH于24 h时分别降至5.16、5.42、5.17,pH降幅相对较大. 温度为55 ℃的处理组2、6、7,pH于48 h后均低于5.0,且波动不大,可能是因为高温不适宜抗酸化复合菌剂生长,小分子有机酸的降解受到抑制.处理组1在发酵至168 h时pH突升至7.98,可能是因为菌体自溶,核酸类物质外泄导致pH发生变化.处理组3、4、5、8、9在反应120 h后pH为5.4~5.9,趋于一致. 这表明在中温(38 ℃)条件下,抗酸化复合菌剂可以有效调控体系的pH波动,初始pH对发酵过程中pH的影响不显著.
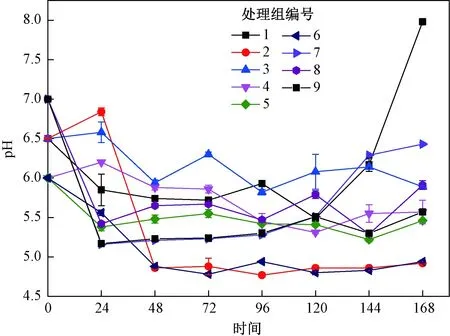
图1 正交试验中各试验组pH随时间的变化情况Fig.1 Changes in pH over time for each experimental group in the orthogonal test
2.2 淀粉和溶解性碳水化合物的变化
功能菌剂协同降解餐厨垃圾过程中,餐厨垃圾中的淀粉会在微生物作用下转化为易于土壤利用的溶解性碳水化合物,从而达到提高肥力的效果. 如图2所示,各处理组中淀粉转化率均高于30%. 其中,处理组3中淀粉浓度的降幅较大,为99.12%,溶解性碳水化合物浓度也达到了7.15 g/L. 因为米曲霉分泌淀粉酶活的较佳温度为20~30 ℃,所以相同接种量的处理组6、9,淀粉转化率分别为30.54%、52.55%,这可能是受温度的影响. 在相同接种量条件下,20 ℃发酵的处理组3的淀粉转化率高于38、55 ℃下的处理组6、9. 同样地,20 ℃发酵下处理组4、8的淀粉转化率分别略高于等接种量的处理组7、2、5. 处理组1淀粉转化率为95.58%,可能是抗酸化复合菌剂中的芽孢杆菌在适宜条件下发挥了显著的降解淀粉大分子的作用. 但处理组1溶解性碳水化合物浓度相较于反应初始时刻仅提高了31%,这与微生物利用还原糖、多糖等物质进行自身生命活动有关. 此外,溶解性碳水化合物会参与腐殖质形成的美拉德反应[24]等过程,这也会导致其浓度降低[16].

图2 不同处理对淀粉转化率及溶解性碳水化合物浓度的影响Fig.2 Effect of different treatments on starch conversion rate and dissolved carbohydrate concentration
2.3 蛋白质和游离氨基酸的变化
餐厨垃圾富含蛋白质,可利用功能微生物将其降解为游离氨基酸,增加小分子可溶物质的浓度. 功能菌剂协同降解餐厨垃圾过程中蛋白质和游离氨基酸的变化情况见图3. 结果表明,9个处理组中蛋白质转化率均高于18%. 其中处理组2在55 ℃下蛋白质转化率最高,为58.97%,有研究表明,55 ℃时米曲霉酶源产物中蛋白酶活性较高[18],具有较高的蛋白质转化能力. 相同温度下处理组6、7的蛋白质转化率分别为48.29%和33.10%,这与处理组7的酶源产物接种量低于处理组6有关. 接种量最少的处理组1、4、7的蛋白质转化率较低,其中处理组4最低,仅为18.01%.

图3 不同处理对蛋白质转化率及游离氨基酸浓度的影响Fig.3 Effect of different treatments on protein conversion rate and free amino acid concentration
游离氨基酸含量变化分析显示,处理组1最高,且在反应至144 h时达到最高值(4.09 g/L),是处理组2的1.6倍,推测38 ℃、菌剂接种量为1%的条件有利于米曲霉生长且蛋白酶稳定性高,相比于其他条件更有利于蛋白质降解和游离氨基酸的赋存. 处理组2、6、8的中游离氨基酸浓度较低,可能是因为菌剂接种量达到了10%、20%,液态发酵过程中微生物大量繁殖,各种生化反应逐渐强烈,氨基酸作为营养成分,在发酵后期逐渐被消耗,因而游离氨基酸浓度下降.
2.4 方差分析
由表2可见,菌剂接种量对溶解性碳水化合物及游离氨基酸浓度均有显著影响(P<0.05),温度仅对游离氨基酸浓度有显著影响(P<0.05),初始pH对二者的影响均不显著(P>0.05).
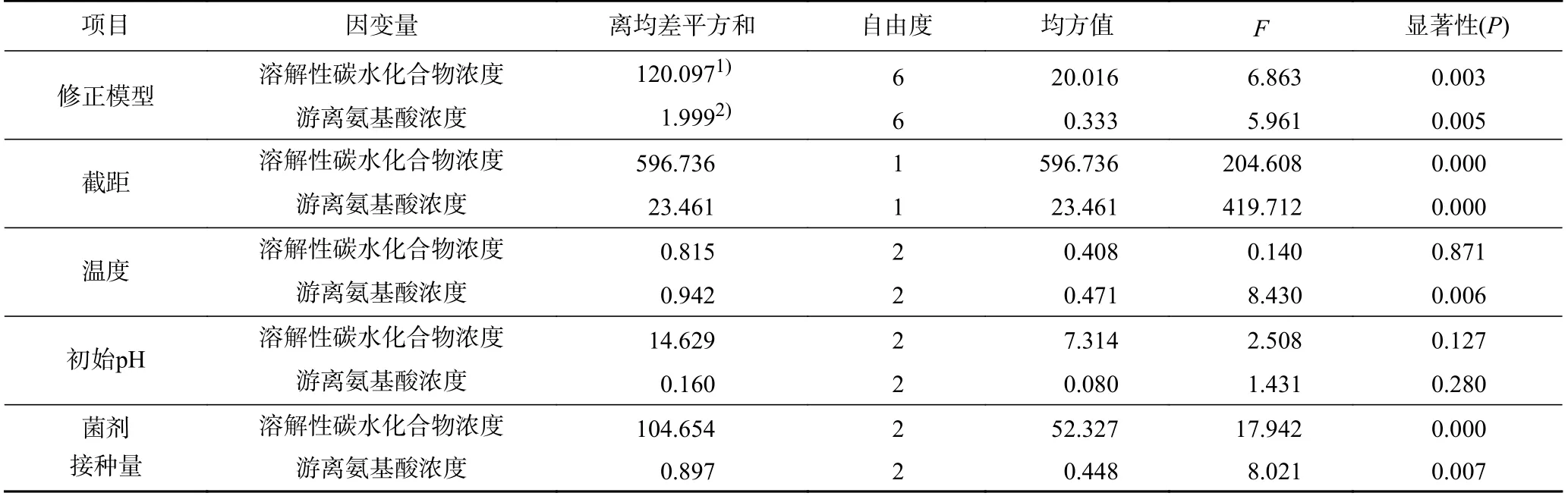
表2 液相指标方差分析Table 2 Analysis of variance
功能菌剂在餐厨垃圾的降解过程中起到主要作用,可有效促进物质转化;温度是微生物生长与产酶的重要影响因子,直接影响酶活性和物质降解效率.因此,影响餐厨垃圾降解的因素依次是菌剂接种量、温度、初始pH.
2.5 功能菌剂协同降解餐厨垃圾过程中微生物群落组成与演替
餐厨垃圾降解反应系统是一个相对复杂的体系,微生物作为主要功能因素,种类繁多、数量巨大,环境因子的改变、复合菌剂的性质等都会对微生物的生命活动产生影响. 因此,要真正实现对餐厨垃圾降解工艺的优化,提高处理能效,还需要对餐厨垃圾降解不同阶段的微生物多样性、群落结构等方面进行更加深入的研究,从而在微生物学的角度上揭示其降解机理.
2.5.1不同处理下微生物多样性
所有样品的覆盖率均高于99.9%,表明测序深度足以真实反映样品的微生物多样性. 如表3所示,从Shannon-Wiener和Simpson指数来看,E组和F组在反应过程中细菌群落多样性均呈先降低后升高的趋势,其中E组在反应144 h时(E144)多样性最高. 从ACE和Chao1指数来看,E组在反应过程中细菌群落丰度逐渐降低,F组细菌群落丰度呈波动趋势. 从Simpson指数来看,E组在反应至72 h时(E72)真菌物种多样性最高;从Chao指数来看,E组反应至48 h时(E48)样品中的真菌群落丰度最高,随后逐渐降低(见表3).

表3 细菌及真菌丰富度和多样性Table 3 Bacterial and fungal abundance and diversity
2.5.2不同处理下微生物群落组成
如图4(a)所示,样品在细菌门水平上的微生物主要有 Firmicutes和Proteobacteria,且所有样品的Firmicutes相对丰度均在97.94%以上. Firmicutes和Proteobacteria可以降解底物中的物质,如纤维素、蛋白质、果胶等. 其中,Firmicutes由于其厚壁结构、潜在的水解能力而在群落中占据主导地位[25].
如图4(b)所示,随着反应的进行,E组Bacilli的相对丰度不断升高,达到99.98%,表明Bacilli具有良好的适应能力.Bacilli可以将大分子(如纤维素淀粉和蛋白质)降解为小分子[26],有利于餐厨垃圾的发酵. F0样品在属水平上的微生物主要由Bacilli和Terribacillus组成,相对丰度分别为30.99%、68.50%,在其他处理时间上,F组在属水平上的微生物主要由Bacilli组成,相对丰度趋于99%.
如图4(c)所示,E组和F组在真菌门水平上的微生物主要有Ascomycota和Basidiomycota. Ascomycota和Basidiomycota的作用包括降解有机质、产生有益代谢产物等,是生态系统中的重要分解者[27-29]. E48样品中Ascomycota和Basidiomycota的相对丰度分别为41.07%、56.84%. 随着试验进行,E组中Ascomycota的相对丰度越来越高,在E144样品中达到了97.35%.在F组中,F0样品中Ascomycota的相对丰度为99.37%,随着试验进行,Ascomycota和Basidiomycota的相对丰度不断波动,F72样品中二者分别为31.29%、65.83%.
如图4(d)所示,从属水平对真菌进行分析,发现各处理组的真菌相对丰度差异性较大,E48组中未鉴定出的伞菌为优势菌属,E72、E144、F0样品中优势真菌均为曲霉属,相对丰度分别为82.73%、95.28%、97.34%. F组中,只有F0样品中优势菌属为曲霉属,相对丰度达到97.34%;F48、F72、F144样品中菌属复杂,推测55 ℃不适合曲霉属生长,随着试验进行,曲霉属不再是优势菌属,其他各类菌属大量繁殖.

图4 不同处理下微生物群落的变化Fig.4 Changes in microbial communities under different treatments
2.5.3相关性分析
选择温度、初始pH、菌剂接种量、氨基酸、溶解性碳水化合物等与微生物相对丰度做Pearson相关性分析. 由图5可见,在环境因子与微生物群落之间的关系中,温度、初始pH、菌剂接种量与优势微生物相对丰度存在显著的正或负相关关系,且温度、菌剂接种量与微生物相对丰度之间呈现一致的相关性.
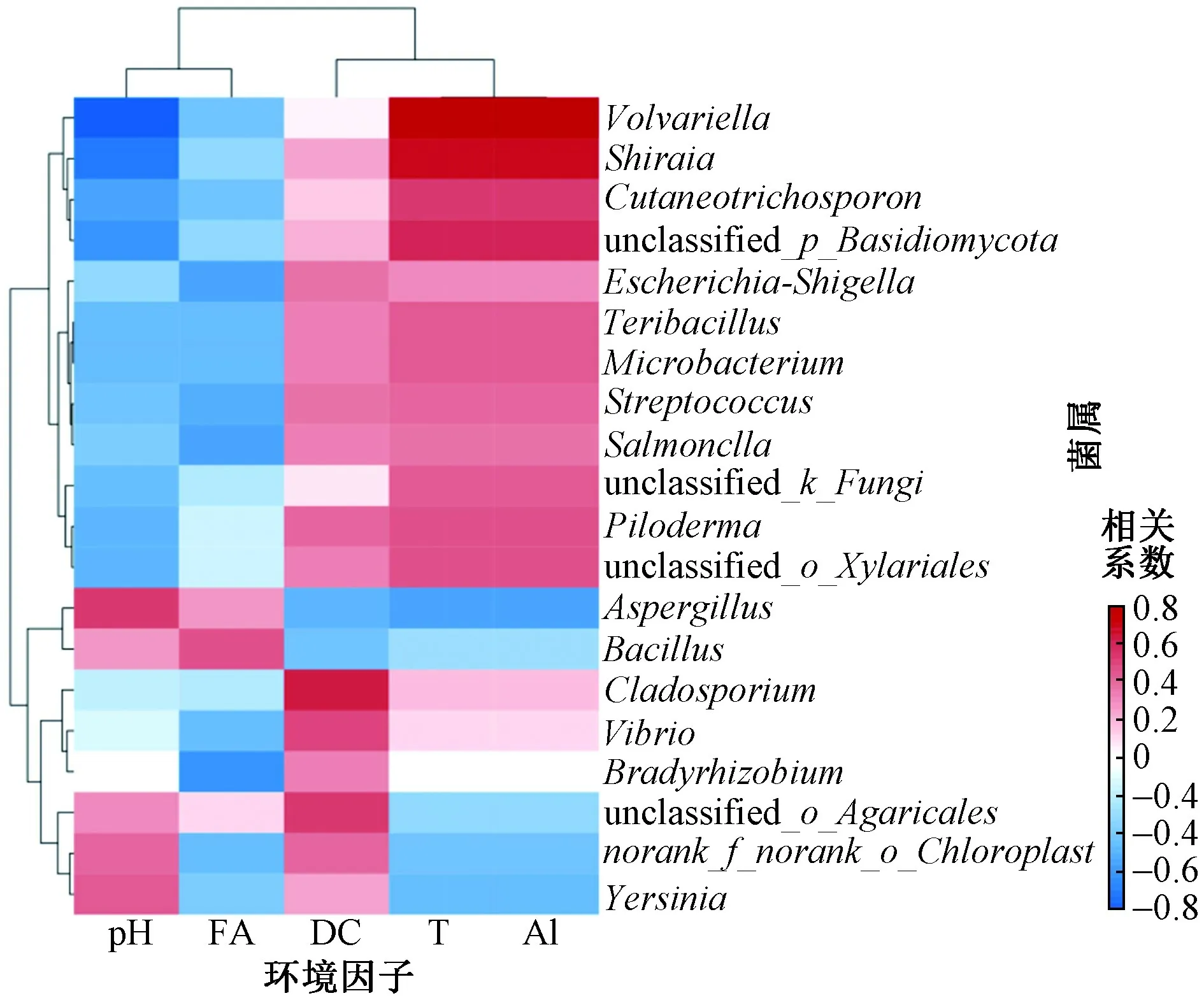
图5 环境因子与微生物群落的响应关系Fig.5 Responses between environmental factors and microbial communities
由图5可见,Bacillus、Aspergillus的相对丰度与游离氨基酸浓度之间具有较强的相关性.Bacillus可通过分泌的蛋白酶、肽酶等将蛋白质分解为游离氨基酸,Bacillus相对丰度与游离氨基酸浓度之间的相关系数为0.452 4,降解过程中Bacillus对游离氨基酸浓度的升高有着重要作用. 有学者[30]发现,Aspergillus在黄酒发酵中具有较强的产酶能力,生成的蛋白酶会将蛋白质分解形成氨基酸.Bradyrhizobium是氮代谢的“枢纽”,是一种反硝化细菌,在生长过程中会利用消耗游离氨基酸[31],所以二者相关系数小于-0.5.
除Bacillus与Aspergillus外,溶解性碳水化合物含量与其他菌属相对丰度均呈正相关,其中与Agaricales、Cladosporium、Vibrio三种菌属相对丰度的相关性较为显著.Agaricales隶属于Basidiomycota,能产生降解木质纤维素相关的碳水化合物活性酶和氧化还原酶,有研究[32]证明,Agaricales相关真菌都具有一定降解纤维素的潜力.Cladosporium可分泌内切葡聚糖酶[33],对餐厨垃圾中蔬菜茎叶、果皮等具有较强的降解能力.Vibrio能产生葡萄糖苷酶、糖化酶,促进淀粉降解为葡萄糖等小分子碳水化合物[34].
3 结论
a) 温度为38 ℃、初始pH为6.5条件下,抗酸化菌剂与米曲霉酶源产物等比例接种1%时,好氧发酵制备的液态有机肥游离氨基酸赋存最佳,淀粉和蛋白质转化率分别达到94.49%和32.52%.
b) 微生物群落演替与代谢转化的相关分析表明,Bacillus和Aspergillus作为发酵过程中的优势菌属,其相对丰度与游离氨基酸浓度之间具有较强的相关性,有效促进了蛋白质向游离氨基酸的转化.Agaricales、Cladosporium、Vibrio在淀粉的降解和溶解性碳水化合物的赋存中起到重要作用.
c) 抗酸化菌剂和米曲霉酶源产物协同降解餐厨垃圾,制备富含氨基酸的液态有机肥,可用于土壤和作物改良,具有重要的应用价值.

